






还剩15页未读,
继续阅读
所属成套资源:九年级化学下册单元课件鲁教版专题
成套系列资料,整套一键下载
九年级化学下册第七单元常见的酸和碱专项训练1酸和碱的性质课件鲁教版
展开
这是一份九年级化学下册第七单元常见的酸和碱专项训练1酸和碱的性质课件鲁教版,共23页。
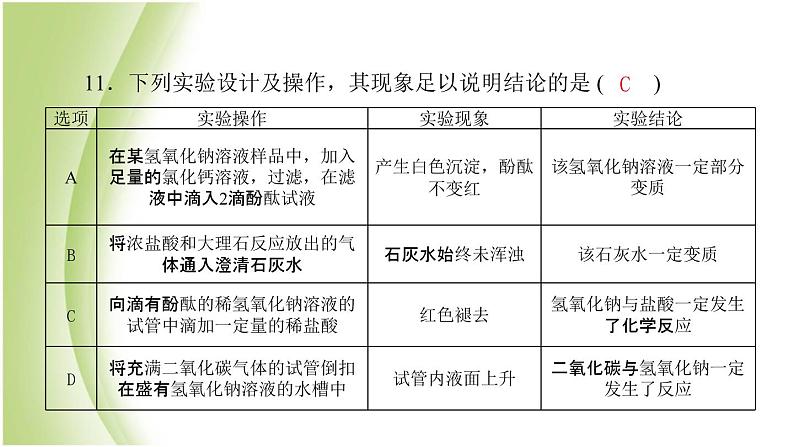
专项训练1 酸和碱的性质1.下列溶液能使紫色石溶液变红色的是( )A.NaCl溶液 B.澄清石灰水C.稀盐酸 D.KNO3溶液2.下列描述属于氢氧化钙化学性质的是( )A.白色固体 B.微溶于水C.溶液有滑腻感 D.能与CO2反应CD3.下列物质长期露置在空气中质量增大但没变质的是( )A.小苏打 B.氢氧化钠固体C.浓盐酸 D.浓硫酸4.关于硫酸的说法错误的是( )A.稀硫酸与锌反应可制得氢气B.稀硫酸可用于除铁锈C.可将水注入浓硫酸中进行稀释D.浓硫酸可用来干燥氢气DC5.利用如图所示的实验探究物质的性质,下列叙述错误的是( )A.②处有气泡,③处无现象B.①②④⑤处有明显现象,则M可能为稀盐酸C.⑤处固体明显减少,则M可能为稀硫酸D.⑥处反应放热,则N可能是氢氧化钠溶液C6.使用下列试剂能将氯化钠、碳酸钠、氯化钡三种溶液鉴别出来的是( )A.稀硫酸 B.紫色石蕊试液C.铁片 D.氢氧化钠溶液7.敞口放置的氢氧化钠溶液发生部分变质,除去变质生成的Na2CO3可以选择适量的( )A.Ca(OH)2溶液 B.稀盐酸C.CaCl2溶液 D.Ca(NO3)2溶液AA8.推理是化学学习中常用的思维方法。下列推理判断正确的是( )A.某物质在空气中燃烧生成水,所以该物质中一定含有氢元素B.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应C.氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物D.碱溶液一定呈碱性,所以呈碱性的溶液一定是碱溶液9.将括号中的物质加入到下列物质的溶液中,能使溶液的pH明显增大的是( )A.饱和石灰水(稀硝酸) B.稀硫酸(硝酸钡溶液)C.硝酸(氢氧化钠溶液) D.氯化钠溶液(硝酸钡溶液)AC10.小刚同学在做有关NaOH溶液性质的实验时,向NaOH溶液中滴加过量的CuSO4溶液。下列图象中能正确表示其变化过程的是( )C11.下列实验设计及操作,其现象足以说明结论的是 ( )C12.某实验小组在探究碱的化学性质实验时,用到了氢氧化钠溶液和氢氧化钙溶液。(1)甲同学不小心将这两种溶液混合在一起,结果产生__________________________的现象,说明氢氧化钠溶液变质了。写出变质时发生反应的化学方程式:_______________________________________。(2)同学们对变质的氢氧化钠溶液中溶质的成分产生了兴趣,进行如下探究:【提出问题】氢氧化钠溶液中溶质的成分是什么? 澄清的石灰水变浑浊2NaOH+CO2===Na2CO3+H2O【作出猜想】猜想一:Na2CO3;猜想二:____________________________(写化学式)。【进行讨论】甲同学取少量待测液加入足量的稀盐酸,有气泡产生。认为猜想一成立。乙同学不同意甲同学的观点,理由是_____________________________________________________________。【设计实验】请你验证猜想二成立,并完成实验报。Na2CO3和NaOH猜想二中也含有碳酸钠,加入足量的稀盐酸也能产生气泡【反思评价】在实验室中,氢氧化钠应____保存。 过量的氯化钙(或过量的氯化钡,或过量的硝酸钙等可溶性钙盐或钡盐)①产生白色沉淀②无色酚酞溶液变红密封13.氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:(1)熟石灰主要成分的化学式是__________。(2)溶液A中的阳离子是_____________________________(填离子符号)。(3)沉淀C的成分是__________________________________。(4)溶液B与熟石灰反应的化学方程式是___________________________________________。Ca(OH)2Mg2+、Fe3+、Cu2+、H+Fe(OH)3、Cu(OH)2MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2【解析】(1)熟石灰的主要成分是氢氧化钙,化学式为Ca(OH)2。(2)矿石中加入稀盐酸,稀盐酸可以与氧化镁、氧化铁和氧化铜反应分别生成氯化镁、氯化铁和氯化铜,由于盐酸过量,故溶液中的阳离子有Mg2+、Fe3+、Cu2+、H+。(3)pH控制在7~9时,溶液中的铁离子和铜离子会生成氢氧化铁沉淀和氢氧化铜沉淀。(4)溶液B中的主要成分是氯化镁,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,故反应方程式为MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2。14.某固体混合物A中可能含硫酸钠、碳酸钠、硝酸钡、氯化铵等物质中的若干种。按如图所示进行实验,出现的现象如图所述(实验过程中所有发生的反应都恰好完全反应)。根据实验过程和发生的现象,回答下列问题:(1)现象X是___________________,气体E的化学式为_______。(2)固体混合物A中,肯定存在的物质是_________________(写化学式)。(3)写出步骤①中发生反应的化学方程式:______________________________________________。(4)仅根据上述实验现象,还不能确定混合物A的组成。为确定混合物A的成分,可用沉淀G再进行实验。方法是取沉淀G少许,向其中加入足量稀硝酸,若沉淀全部溶解,则固体混合物A中不含_______________________________(化学式)。石蕊试液变红色NH3Na2CO3、NH4ClNa2CO3+2HCl===2NaCl+H2O+CO2↑Ba(NO3)2、Na2SO4【解析】碳酸根离子和氢离子结合会生成二氧化碳气体,氢氧根离子和铵根离子结合会生成氨气,硫酸根离子和钡离子结合会生成硫酸钡沉淀。混合物A中加入盐酸会生成气体B,所以混合物A中一定含有碳酸钠,气体B是二氧化碳,二氧化碳溶于水生成碳酸,碳酸能使紫色石蕊溶液变红色;混合物A和氢氧化钠反应会生成气体E,所以混合物A中含有氯化铵,E是氨气,氨气溶于水形成氨水,氨水能使酚酞变红色;C、D溶液和氯化钡反应会生成白色沉淀,碳酸钠和氯化钡也会生成白色的碳酸钡沉淀,所以混合物A中可能含有硫酸钠,碳酸钠、硫酸钠和硝酸钡不能共存,所以混合物A中一定不含硝酸钡。15.某实验小组的同学从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请填写下列空白。(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应?方案一:上述方案中,为什么强调只有测得pH ≥7才能证明反应发生了?__________________________________________________________。方案二:如下图向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀盐酸至过量,观察到的现象是_______________________________________。结论:稀盐酸与氢氧化钠溶液发生了化学反应,反应的化学方程式为_______________________________。上述两个方案在设计思路上的相同点是____________________________________。排除因氢氧化钠溶液的加入、稀释盐酸而引起的pH变大溶液由无色变成红色,又由红色变成无色NaOH+HCl===NaCl+H2O是测定溶液酸碱性的变化证明发生了反应(2)探究稀盐酸与氢氧化钠溶液是否恰好完全反应?小明同学对此提出质疑,没有明显现象也不能证明稀盐酸与氢氧化钠溶液恰好完全反应,理由是_________________________________________。为此他认为还需要补充下列实验:生成蓝色沉淀CuSO4+2NaOH===Cu(OH)2↓+Na2SO4若盐酸过量,加入硫酸铜溶液后也无明显现象紫色石蕊试液紫色石蕊试液不变色16.为测定某稀硫酸的溶质的质量分数,小兰同学设计了如下实验方案:第②步实验中生成沉淀的质量与加入NaOH溶液的质量关系如图所示。(1)分析第②步实验:与先加入的80 g NaOH溶液反应的物质是__________(填化学式),继续加入NaOH溶液后产生的沉淀是______________(填名称)。(2)计算稀硫酸的溶质的质量分数。(写出计算过程)H2SO4氢氧化铜解:与硫酸反应的氢氧化钠的质量是80 g×10%=8 g。设与氢氧化钠反应的硫酸质量为x。2NaOH+H2SO4===Na2SO4+2H2O 80 98 8 g x x=9.8 g设与氧化铜反应的硫酸质量为y。CuO+H2SO4===CuSO4+H2O 80 98 8 g y y=9.8 g稀硫酸的溶质的质量分数为 ×100%=9.8%
专项训练1 酸和碱的性质1.下列溶液能使紫色石溶液变红色的是( )A.NaCl溶液 B.澄清石灰水C.稀盐酸 D.KNO3溶液2.下列描述属于氢氧化钙化学性质的是( )A.白色固体 B.微溶于水C.溶液有滑腻感 D.能与CO2反应CD3.下列物质长期露置在空气中质量增大但没变质的是( )A.小苏打 B.氢氧化钠固体C.浓盐酸 D.浓硫酸4.关于硫酸的说法错误的是( )A.稀硫酸与锌反应可制得氢气B.稀硫酸可用于除铁锈C.可将水注入浓硫酸中进行稀释D.浓硫酸可用来干燥氢气DC5.利用如图所示的实验探究物质的性质,下列叙述错误的是( )A.②处有气泡,③处无现象B.①②④⑤处有明显现象,则M可能为稀盐酸C.⑤处固体明显减少,则M可能为稀硫酸D.⑥处反应放热,则N可能是氢氧化钠溶液C6.使用下列试剂能将氯化钠、碳酸钠、氯化钡三种溶液鉴别出来的是( )A.稀硫酸 B.紫色石蕊试液C.铁片 D.氢氧化钠溶液7.敞口放置的氢氧化钠溶液发生部分变质,除去变质生成的Na2CO3可以选择适量的( )A.Ca(OH)2溶液 B.稀盐酸C.CaCl2溶液 D.Ca(NO3)2溶液AA8.推理是化学学习中常用的思维方法。下列推理判断正确的是( )A.某物质在空气中燃烧生成水,所以该物质中一定含有氢元素B.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应C.氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物D.碱溶液一定呈碱性,所以呈碱性的溶液一定是碱溶液9.将括号中的物质加入到下列物质的溶液中,能使溶液的pH明显增大的是( )A.饱和石灰水(稀硝酸) B.稀硫酸(硝酸钡溶液)C.硝酸(氢氧化钠溶液) D.氯化钠溶液(硝酸钡溶液)AC10.小刚同学在做有关NaOH溶液性质的实验时,向NaOH溶液中滴加过量的CuSO4溶液。下列图象中能正确表示其变化过程的是( )C11.下列实验设计及操作,其现象足以说明结论的是 ( )C12.某实验小组在探究碱的化学性质实验时,用到了氢氧化钠溶液和氢氧化钙溶液。(1)甲同学不小心将这两种溶液混合在一起,结果产生__________________________的现象,说明氢氧化钠溶液变质了。写出变质时发生反应的化学方程式:_______________________________________。(2)同学们对变质的氢氧化钠溶液中溶质的成分产生了兴趣,进行如下探究:【提出问题】氢氧化钠溶液中溶质的成分是什么? 澄清的石灰水变浑浊2NaOH+CO2===Na2CO3+H2O【作出猜想】猜想一:Na2CO3;猜想二:____________________________(写化学式)。【进行讨论】甲同学取少量待测液加入足量的稀盐酸,有气泡产生。认为猜想一成立。乙同学不同意甲同学的观点,理由是_____________________________________________________________。【设计实验】请你验证猜想二成立,并完成实验报。Na2CO3和NaOH猜想二中也含有碳酸钠,加入足量的稀盐酸也能产生气泡【反思评价】在实验室中,氢氧化钠应____保存。 过量的氯化钙(或过量的氯化钡,或过量的硝酸钙等可溶性钙盐或钡盐)①产生白色沉淀②无色酚酞溶液变红密封13.氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:(1)熟石灰主要成分的化学式是__________。(2)溶液A中的阳离子是_____________________________(填离子符号)。(3)沉淀C的成分是__________________________________。(4)溶液B与熟石灰反应的化学方程式是___________________________________________。Ca(OH)2Mg2+、Fe3+、Cu2+、H+Fe(OH)3、Cu(OH)2MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2【解析】(1)熟石灰的主要成分是氢氧化钙,化学式为Ca(OH)2。(2)矿石中加入稀盐酸,稀盐酸可以与氧化镁、氧化铁和氧化铜反应分别生成氯化镁、氯化铁和氯化铜,由于盐酸过量,故溶液中的阳离子有Mg2+、Fe3+、Cu2+、H+。(3)pH控制在7~9时,溶液中的铁离子和铜离子会生成氢氧化铁沉淀和氢氧化铜沉淀。(4)溶液B中的主要成分是氯化镁,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,故反应方程式为MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2。14.某固体混合物A中可能含硫酸钠、碳酸钠、硝酸钡、氯化铵等物质中的若干种。按如图所示进行实验,出现的现象如图所述(实验过程中所有发生的反应都恰好完全反应)。根据实验过程和发生的现象,回答下列问题:(1)现象X是___________________,气体E的化学式为_______。(2)固体混合物A中,肯定存在的物质是_________________(写化学式)。(3)写出步骤①中发生反应的化学方程式:______________________________________________。(4)仅根据上述实验现象,还不能确定混合物A的组成。为确定混合物A的成分,可用沉淀G再进行实验。方法是取沉淀G少许,向其中加入足量稀硝酸,若沉淀全部溶解,则固体混合物A中不含_______________________________(化学式)。石蕊试液变红色NH3Na2CO3、NH4ClNa2CO3+2HCl===2NaCl+H2O+CO2↑Ba(NO3)2、Na2SO4【解析】碳酸根离子和氢离子结合会生成二氧化碳气体,氢氧根离子和铵根离子结合会生成氨气,硫酸根离子和钡离子结合会生成硫酸钡沉淀。混合物A中加入盐酸会生成气体B,所以混合物A中一定含有碳酸钠,气体B是二氧化碳,二氧化碳溶于水生成碳酸,碳酸能使紫色石蕊溶液变红色;混合物A和氢氧化钠反应会生成气体E,所以混合物A中含有氯化铵,E是氨气,氨气溶于水形成氨水,氨水能使酚酞变红色;C、D溶液和氯化钡反应会生成白色沉淀,碳酸钠和氯化钡也会生成白色的碳酸钡沉淀,所以混合物A中可能含有硫酸钠,碳酸钠、硫酸钠和硝酸钡不能共存,所以混合物A中一定不含硝酸钡。15.某实验小组的同学从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究,请填写下列空白。(1)如何用实验验证稀盐酸与氢氧化钠溶液发生了反应?方案一:上述方案中,为什么强调只有测得pH ≥7才能证明反应发生了?__________________________________________________________。方案二:如下图向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀盐酸至过量,观察到的现象是_______________________________________。结论:稀盐酸与氢氧化钠溶液发生了化学反应,反应的化学方程式为_______________________________。上述两个方案在设计思路上的相同点是____________________________________。排除因氢氧化钠溶液的加入、稀释盐酸而引起的pH变大溶液由无色变成红色,又由红色变成无色NaOH+HCl===NaCl+H2O是测定溶液酸碱性的变化证明发生了反应(2)探究稀盐酸与氢氧化钠溶液是否恰好完全反应?小明同学对此提出质疑,没有明显现象也不能证明稀盐酸与氢氧化钠溶液恰好完全反应,理由是_________________________________________。为此他认为还需要补充下列实验:生成蓝色沉淀CuSO4+2NaOH===Cu(OH)2↓+Na2SO4若盐酸过量,加入硫酸铜溶液后也无明显现象紫色石蕊试液紫色石蕊试液不变色16.为测定某稀硫酸的溶质的质量分数,小兰同学设计了如下实验方案:第②步实验中生成沉淀的质量与加入NaOH溶液的质量关系如图所示。(1)分析第②步实验:与先加入的80 g NaOH溶液反应的物质是__________(填化学式),继续加入NaOH溶液后产生的沉淀是______________(填名称)。(2)计算稀硫酸的溶质的质量分数。(写出计算过程)H2SO4氢氧化铜解:与硫酸反应的氢氧化钠的质量是80 g×10%=8 g。设与氢氧化钠反应的硫酸质量为x。2NaOH+H2SO4===Na2SO4+2H2O 80 98 8 g x x=9.8 g设与氧化铜反应的硫酸质量为y。CuO+H2SO4===CuSO4+H2O 80 98 8 g y y=9.8 g稀硫酸的溶质的质量分数为 ×100%=9.8%
相关资料
更多









