



初中化学鲁教版九年级下册第七单元 常见的酸和碱综合与测试评课课件ppt
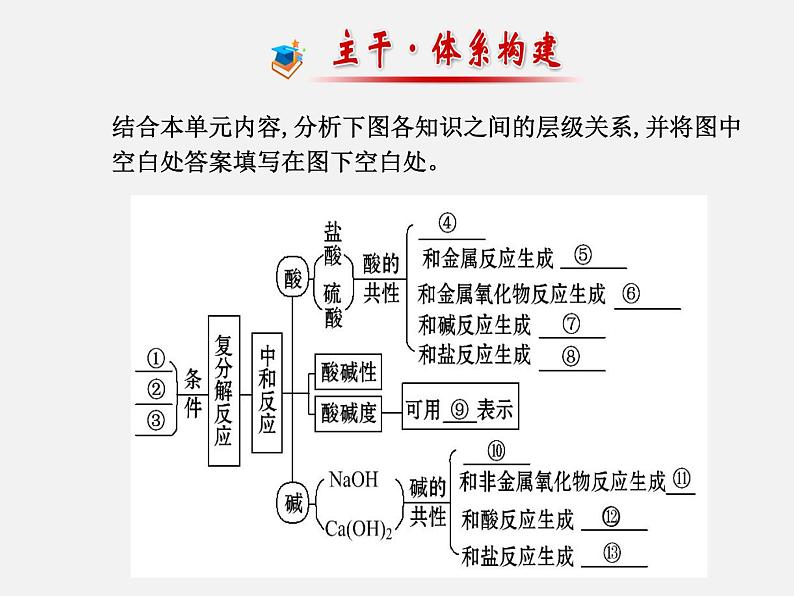
展开结合本单元内容,分析下图各知识之间的层级关系,并将图中空白处答案填写在图下空白处。
答案:①_________ ②___________③_____________________________________④___________________ ⑤_________ ⑥_______⑦_______ ⑧___________________ ⑨___⑩___________________ ⑪_______ ⑫_______⑬___________________
有沉淀生成(前三个选项内容无先后顺序)
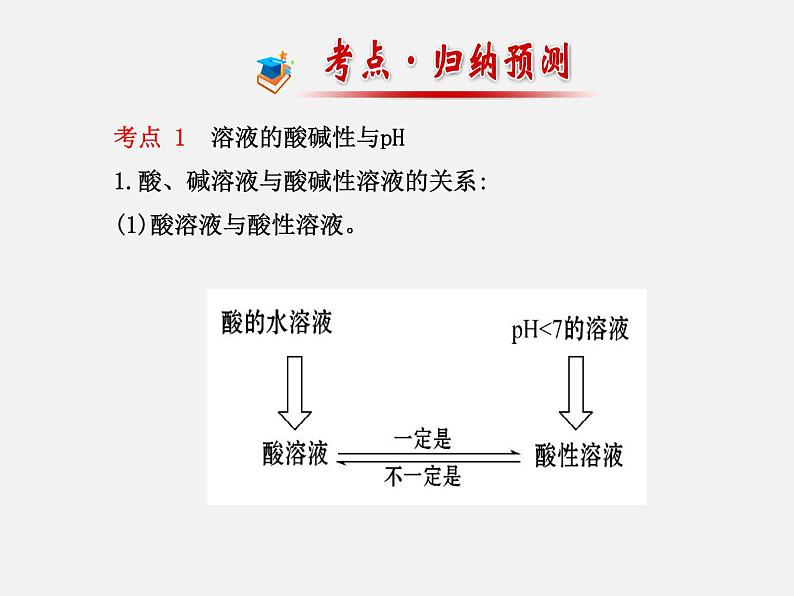
考点 1 溶液的酸碱性与pH1.酸、碱溶液与酸碱性溶液的关系:(1)酸溶液与酸性溶液。
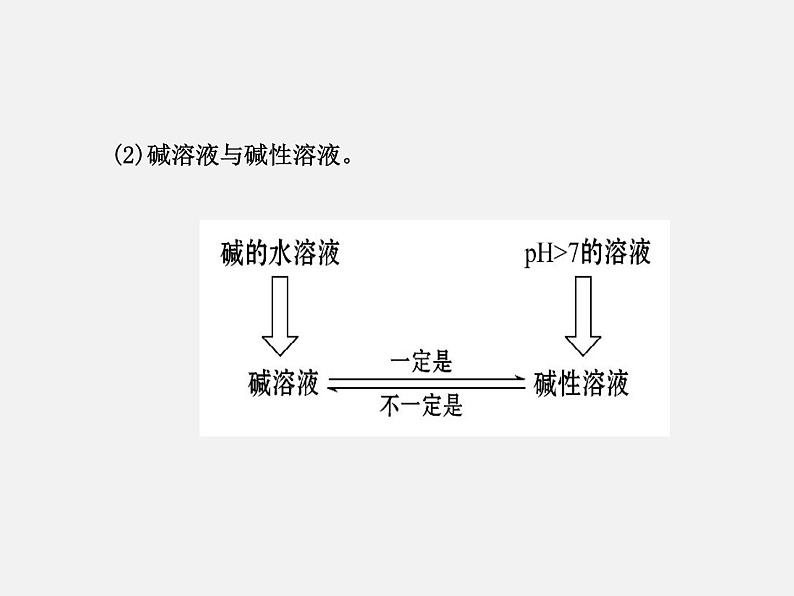
(2)碱溶液与碱性溶液。
2.改变溶液pH的方法:(1)加水。只能改变溶液的酸碱度,不能改变溶液原来的酸碱性,只能使溶液的pH逐渐接近于7。(2)加酸碱性相同、pH不同的溶液。原溶液酸碱性不会发生变化,但混合后溶液的pH在两种溶液的pH之间。(3)加酸碱性相反的溶液。由于两种溶液间发生了中和反应,使混合后的溶液的pH可能等于7,若加入的溶液过量,原溶液的酸碱性就会发生相反的变化。
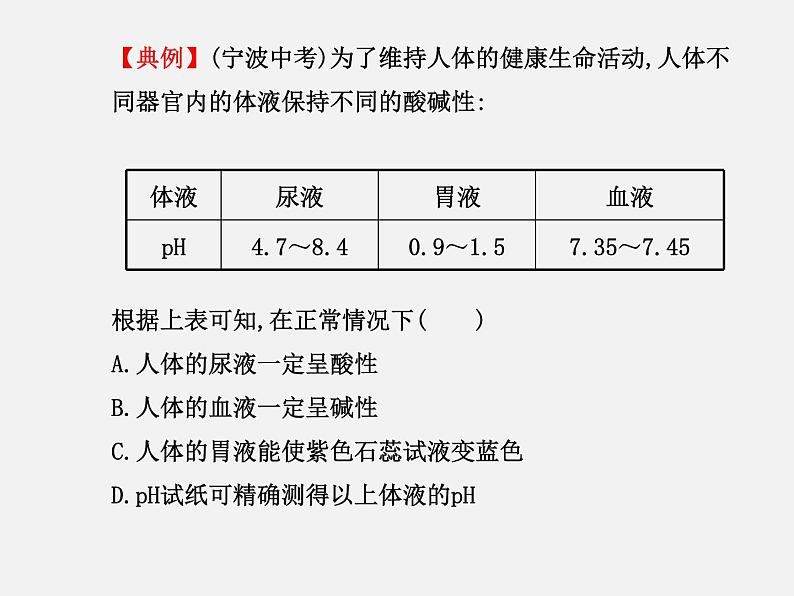
【典例】(宁波中考)为了维持人体的健康生命活动,人体不同器官内的体液保持不同的酸碱性:根据上表可知,在正常情况下( )A.人体的尿液一定呈酸性B.人体的血液一定呈碱性C.人体的胃液能使紫色石蕊试液变蓝色D.pH试纸可精确测得以上体液的pH
【解析】选B。尿液的pH为4.7~8.4,可能显酸性、中性或碱性,A错误;血液的pH为7.35~7.45,大于7,显碱性,B正确;胃液的pH为0.9~1.5,小于7,显酸性,能使紫色石蕊试液变红,C错误;pH试纸测得的结果是整数,D错误。
考点 2 酸、碱的性质及应用1.酸的性质及应用:(1)酸具有通性的原因:酸溶液中都含有H+。
2.碱的性质及应用:(1)碱具有通性的原因:碱溶液中都含有OH-。
【典例1】(自贡中考)物质X可发生下列所示的两个反应,则X可能是( )①X+碱→盐+水②X+金属氧化物→盐+水A.CaO D.H2SO4
【解析】选D。本题考查酸和碱的化学通性。解答本题的关键是:(1)明确酸和碱的化学通性;(2)明确物质的分类。由信息①可推断X可能是酸,也可能是非金属氧化物;由信息②可推断X只能是酸,所以同时满足①和②,X只能是酸。
【典例2】(山西中考)同学们在学习酸碱的化学性质时构建了如图知识网络,A、B、C、D是不同类别的化合物,“—”表示物质在一定条件下可以发生化学反应。请回答下列问题:
(1)反应①的化学方程式为 ,实验现象为 。(2)写出图中一个中和反应的化学方程式 。(3)物质C应具备的条件是 。
【解析】本题结合知识框架图考查酸和碱的通性。(1)三氧化二铁和盐酸反应生成氯化铁和水,其现象是:红色固体不断溶解,溶液由无色变为黄色。(2)中和反应就是酸和碱生成盐和水的反应,例如:氢氧化钙和硫酸反应生成硫酸钙和水。(3)物质C能与盐酸、氢氧化钙反应,可知C为可溶性盐,并且反应符合复分解反应发生的条件。
答案:(1)Fe2O3+6HCl====2FeCl3+3H2O红色(或红棕色)固体不断溶解,溶液由无色变为黄色(2)Ca(OH)2+ H2SO4====CaSO4+ 2H2O(或HCl和任意一种碱)(3)可溶性盐,并且和盐酸、氢氧化钙反应符合复分解反应发生的条件
考点 1 溶液的酸碱性与pH1.(赤峰中考)下列试剂:①pH试纸、②无色酚酞溶液、③紫色石蕊溶液、④碳酸钠溶液,其中能将稀盐酸、氯化钠溶液和澄清石灰水鉴别出来的是( )A.①②③ B.①③④C.②③④ D.①②④
【解析】选B。①pH试纸能测出溶液的pH,稀盐酸是酸,pH<7,氯化钠溶液是盐呈中性,pH=7;氢氧化钙是碱,pH>7,该方法可行;②酸和盐不能使酚酞溶液变色,碱能使酚酞溶液变红色,只能鉴别出氢氧化钙,稀盐酸和氯化钠溶液不能鉴别,该方法不可行;③使石蕊溶液变红色的是盐酸,不能使石蕊溶液变色的就是氯化钠溶液,使石蕊溶液变蓝色的是澄清石灰水,该方法可行;④稀盐酸和碳酸钠反应生成二氧化碳气体,氯化钠溶液和碳酸钠溶液不反应,碳酸钠溶液和氢氧化钙溶液反应生成碳酸钙白色沉淀,该方法可行。故选B。
2.(株洲中考)今有①肥皂水 ②食盐水 ③杨梅汁④白糖水 ⑤蒸馏水五种液体,根据你的生活经验判断,其中pH<7的是 ,pH>7的是 (填序号)。【解析】碱性物质pH>7,酸性物质pH<7,中性物质pH=7。肥皂水呈碱性,食盐水、白糖水和蒸馏水呈中性,杨梅汁呈酸性。答案:③ ①
考点 2 酸、碱的性质及应用1.(广州中考)玻璃仪器常附着难清洗的物质,下列清洗方法不可行的是( )A.内壁有CaCO3的试管用稀盐酸清洗B.内壁有碘的试管用酒精清洗C.内壁有Fe2O3的试管用NaOH溶液清洗D.内壁有植物油的试管用洗洁精清洗
【解析】选C。本题主要考查常见物质的化学性质及溶液的知识。CaCO3能与稀盐酸发生化学反应生成可溶性的氯化钙,碘能够溶于酒精,洗洁精对植物油具有乳化作用,A、B、D三项中的清洗方法均可行;Fe2O3不能与NaOH溶液发生化学反应,C项中的清洗方法不可行。
2.(黄冈中考)张亮在实验室用足量的锌粒与稀硫酸按右图装置制取一定量的氢气,发现液面刚好不与锌粒接触而又无酸液可加,若从长颈漏斗中加入适量的下列试剂,又不影响生成氢气的量,你认为最合适的是( )A.氢氧化钠溶液 B.碳酸钠溶液C.硫酸钠溶液 D.澄清石灰水
【解析】选C。本题考查试剂的加入对反应生成物的影响。要加入某种试剂使液体体积增加,同时还不能影响生成H2的质量,则加入的试剂不能与H+反应,也不能增加H+的质量。A、B、D都能与H+反应使生成H2的质量减少,所以选C。
3.(枣庄中考)甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如下图所示。请回答:(1)丁是 ;通常其用途为 。(2)甲和丙的化学反应方程式为 ;反应类型为 。
【解析】本题是一道有关酸、碱、盐的推断题,解题的关键是结合常见酸、碱、盐的性质寻找突破口。丁遇乙变红色,遇丙变蓝色,说明丁为石蕊溶液,则乙呈酸性(稀硫酸),丙呈碱性(澄清石灰水),由此可知甲为碳酸钠溶液。(1)丁为石蕊溶液,属于酸碱指示剂,可用于判断溶液的酸碱性。(2)甲和丙分别为碳酸钠溶液和澄清石灰水,它们之间的反应属于复分解反应。
答案:(1)石蕊溶液 判断溶液的酸碱性(2)Ca(OH)2+Na2CO3====CaCO3↓+2NaOH复分解反应
考点 3 中和反应及其应用1.(双选)(烟台中考)实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如右图所示曲线。下列有关该实验事实的说法正确的是( )A.该实验是将氢氧化钠溶液滴入盐酸中B.B点表示盐酸和氢氧化钠恰好完全反应C.A点时的溶液能使酚酞试液变红D.C点时,溶液中的溶质只有氯化钠
【解析】选B、C。本题结合图像考查酸碱中和反应过程中溶液pH的变化,解答此类题目的关键是要明确曲线变化的趋势和关键点的意义。根据图像可以看出,开始时溶液的pH大于7,溶液呈碱性,随着溶液的加入,pH逐渐减小,应为氢氧化钠溶液中加入稀盐酸,A错误;B点对应的pH等于7,表明氢氧化钠溶液和稀盐酸恰好完全反应,B正确;从图像可以看出,A点溶液呈碱性,酚酞试液在碱性溶液中显红色,C正确;C点的pH小于7,说明酸有剩余,故溶液中还含有溶质氯化氢,D错误。
2.(衡阳中考)用熟石灰中和一定量的盐酸时,熟石灰与盐酸反应的化学方程式为 ;当恰好完全反应时,溶液中的溶质为 。【解析】本题主要考查酸碱中和反应。熟石灰与盐酸反应的化学方程式为Ca(OH)2+2HCl====CaCl2+2H2O,当二者恰好完全反应时,溶液中的溶质是CaCl2。答案:Ca(OH)2+2HCl====CaCl2+2H2O CaCl2
3.(鄂州中考)某化学兴趣小组的同学在学完《酸和碱的中和反应》后,集体创作了一个小魔术:“变色玫瑰”——用滤纸编制的白玫瑰喷洒无色液体乙后变红,继续喷洒该液体后又变为白色。组员揭秘:喷洒无色液体乙前,白玫瑰先用某无色液体甲处理过;喷洒的无色液体乙是由两种液体混合而成的;组成甲、乙两种液体的物质都是初中化学常见的物质。(1)液体乙可能是 。(2)液体甲中的溶剂是 。(3)玫瑰花由红色变为白色时发生反应的化学方程式可能是 。
【解析】由题目信息可以看出白玫瑰上的无色液体与乙能够反应且发生颜色变化,由此可以确定无色液体乙中含酚酞,酚酞遇碱变红,故液体甲中的溶剂是碱溶液。随着甲乙反应,红色逐渐消失,说明碱性减弱,由此判断乙溶液中除了酚酞外还应有酸溶液,又因为组成甲、乙两种液体的物质都是初中化学常见的物质,故可以确定乙为滴加了酚酞的盐酸(或硫酸),甲为氢氧化钠溶液,盐酸与氢氧化钠反应生成氯化钠和水,由此确定化学方程式。
答案:(1)滴加了酚酞的盐酸(或硫酸)(2)水(或H2O)(3)NaOH+HCl====NaCl+H2O
4.(淮安中考)某硫酸厂废水中含有少量硫酸,为达标排放,技术员小张对废水中硫酸的含量进行检测。(1)配制溶液:欲配制溶质质量分数为4%的NaOH溶液100 g,需要NaOH固体 g水 mL(水的密度为1 g·cm-3)。(2)检测分析:取废水样品98 g,向其中逐滴加入NaOH溶液至恰好完全反应时,消耗4%的NaOH溶液20 g。(假设废水中其他成分均不和NaOH反应,发生反应的化学方程式为:2NaOH+H2SO4====Na2SO4+2H2O)试计算废水中硫酸的质量分数(写出计算过程)。
【解析】(1)欲配制溶质质量分数为4%的NaOH溶液100 g,需要NaOH固体100 g×4%=4 g。需水的质量为100 g-4 g=96 g,除以水的密度即是水的体积。(2)求出氢氧化钠溶液中氢氧化钠的质量为20 g×4%,根据2NaOH+H2SO4====Na2SO4+2H2O,求废水样品中所含H2SO4的质量,然后除以稀硫酸溶液的质量即可解答。
答案:(1)4 96(2)解:设废水样品中所含H2SO4的质量为x。2NaOH + H2SO4====Na2SO4+2H2O 80 9820 g×4% x x=0.98 g则废水中硫酸的质量分数为
考点 4 酸和碱的检验、鉴别、推断及除杂1.(成都中考)下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )A.紫色石蕊溶液 B.氯化钠溶液C.铁粉 D.pH试纸【解析】选B。紫色石蕊溶液遇到盐酸和氢氧化钠溶液会显示不同的颜色,铁粉能与盐酸反应生成气泡而与氢氧化钠溶液不反应,pH试纸能测定溶液的酸碱度,A、C、D三项均可用于鉴别盐酸和氢氧化钠溶液。氯化钠溶液与盐酸和氢氧化钠溶液都不反应,所以不能鉴别盐酸和氢氧化钠溶液,故选B。
2.(聊城中考)鉴别下列各组物质,选用试剂(括号内的物质)正确的是( )A.氢氧化钠溶液和澄清石灰水(稀盐酸)B.氯化钠溶液和稀盐酸(氢氧化钠溶液)C.碳酸钠溶液和氯化钠溶液(澄清石灰水)D.稀盐酸和稀硫酸(锌粒)
【解析】选C。本题属于物质的鉴别题,通过对实验过程的探究,在比较鉴别的基础上,得出正确的实验结论。氢氧化钠溶液和澄清石灰水都能与盐酸发生中和反应,但是都无明显现象;氯化钠与氢氧化钠不反应,无现象,盐酸与氢氧化钠反应生成氯化钠和水,也无明显现象;把澄清的石灰水分别加入碳酸钠溶液和氯化钠溶液中,有白色沉淀生成的是碳酸钠,无现象的是氯化钠;把锌粒分别加入稀盐酸和稀硫酸中,都有气泡冒出。
3.(北京中考)某固体粉末可能由氢氧化钠、氢氧化钙、碳酸钠和碳酸钙中的一种或几种组成,进行如下实验:①取少量固体加入足量的水,搅拌,有不溶物;②过滤,向滤液中加入盐酸,有气泡产生。下列对固体粉末成分的判断中,不正确的是( )A.一定有碳酸钠 B.可能有氢氧化钠C.一定有碳酸钙 D.可能有氢氧化钙
【解析】选C。由于滤液中加入盐酸,有气泡产生,说明固体粉末中含有碳酸钠;固体加入足量的水,搅拌,有不溶物,说明有不溶性物质,但这种不溶性物质可能为原有的碳酸钙,也可能为氢氧化钙和碳酸钠反应生成的碳酸钙;题中没有进一步检验氢氧化钠和氢氧化钙是否存在,故两者都有可能存在。故选C。
4.(双选)(天津中考)某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验。下列选项错误的是( )
初中化学鲁教版九年级下册第七单元 常见的酸和碱综合与测试示范课ppt课件: 这是一份初中化学鲁教版九年级下册第七单元 常见的酸和碱综合与测试示范课ppt课件,共19页。PPT课件主要包含了实验现象记录,酸碱盐溶液的导电性,课堂练习等内容,欢迎下载使用。
初中化学第九单元 金属综合与测试课前预习ppt课件: 这是一份初中化学第九单元 金属综合与测试课前预习ppt课件,共40页。PPT课件主要包含了重温教材,金属在生活中的应用,金属的物理性质,我会总结,练一练,性能的改变,火眼金睛,鉴别方法,盐溶液,氧化物等内容,欢迎下载使用。
初中化学鲁教版九年级下册第十单元 化学与健康综合与测试课文配套课件ppt: 这是一份初中化学鲁教版九年级下册第十单元 化学与健康综合与测试课文配套课件ppt,共29页。













