


高中第二章 分子结构与性质第一节 共价键说课课件ppt
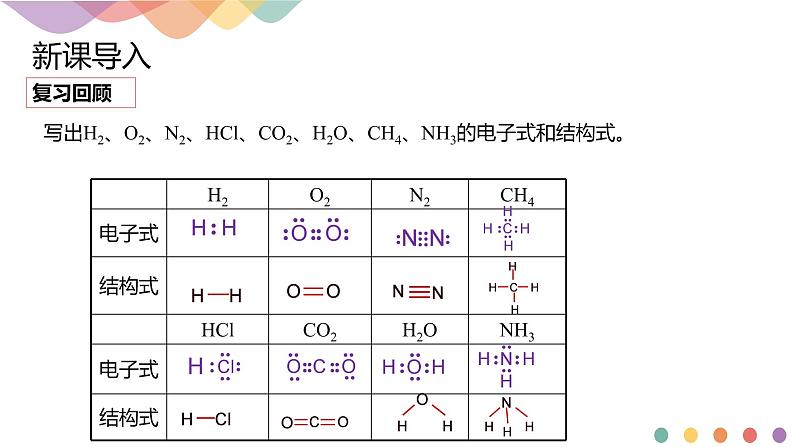
展开写出H2、O2、N2、HCl、CO2、H2O、CH4、NH3的电子式和结构式。
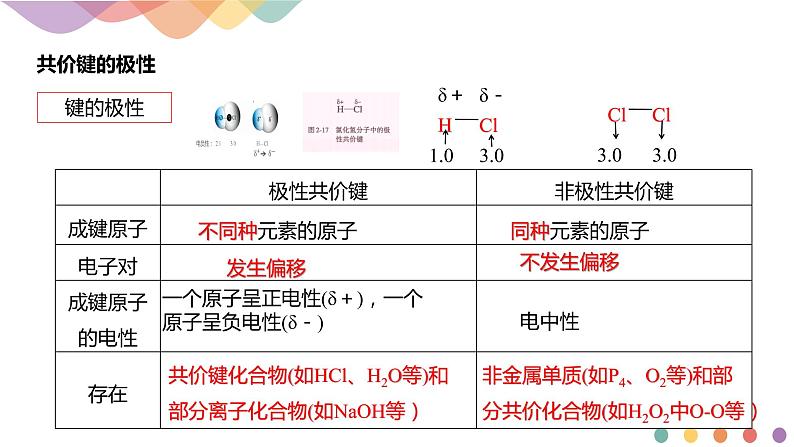
共价键化合物(如HCl、H2O等)和部分离子化合物(如NaOH等)
非金属单质(如P4、O2等)和部分共价化合物(如H2O2中O-O等)
一个原子呈正电性(δ+),一个原子呈负电性(δ-)
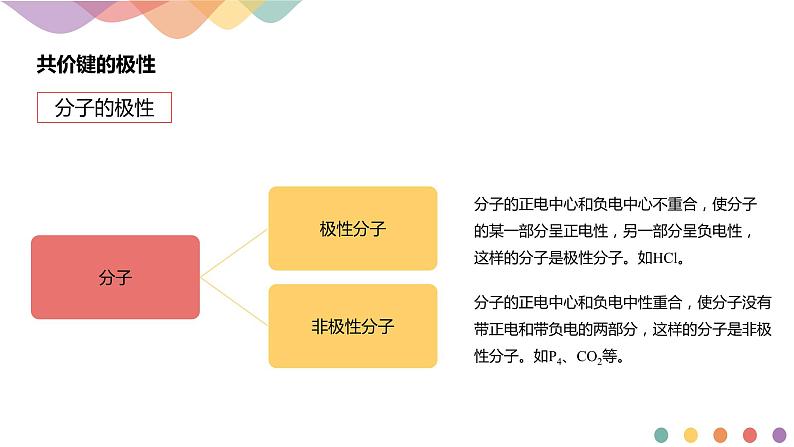
分子的正电中心和负电中心不重合,使分子的某一部分呈正电性,另一部分呈负电性,这样的分子是极性分子。如HCl。
分子的正电中心和负电中性重合,使分子没有带正电和带负电的两部分,这样的分子是非极性分子。如P4、CO2等。
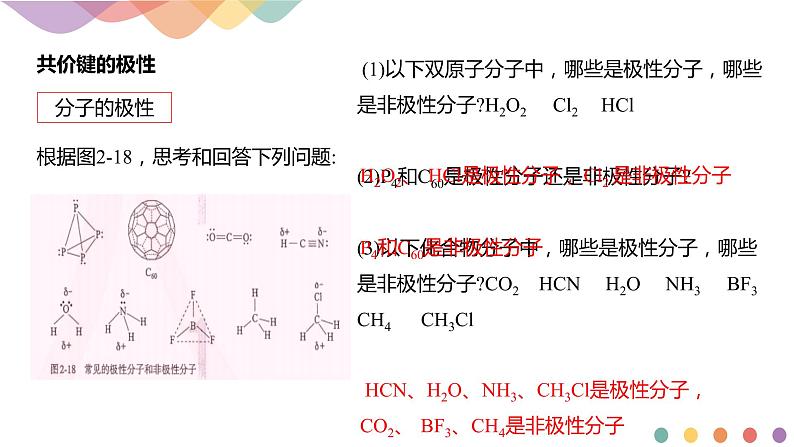
根据图2-18,思考和回答下列问题:
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子?H2O2 Cl2 HCl (2)P4和C60是极性分子还是非极性分子? (3)以下化合物分子中,哪些是极性分子,哪些是非极性分子?CO2 HCN H2O NH3 BF3 CH4 CH3Cl
H2O2、 HCl是极性分子, Cl2 是非极性分子
HCN、H2O、NH3、CH3Cl是极性分子,CO2、 BF3、CH4是非极性分子
P4和C60是非极性分子
①若分子中共价键的极性的向量和等于0,则为非极性分子,如BF3、CH4等。
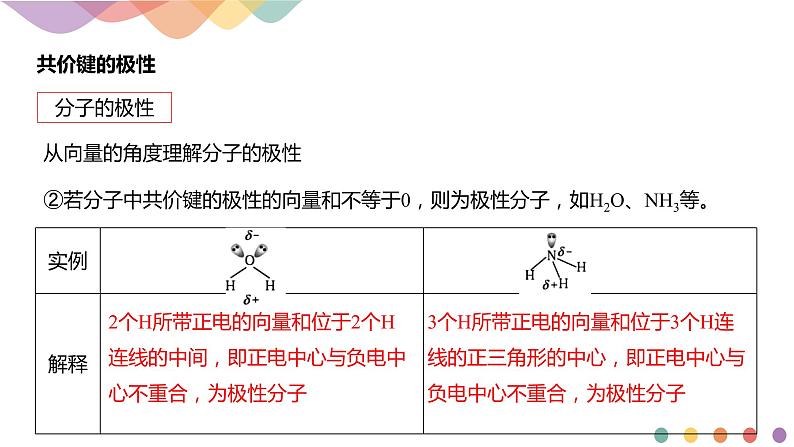
从向量的角度理解分子的极性
对称的3个F所带负电的向量和位于分子中心,即与B重合,且负电量与B所带正电量相等,分子不带电,为非极性分子
对称的4个H所带正电的向量和位于分子中心,即与C重合,且正电量与C所带负电量相等,分子不带电,为非极性分子
②若分子中共价键的极性的向量和不等于0,则为极性分子,如H2O、NH3等。
2个H所带正电的向量和位于2个H连线的中间,即正电中心与负电中心不重合,为极性分子
3个H所带正电的向量和位于3个H连线的正三角形的中心,即正电中心与负电中心不重合,为极性分子
键的极性与分子的极性关系
O3是V形分子,其空间结构不对称,故O3为 分子。H2O2分子不是直线形,两个H原子犹如在半展开的书的两面上,即结构不对称,为 分子。
只含有非极性键的双原子分子或多原子分子大多是非极性分子,如O2、H2、P4、C60。含有极性键的双原子分子都是极性分子,如HCl、HF、HBr。含有极性键的多原子分子,立体构型对称的是非极性分子;立体构型不对称的是极性分子。
判断ABn型分子极性的经验规律:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子;若不等,则为极性分子。若中心原子有孤电子对,则为极性分子;若无孤电子对,则为非极性分子。如CS2、BF3、SO3、CH4为非极性分子;H2S、SO2、NH3、PCl3为极性分子。
1、什么是表面活性剂?亲水基团?疏水基团?肥皂和洗涤剂的去污原理是什么?2、什么是单分子膜?双分子膜?举例说明。3、为什么双分子膜以头向外而尾向内的方式排列?
一类有机分子一端有极性(亲水基团),另一端非极性(疏水基团)
表面活性剂分散在水表面形成一层疏水基团朝空气的单分子层。细胞和细胞膜是双分子膜,由大量两性分子组装而成。
由于细胞膜的两侧是水溶液,而两性分子膜的头基是极性基团、尾基是非极性基团
键的极性对物质的化学性质的影响
羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。
1. 为什么甲酸、乙酸、丙酸的酸性逐渐减弱? 2. CF3COOH的酸性大于CCl3COOH,解释原因。
烃基是推电子基团,烃基越长推电子效应越大,使羧基中的烃基的极性越小,羧酸的酸性越弱。所以,甲酸的酸性大于乙酸的,乙酸的酸性大于丙酸的……随着烃基加长,酸性的差异越来越小。
的电负性大于氯的电负性,F—C的极性大于Cc的极性,使F3C一的极性大于Cl3C一的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。同理,三氯乙酸的酸性大于二氯乙酸的,二氯乙酸的酸性大于氯乙酸的。
1. 试分析羧酸的酸性与分子的组成和结构的关系。
与羧酸(—COOH)相连的C—X(X为卤素原子)的极性越大,羧酸的酸性越大;C—X的数量越多,羧酸的酸性越大,如酸性:CF3COOH>CCl3COOH>CH3COOH;CCl3COOH>CHCl2COOH>CH2ClCOOH。 烃基越长,羧酸的酸性越小,如酸性:C2H5COOH<CH3COOH<HCOOH。
人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件: 这是一份人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质备课ppt课件,共29页。PPT课件主要包含了课前导入,电子式,结构式,非极性键,极性键,极性键和非极性键,极性分子,非极性分子,HCl,大小相等方向相反等内容,欢迎下载使用。
高中第三节 分子结构与物质的性质示范课课件ppt: 这是一份高中第三节 分子结构与物质的性质示范课课件ppt,共30页。PPT课件主要包含了教材分析,教学目标,教学重点,教学难点,共价键的极性,教学流程,教学过程,只含非极性键的分子,含有极性键的分子,向量和不等于零等内容,欢迎下载使用。
2021学年第三节 分子结构与物质的性质教学ppt课件: 这是一份2021学年第三节 分子结构与物质的性质教学ppt课件,文件包含231共价键的极性pptx、231共价键的极性-练习解析版docx、231共价键的极性-教学设计docx、231共价键的极性-学案解析版docx、231共价键的极性-学案原卷版docx、231共价键的极性-练习原卷版docx等6份课件配套教学资源,其中PPT共22页, 欢迎下载使用。













