





高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表多媒体教学ppt课件
展开第一节 原子结构与元素周期表
第3课时 原子结构与元素的性质
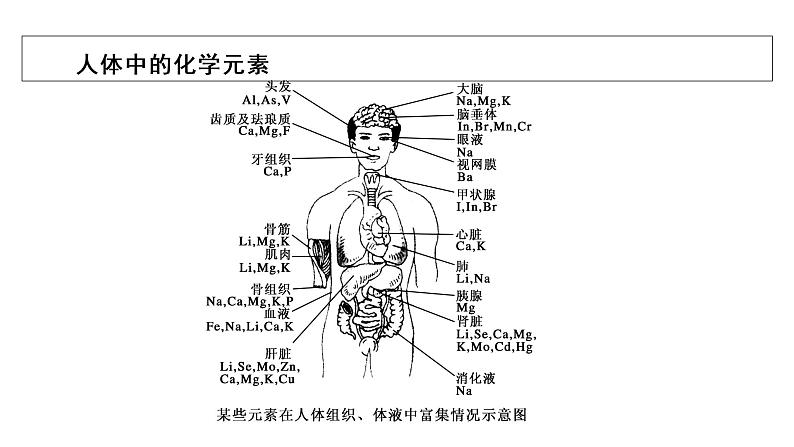
我们人体是一个有机体,主要是由碳、氢、氧元素组成的,除此之外,在人体组织和体液中含有很多其他的元素,某些元素在人体中的含量虽然不高,但却都是人体中不能缺少的元素。你知道人体中所含的各元素的原子结构吗?它们具有什么样的性质呢?
1.碱金属元素包括______________________________(填写元素符号)等元素,它们都处于元素周期表中第________族;卤族元素包括______________________(填写元素符号)等元素,它们都处于元素周期表中第________族。2.钠与水反应的离子方程式为______________________________。钠与氧气在常温和加热条件下反应得到的产物分别为__________、__________。3.氯气与氢气反应的条件是______________。
Li、Na、K、Rb、Cs
2Na+2H2O===2Na++2OH-+H2↑
一、元素的性质1.金属性金属元素的原子最外层电子一般少于_____个,在化学反应中容易____________,具有__________。即元素的金属性是指元素的原子所具有的____________的能力。
2.非金属性非金属元素的原子最外层电子一般多于_____个,在化学反应中容易____________,具有____________。即元素的非金属性是指元素的原子所具有的____________的能力。
二、碱金属元素1.碱金属元素的原子结构
2.碱金属单质的化学性质(1)钠、钾与氧气反应比较
(2)钠、钾与水反应的比较
钾与水的反应有轻微爆炸声并着火燃烧
2Na+2H2O===2NaOH+H2↑
2K+2H2O===2KOH+H2↑
3.碱金属单质的物理性质
三、卤族元素1.卤素单质的物理性质
2.卤素的原子结构特点
3.卤素单质的化学性质(1)卤素单质与氢气反应
H2+F2===2HF
(2)卤素单质之间的置换反应
Cl2+2KBr===2KCl+Br2
Cl2+2KI===2KCl+I2
Br2+2KI===2KBr+I2
四、同主族元素的性质与原子结构的关系
1.下列有关碱金属的说法不正确的是( )A.均为ⅠA族元素,最外层均有1个电子B.单质的还原性:Li>Na>K>Rb>CsC.单质的熔、沸点逐渐降低D.由Li到Cs,核电荷数依次增加,电子层数、原子半径依次增大
解析:主族元素族序数等于最外层电子数,A正确;Li→Na→K→ Rb→Cs原子半径依次增大,失电子能力增强,还原性增强,B错;Li→Na→K→Rb→Cs原子半径依次增大,原子间作用力逐渐减小,熔沸点逐渐降低,C正确;由Li到Cs核电荷数依次增加,电子层数、原子半径依次增大,D正确。
2.下列有关卤素单质的说法正确的是( )A.从F2到I2,单质密度逐渐减小B.从F2到I2,单质氧化性增强C.H2与F2不能共存D.碘与铁反应时生成FeI3解析:常温下,F2为气体,Cl2为气体,Br2为液体,I2为固体,单质密度逐渐增大,A错;从F到I原子半径增大,得电子能力减弱,单质的氧化性减弱,B错;H2与F2混合迅速爆炸,不共存,C正确;碘与铁生成FeI2,D错。
3.依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )A.卤素单质Cl2、Br2、I2的氧化性强弱B.气态氢化物NH3、H2O、HF的稳定性C.碱金属单质Li、Na、K与水反应的剧烈程度D.1 ml Na、Mg、Al分别与足量盐酸反应时失去电子数的多少解析:卤族元素中,单质的氧化性越弱,对应元素的非金属性越弱,A合理;气态氢化物稳定性越强,对应元素的非金属性越强,B合理;碱金属单质与H2O反应越剧烈,失电子能力越强,金属性越强,C合理;金属性强弱与得失电子多少没有必然关系,D不合理。
4.X、Y是元素周期表ⅦA族中的两种元素。下列叙述能说明X的非金属性比Y强的是( )A.X原子的电子层数比Y原子的电子层数多B.Y的单质能将X从NaX的溶液中置换出来C.X的单质比Y的单质更容易与氢气反应D.同浓度下X的氢化物水溶液比Y的氢化物水溶液的酸性强
解析:同一主族中,原子序数越大,电子层数越多,非金属性越弱,A错;由于非金属性X>Y,则X的单质能将NaY转化成Y的单质,B错;非金属性越强,与氢气化合越容易,C正确;卤族元素中,原子序数越大,HX的水溶液酸性越强,则X的氢化物水溶液比Y的氢化物水溶液的酸性弱,D错。
5.下列关于碱金属元素和卤素的说法中错误的是( )A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强C.钾与水的反应比钠与水的反应更剧烈D.溴单质与水的反应比氯单质与水的反应更剧烈解析:同主族元素从上到下,原子半径逐渐增大,金属族失电子能力增强,与水反应越来越强,非金属族得电子能力减弱,与H2O反应越来越难,D项错误,A、B、C正确。
6.碱金属是典型的活泼金属,其根本原因是( )A.碱金属单质的密度小,熔点和沸点低B.碱金属在常温下易被氧化C.碱金属原子最外电子层上都只有1个电子,容易失去D.碱金属原子的核电荷数比较小解析:结构决定性质,碱金属元素的原子最外层都只有一个电子,易失去,表现出较活泼的金属性,C项正确。
碱金属元素单质化学性质的相似性和递变性
1.Li、Na、K在空气中燃烧分别生成Li2O、Na2O2、KO2(超氧化钾)说明什么问题?如何保存单质钾?2.请结合碱金属元素的原子结构的递变性探究其单质化学性质的递变性。探究提示:1.说明Li、Na、K活动性依次增强;保存钾时保存在煤油中,以避免与空气中的O2、H2O反应。2.碱金属元素原子的最外层电子数都相等,但从Li到Cs,随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱;失电子能力逐渐增强,金属性逐渐增强。
2.递变性具体情况如下(按从Li→Cs的顺序):
(1)与氧气、与水反应的剧烈程度逐渐增强。①与O2反应越来越剧烈,产物也更加复杂,Li只生成Li2O,Na能生成Na2O和Na2O2,K则能生成K2O、K2O2、KO2等。②与水反应越来越剧烈,K能发生轻微爆炸,Rb、Cs遇水则发生剧烈爆炸。(2)最高价氧化物对应水化物的碱性逐渐增强,即碱性:LiOH< NaOH
下列说法中正确的是( )A.碱性:LiOH>NaOH>KOH>RbOHB.金属性:Rb>K>Na>LiC.Fe、Na分别和稀盐酸反应时,每个铁原子失去2个电子,每个钠原子失去1个电子,所以Fe的金属活动性强于NaD.Rb不易与水反应放出H2解析:因为金属性Li
卤族元素性质的相似性和递变性
1.由F、Cl、Br、I的原子结构推测它们得失电子能力大小。2.根据卤族元素的性质分析,将F2通入NaCl溶液中得到什么气体?探究提示:1.它们最外层都有7个电子,都易得一个电子达到稳定结构,但它们的原子半径依次增大,得电子能力逐渐减弱。2.F2的氧化性强于Cl2,但由于F2易与H2O反应:2F2+2H2O=== 4HF+O2,故F2通入NaCl溶液中得到O2而不是Cl2。
知识归纳总结:1.相似性:
2.递变性:具体情况如下:
(1)与H2反应越来越难,对应氢化物的稳定性逐渐减弱,氢化物还原性逐渐增强,其水溶液的酸性逐渐增强,即:稳定性:HF>HCl>HBr>HI;还原性:HF<HCl<HBr<HI;酸性:HF<HCl<HBr<HI。(2)最高价氧化物的水化物的酸性逐渐减弱,即HClO4>HBrO4>HIO4。
点拨:卤素单质性质中的特殊情况(1)F2能与水反应,反应方程式为2F2+2H2O===4HF+O2。因此,F2不能从溶液中置换出其他卤素单质。(2)通常情况下,氟没有正价,所以氟没有含氧酸。(3)溶解性:通常情况下,除F2外,卤素单质在水中的溶解度都不大,但是均易溶于有机溶剂。(4)卤素单质都有毒,液溴易挥发,保存时常用水密封。(5)溴单质在常温下是唯一一种液态非金属单质。(6)碘为紫色固体,易升华,淀粉遇I2变蓝色。(7)氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸。
1826年,法国的一位青年波拉德把海藻烧成灰,用热水浸取,再往里通氯气,这时,就得到紫黑色的固体——碘晶体。他发现在提取后的母液底部,总沉着一层深褐色的液体,这液体具有刺鼻的臭味。详细地进行研究后证明,这深褐色的液体,是一种人们还未发现的新元素。科学家把这种新元素称为“溴”。德国著名的化学家李比希也做过和波拉德相似的实验,看到过这一奇怪的现象,所不同的是,李比希没有深入地钻研下去,只凭空地断定这深褐色的液体只不过是氯化碘(ICl)——通氯气时,氯和碘形成的化合物。因此,他只是往瓶子上贴了一张“氯化碘”的标签就完了,从而与溴元素失之交臂,没有发现这一新的元素。
(1)写出波拉德获得溴、碘单质的离子方程式。__________________________________________________________
Cl2+2Br-===Br2+2Cl-,Cl2+2I-===I2+2Cl-
(2)比较Cl-、Br-、I-的还原性强弱,并从原子结构角度解释原因。____________________________________________________________________________________________________________________________________________________________________________________________________________
Cl-、Br-、I-的还原性:Cl-
解析:F的次外层电子数为2,Br的次外层电子数为18,A项错误;元素的非金属性强弱可以根据其最高价氧化物对应水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,B项错误;F无正化合价,不能形成HFO4,C错误;由碘微溶于水,易溶于四氯化碳可推知,砹微溶于水,易溶于CCl4,D正确。
解答同主族元素原子结构和性质递变规律类题的常见思路
〔即时训练〕可能存在的第119号未知元素,有人称为“类钫”。根据周期表结构及元素性质变化趋势,下列有关“类钫”的预测中错误的是( )A.单质有较高的熔点B.“类钫”在化合物中呈+1价C.“类钫”具有放射性D.“类钫”单质的密度大于1 g·cm-3解析:“类钫”在周期表中处于碱金属元素的最下方,碱金属元素从上到下,原子半径逐渐增大,原子间作用力逐渐减小,单质的熔、沸点逐渐降低,A错误。
鲁科版 (2019)第1章 原子结构与元素性质第2节 原子结构与元素周期表课堂教学ppt课件: 这是一份鲁科版 (2019)第1章 原子结构与元素性质第2节 原子结构与元素周期表课堂教学ppt课件
鲁科版 (2019)选择性必修3第3节 烃集体备课课件ppt: 这是一份鲁科版 (2019)选择性必修3第3节 烃集体备课课件ppt,共58页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。
鲁科版 (2019)第2节 原子结构与元素周期表示范课ppt课件: 这是一份鲁科版 (2019)第2节 原子结构与元素周期表示范课ppt课件













