




第09讲 铁及其重要化合物(练)-2022年高考化学一轮复习讲练测
展开第三章 金属及其化合物
第09讲 铁及其重要化合物(精练)
完卷时间:50分钟
可能用到的相对原子质量:O 16 S 32 Ba 137
一、选择题(每小题只有一个正确选项,共12*5分)
1.(2021·北京西城区·高三二模)下列事实与电化学无关的是
A.暖宝宝(含铁粉、碳、氯化钠等)发热
B.海沙比河沙混凝土更易使钢筋生锈
C.家用铁锅生锈
D.铁罐运输浓硫酸
A.A B.B C.C D.D
【答案】D
【解析】A.暖宝宝中铁粉、碳在氯化钠溶液中构成原电池,铁发生吸氧腐蚀放出热量,与电化学有关,故A不符合题意;B.海沙中电解质的量大于河沙,钢筋在海沙中构成原电池时,由于电解质溶液浓度大,腐蚀速率快,则海沙比河沙混凝土更易使钢筋生锈与电化学有关,故B不符合题意;C.家用铁锅生锈是因为铁锅与锅中残留溶液构成原电池,发生吸氧腐蚀,则家用铁锅生锈与电化学有关,故C不符合题意;D.铁在冷的浓硫酸中发生钝化,则铁罐运输浓硫酸与铁的钝化有关,与电化学有无关,故D符合题意;故选D。
2.(2021·广东高三二模)一种利用回收含铜废铁粉中的的工艺如下:
下列说法错误的是
A.M是,与在该条件下较难发生反应
B.“气化”过程的化学方程式为
C.“分解”过程需要适当降低反应体系的压强
D.“分解”过程可在空气气氛的密闭容器内进行
【答案】D
【解析】A.Fe(CO)5分解得到5CO和Fe,故5M中的M代表CO,含铜废铁粉气化后仅得到Fe(CO)5,说明与在该条件下较难发生反应,故A正确;B.“气化”过程由CO与Fe生成Fe(CO)5,化学方程式为,故B正确;C.“分解”过程发生反应,,需要适当降低反应体系的压强有利于平衡向右移动,提高分解率,故C正确;D.“分解”过程后CO还需要重新回收利用,不能在空气气氛的密闭容器内进行,故D错误;故选D。
3.(2020·浙江绍兴市·高三一模)某同学为验证Fe3+的氧化性进行了如下实验:
序号
操作
现象
实验I
将2 mL 2 mol∙L−1Fe(NO3)3溶液加入有银镜的试管中
银镜消失
实验II
将2 mL1 mol∙L−1 Fe2(SO4)3溶液加入有银镜的试管中
银镜减少,未消失
实验III
将2mL2 mol∙L−1FeCl3溶液加入有银镜的试管中
银镜消失
实验IV
将2mL 1 mol∙L−1 AgNO3溶液加入到1 mL 1 mol∙L−1 FeSO4溶液中
产生白色沉淀,随后有黑色固体产生
已知相同条件下AgCl的溶解度小于Ag2SO4.下列说法不正确的是
A.实验I不能说明Fe3+氧化了Ag
B.实验II和III说明溶液中存在平衡: Fe3++AgFe2++ Ag+
C.实验IV中产生白色沉淀,说明Ag+氧化了Fe2+
D.欲证明实验IV中产生了Fe3+,可以取上层清液滴加KSCN溶液
【答案】C
【解析】A.实验I中铁离子水解显酸性,含有硝酸根,(H+)的氧化性强于Fe3+,因此不能说明Fe3+氧化了Ag,故A正确;B.实验II中银镜未消失,实验III银镜消失,说明实验II和III说明溶液中存在平衡:Fe3++AgFe2++ Ag+,实验III生成的Ag+和Cl-反应得到AgCl沉淀,消耗Ag+,Ag+浓度减小,致使平衡不断正向移动,故B正确;C.实验IV中产生白色沉淀,生成了Ag2SO4沉淀,Ag+具有强氧化性会氧化Fe2+变为Fe3+,而自身变为黑色的Ag,故C错误;D.欲证明实验IV中产生了Fe3+,可以取上层清液滴加KSCN溶液,若溶液变为血红色,说明含有Fe3+,若不变血红色,则说明不含有Fe3+,故D正确;综上所述,答案为C。
4.(2020·江西高三月考)压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
A.Fe2(SO4)3可以视为该脱硫过程中的催化剂
B.该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C.该脱硫过程不能在高温下进行
D.该脱硫过程是将H2S转化为FeSO4
【答案】D
【解析】天然气中的脱硫原理是:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁;A.T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3在整个过程中质量和化学性质不变,可以视为催化剂,故A正确;B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3视为催化剂,因此脱硫过程O2间接氧化H2S,总反应为:2H2S+O2=2S+2H2O,故B正确;C.T.F菌的主要成分为蛋白质,高温下蛋白质会发生变性,因此该脱硫过程不能在高温下进行,故C正确;D.T.F菌在酸性溶液中可实现天然气的催化脱硫,根据图示,Fe2(SO4)3氧化硫化氢生成硫,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,故D错误;答案选D。
5.(2020·浙江嘉兴市·高三一模)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,其制备原理用化学方程式表示为:3NaClO+2FeCl3+10NaOH=2Na2FeO4+9NaCl+5H2O。下列说法不正确的是
A.Na2FeO4中Fe元素是+6价 B.还原产物是NaCl
C.FeCl3是还原剂 D.NaClO被氧化
【答案】D
【解析】A.根据化合物中各元素化合价之和为0可知,Na2FeO4中Fe元素是+6价,A正确;B.NaClO被FeCl3还原得到NaCl,因此NaCl是还原产物,B正确;C.FeCl3中Fe的化合价升高,失去电子,作还原剂,C正确;D.NaClO中Cl的化合价降低,得到电子,作氧化剂,被还原,D错误;答案选D。
6.(2021·山东高三二模)利用反应2FeC2O4·2H2O+H2O2+3K2C2O4+H2C2O4=2K3[Fe(C2O4)3]·3H2O可制备光敏材料三草酸合铁酸钾晶体。下列说法正确的是
A.H2O2是含有非极性键的极性分子
B.激发态的钾原子回到基态,会形成吸收光谱
C.向草酸亚铁溶液中滴加酸性KMnO4溶液,紫色褪去可证明溶液中含有Fe2+
D.H2C2O4 ()与CH3COOH相比,可电离出的H+个数更多,所以酸性更强
【答案】A
【解析】A.H2O2结构式为H-O-O-H,含有极性共价键H-O和非极性共价键O-O,极性不能抵消,是含有非极性键的极性分子,A说法正确;B.激发态的钾原子回到基态,释放能量,会形成发射光谱,B说法错误;C.向草酸亚铁溶液中滴加酸性KMnO4溶液,草酸根离子与亚铁离子均有还原性,则紫色褪去不能证明溶液中含有Fe2+,C说法错误;D.酸的强弱与其电离出的H+个数无关,D说法错误;答案为A。
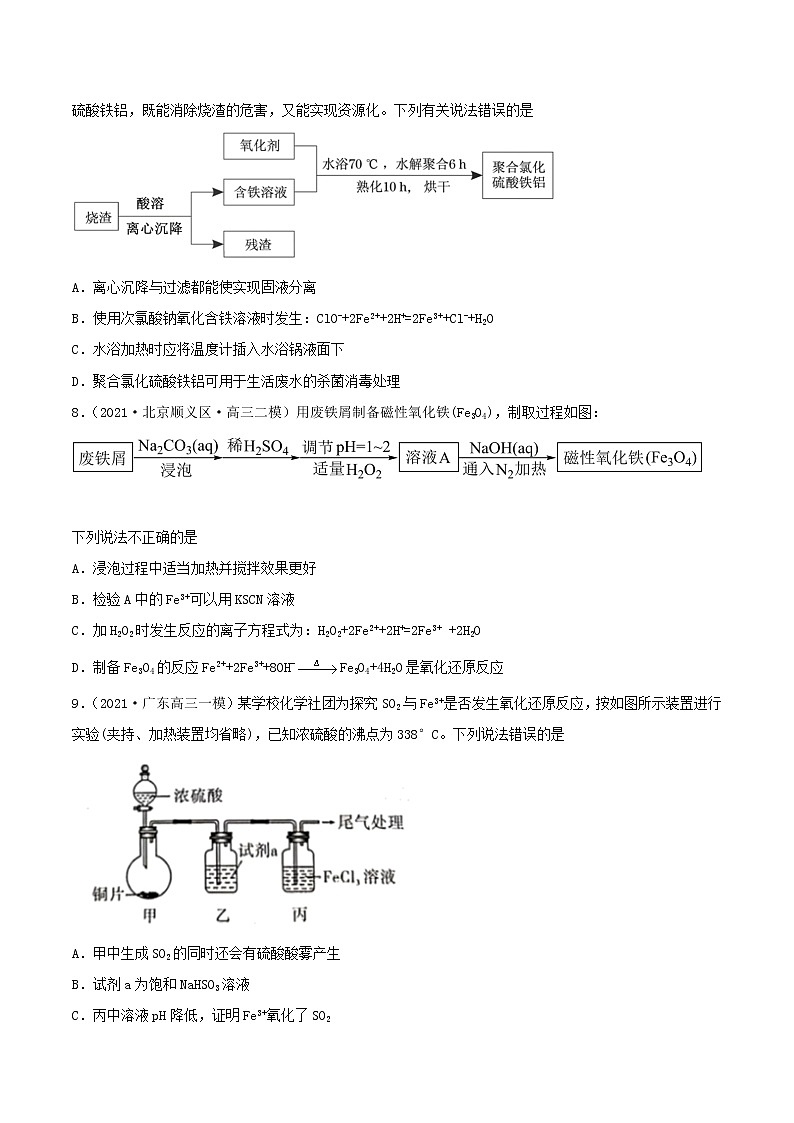
7.(2021·福建福州市·高三三模)硫铁矿烧渣是生产硫酸的固体废弃物,用其制备高效絮凝剂聚合氯化硫酸铁铝,既能消除烧渣的危害,又能实现资源化。下列有关说法错误的是
A.离心沉降与过滤都能使实现固液分离
B.使用次氯酸钠氧化含铁溶液时发生:ClO-+2Fe2++2H+=2Fe3++Cl-+H2O
C.水浴加热时应将温度计插入水浴锅液面下
D.聚合氯化硫酸铁铝可用于生活废水的杀菌消毒处理
【答案】D
【解析】A.硫铁矿烧渣用硫酸处理后,可溶性物质进入溶液,难溶性的物质仍以固体形式存在,可以通过过滤的方法实现固液分离;也可以在离心力作用下,使分散在分散剂中的固相分散质分离出来,即采用离心沉降方法实现固液分离,A正确;B.次氯酸钠具有强氧化性,会将Fe2+氧化为Fe3+,ClO-被还原为Cl-,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式为:ClO-+2Fe2++2H+=2Fe3++Cl-+H2O,B正确;C.水浴加热时要使用温度计测量水的温度,因此应将温度计插入水浴锅液面下,并且温度计不能接触锅壁或锅底,C正确;D.聚合氯化硫酸铁铝在水中能够水解产生氢氧化铝胶体、氢氧化铁胶体,这些胶体表面积大,吸附力强,能够吸附水中悬浮的固体小颗粒,使之形成沉淀而除去,因此可用于生活废水的净化作用,但由于不具有强氧化性,因此不能起杀菌消毒作用,D错误;故合理选项是D。
8.(2021·北京顺义区·高三二模)用废铁屑制备磁性氧化铁(Fe3O4),制取过程如图:
下列说法不正确的是
A.浸泡过程中适当加热并搅拌效果更好
B.检验A中的Fe3+可以用KSCN溶液
C.加H2O2时发生反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3+ +2H2O
D.制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O是氧化还原反应
【答案】D
【解析】A.浸泡过程中适当加热并搅拌可以提高反应速率和充分接触,效果更好,A正确;B.检验铁离子可以用硫氰化钾,溶液显红色,B正确;C.过氧化氢能氧化亚铁离子,离子方程式为H2O2+2Fe2++2H+=2Fe3+ +2H2O,C正确;D.制备Fe3O4的反应Fe2++2Fe3++8OH-Fe3O4+4H2O中没有元素化合价变化,不是氧化还原反应,D错误;故选D。
9.(2021·广东高三一模)某学校化学社团为探究SO2与Fe3+是否发生氧化还原反应,按如图所示装置进行实验(夹持、加热装置均省略),已知浓硫酸的沸点为338°C。下列说法错误的是
A.甲中生成SO2的同时还会有硫酸酸雾产生
B.试剂a为饱和NaHSO3溶液
C.丙中溶液pH降低,证明Fe3+氧化了SO2
D.若Fe3+氧化了SO2,则在丙中的溶液中滴加K3[Fe(CN)6]溶液,会出现蓝色沉淀
【答案】C
【解析】A.铜和浓硫酸反应需要加热,硫酸的沸点为338℃,所以甲中生成SO2的同时还会有硫酸酸雾产生,故A正确;B.为了除去SO2中的硫酸酸雾,可以选择饱和NaHSO3溶液,故B正确;C.丙中溶液pH降低,也可能是SO2溶于水生成了亚硫酸,不能证明是Fe3+氧化了SO2,故C错误;D.若Fe3+氧化了SO2,则生成了Fe2+,Fe2+和K3[Fe(CN)6]反应会出现蓝色沉淀,故D正确;故选C。
10.(2021·北京石景山区·高三一模)某小组对Fe2+和Ag+的反应进行了如下探究实验:
操作
现象
Ag+ 浓度变化曲线
实验Ⅰ
向1 mL 0.1 mol/L FeSO4溶液中加入1 mL 0.1 mol/L AgNO3溶液
几分钟后,出现大量灰黑色浑浊
实验Ⅱ
先向试管中加入几滴Fe2(SO4)3溶液,然后重复实验Ⅰ的操作
现象与实验Ⅰ相同
(已知:Ag2SO4为白色微溶物;反应过程中测得温度几乎无变化)
下列说法正确的是
A.实验Ⅰ只发生反应:Fe2++Ag+⇌Fe3++Ag,灰黑色浑浊是Ag
B.图中c(Ag+)由a→b急速变化的可能原因是反应放热
C.图中c(Ag+)由a→b急速变化的可能原因是生成的Ag起催化作用
D.图中c(Ag+)由a→b急速变化的可能原因是生成的Fe3+起催化作用
【答案】C
【解析】A.Ag2SO4为白色沉淀,故溶液中还可发生:2Ag++S=Ag2SO4↓,灰黑色浑浊应是Ag和Ag2SO4的混合物,故A错误;B.反应过程中测得温度几乎无变化,说明反应热效应不明显,故B错误;C.实验Ⅱ中,先加入Fe2(SO4)3溶液,然后重复实验Ⅰ的操作,现象与实验Ⅰ相同,结合反应Fe2++Ag+⇌Fe3++Ag可知,应是生成的Ag起催化作用,故C正确;D.实验Ⅱ中,先加入Fe2(SO4)3溶液,然后重复实验Ⅰ的操作,现象与实验Ⅰ相同,说明Fe3+没起催化作用,故D错误;答案选C。
11.(2021·河南郑州市·高三二模)某学习小组探究铁丝(含杂质碳)与浓硫酸的反应,反应装置如下图。下列说法错误的是
A.无法直接使用pH试纸来判断反应后硫酸是否剩余
B.可用KSCN和K3[Fe(CN)6]检验反应后溶液中铁元素的价态
C.将22.4mL(标准状况下)反应生成的气体通入足量氯水中,再滴加足量BaCl2溶液,最终得到0.233g沉淀
D.生成的气体通入BaCl2溶液产生白色浑浊,可能是硫酸蒸气逸出或部分SO2被氧化所致
【答案】C
【解析】铁和浓硫酸在加热的条件下反应生成硫酸铁、二氧化硫、水,随着反应的进行,浓硫酸变稀,铁和稀硫酸反应生成硫酸亚铁和氢气。
A.生成物中含有SO2,SO2溶于水生成H2SO3,使溶液显酸性,因此不能直接使用pH试纸来判断反应后硫酸是否剩余,A项正确;B.K3[Fe(CN)6]与Fe2+作用产生蓝色沉淀,K3[Fe(CN)6]可检验Fe2+,KSCN与Fe3+作用,溶液变红色,KSCN可检验Fe3+,B项正确;C.反应生成的气体中含有SO2、H2,混合气体的总物质的量为,若气体都为SO2,根据S元素守恒,生成沉淀的物质的量为0.001mol,则产生沉淀的质量为,但实际上,SO2物质的量小于0.001mol,则沉淀质量小于0.233g,C项错误;D.生成的气体通入BaCl2溶液,由于硫酸蒸气逸出或部分SO2被氧化生成,会和Ba2+反应生成BaSO4白色沉淀,D项正确;答案选C。
12.(2020·邵东市第一中学高三月考)黄铁矿(主要成分FeS2),在空气中会被缓慢氧化,氧化过程如图所示。下列说法不正确的是
A.发生反应a时,0.05mol FeS2被氧化时消耗标准状况下空气的体积大约19.6L
B.为了验证b过程反应后溶液中含Fe2+,可选用KSCN溶液和氯水
C.c发生反应的离子方程式为:14Fe3+ +FeS2+8H2O=15Fe2++2SO42-+16H+
D.已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,则该温度下d逆反应的平衡常数为K=2.79×103
【答案】B
【解析】A.据图可知反应a中FeS2被氧化生成Fe2+和SO42-,Fe元素化合价不变,S元素化合价升高+7价,所以0.05mol FeS2被氧化时转移电子0.7mol,消耗氧气0.175mol,氧气占空气体积,所以消耗空气0.875mol,标况下体积为0.875mol×22.4L/mol=19.6L,故A正确;B.经反应b后溶液中一定存在Fe3+,无论是否含有Fe2+,滴加KSCN溶液均会显红色,加入氯水后现象不变,无法检验Fe2+,故B错误;C.反应c中反应物有FeS2、Fe3+,产物有Fe2+和SO42-,说明该过程中铁离子将硫元素氧化,生成SO42-,结合电子守恒和元素守恒可知离子方程式为14Fe3+ +FeS2+8H2O=15Fe2++2SO42-+16H+,故C正确;D.d的逆反应为Fe(OH)3+3H+Fe3++3H2O,该反应的平衡常数K==2.79×103,故D正确;故答案为B。
二、主观题(共3小题,共40分)
13.(2021·上海杨浦区·高三一模)(14分)(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)是一种重要的化工原料,用途广泛。完成下列填空:
(1)铁在元素周期表的第ⅦB和第ⅠB之间。铁位于第___周期___族。
(2)写出Fe与水反应的化学方程式:___。
(3)将(NH4)2Fe(SO4)2中非金属元素的简单阴离子按半径由小到大的顺序排列:___。
(4)同温度同浓度的FeSO4和(NH4)2Fe(SO4)2溶液中,c(Fe2+)是否相等___?为什么?___。
(5)设计实验,证明(NH4)2Fe(SO4)2·6H2O晶体中含有Fe2+___。
(6)已知:(NH4)2Fe(SO4)2·6H2O在200℃失去全部结晶水。将一定质量的粉末状该晶体置于坩埚中,保持200℃受热,经冷却、恒重等正确操作,计算得到的1mol晶体中结晶水含量总是偏低,偏低的可能原因是___(写一条即可)。
【答案】(除标注外,每空2分)(1)四(或4)(1分) Ⅷ (1分)
(2)
(3) r(H-)<r(O2-)<r(N3-)<r(S2-)
(4)不相等 因为Fe2++2H2OFe(OH)2+2H+、NH+H2ONH3·H2O+H+,的水解会抑制Fe2+水解,使(NH4)2Fe(SO4)2中c(Fe2+)偏大
(5)取样少许,加水(或稀硫酸)溶解,滴加KSCN溶液,无明显现象,滴加少量氯水,溶液变为血红色,说明含Fe2+
(6)(NH4)2Fe(SO4)2·6H2O在坩埚中受热分解时,Fe2+可能会被空气中的氧气部分氧化,增加了氧元素的质量,使结晶水含量的测定偏低
【解析】(1)位于第四周期,价电子共有8个,位于周期表的第8列,周期表中8、9、10三列合称第Ⅷ族,即铁位于第四周期第Ⅷ族。
(2)Fe与水蒸气反应生成Fe3O4和H2,反应方程式为:;
(3)四种非金属元素简单阴离子分别为:H-、N3-、S2-、O2-,其中H-电子层为一层,半径最小,S2-电子层为三层,半径最大,N3-、O2-电子层均为两层,但O的核电荷数大,对核外电子引力强,故半径小,所以四种离子半径大小顺序为:r(H-)<r(O2-)<r(N3-)<r(S2-);
(4)(NH4)Fe(SO4)2中Fe2+水解与水解相互抑制,水解程度比FeSO4中Fe2+水解程度小,故(NH4)Fe(SO4)2中Fe2+浓度大于FeSO4中Fe2+浓度;
(5)证明(NH4)Fe(SO4)2中含有Fe2+,可以通过将Fe2+氧化为Fe3+检验,但需排除原有Fe3+干扰,故应该先加KSCN,再氧化Fe2+,具体方案为:取样少许,加水(或稀硫酸)溶解,滴加KSCN溶液,无明显现象,滴加少量氯水,溶液变为血红色,说明含Fe2+;
(6)由于样品中铁元素为二价,易被氧化,题目操作未说明隔绝空气,故会产生误差,即 (NH4)2Fe(SO4)2·6H2O在坩埚中受热分解时,Fe2+可能会被空气中的氧气部分氧化,增加了氧元素的质量,使结晶水含量的测定偏低。
14.(2020·兰州市第七中学高三月考)(10分)以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3− =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4− = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
【答案】(除标注外,每空2分)(1)SiO2 (1分)提高钴元素的利用率(或其他合理答案) (1分)
(2)6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O
(3)取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化
(4) 6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑
(5)防止因温度降低,CoCl2晶体析出
【解析】(1)含钴废催化剂中含有的Fe、Co均可溶于硫酸,而SiO2不溶,所以滤渣的是SiO2 ,洗涤滤渣的洗涤液中含有钴的化合物,为了提高钴元素的利用率,将洗液与滤液合并;
本题答案为:SiO2 ,提高钴元素的利用率;
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是:6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O;
本题答案为:6Fe2++6H++ClO3- 6Fe3++Cl-+3H2O;
(3)依据所给信息,Fe2+和[Fe(CN)6]3−反应,生成蓝色Fe3[Fe(CN)6]2沉淀,故确定Fe2+是否氧化完全的方法是:取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化;
本题答案为:取少许氧化后的溶液于试管中滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则说明Fe2+已全部被氧化;
(4)氧化后的溶液中,含有Fe3+,加入Na2CO3后,生成[Na2Fe6(SO4)4(OH)12]沉淀和CO2气体,离子方程式为:6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑;
本题答案为:6Fe3++4SO42-+6H2O+2Na++6CO32- =Na2Fe6(SO4)4(OH)12↓+6CO2↑;
(5)由CoCl2的溶解度曲线可知,随温度的升高,CoCl2的溶解度增大,所以趁热过滤,防止温度降低CoCl2晶体析出;
本题答案为:防止因温度降低,CoCl2晶体析出。
15.(2021·四川攀枝花市·高三一模)(16分)高铁酸钾(K2FeO4)是高效消毒剂,也是制作大功率电池的重要材料。某实验小组欲制备K2FeO4并探究其性质。
(查阅资料)K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性, 在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
Ⅰ.制备K2FeO4 夹持装置略)
(1)A中发生反应的化学方程式是___________。
(2)下列试剂中,装置B的X溶液可以选用的是___________ 。
A.饱和食盐水 B.浓盐酸 C.饱和氯水 D.NaHCO3溶液
(3)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是___________ ;若要从反应后的装置C中尽可能得到更多的K2FeO4固体,可以采取的一种措施是___________。
Ⅱ.探究K2FeO4的性质
(4)取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得到溶液a。经检验气体中含有Cl2,为 证明是K2FeO4氧化了Cl-,而不是ClO-氧化了Cl-,设计以下方案:
方案I
取少量a,滴加KSCN溶液至过量,溶液呈红色
方案II
用KOH溶液洗净C中所得固体,再用一定浓度的KOH溶液将K2FeO,溶出,得到紫色溶液b,取少量b,滴加盐酸.有Cl2产生。
①由方案Ⅰ中溶液变红可知a中含有离子是___________,但该离子的来源不能判断一定是K2FeO4与Cl-反应的产物,还可能是反应___________(用离子方程式表示)的产物。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的,一是使减少K2FeO4溶解损失,二是___________。
(5)小组同学利用制备的K2FeO4制成如图简易电池,发现放电后两极都产生红褐色悬浮物,则该电池的总反应为___________;该电池放电时,正极电极反应式为___________。
【答案】(除标注外,每空2分)(1)KClO3 + 6HCl(浓)=KCl +3Cl2↑+ 3H2O
(2) AC 3Cl2 + 2Fe(OH)3 +10KOH =2K2FeO4 + 6KCl + 8H2O
(3) 加入乙醇(1分)
(4)①Fe3+(1分)4FeO+ 20H+=4Fe3++3O2↑+10H2O ②除尽K2FeO4表面吸附的ClO﹣,防止ClO﹣与Cl﹣在酸性条件下反应产生Cl2,避免ClO﹣干扰实验
(5)Fe + K2FeO4 + 4H2O=2Fe(OH)3 + 2KOH FeO+ 4H2O +3e﹣= Fe(OH)3 + 5OH﹣
【解析】装置A是制取氯气,反应方程式;KClO3 + 6HCl(浓)=KCl +3Cl2↑+ 3H2O,得到的氯气中混有HCl杂质气体,经装置B除杂,纯净的氯气通入装置C中发生反应:3Cl2 + 2Fe(OH)3 +10KOH =2K2FeO4 + 6KCl + 8H2O,用装置D来吸收过量的尾气中有毒的氯气。
(1)装置A中是氯元素发生归中反应,发生反应的化学方程式是:KClO3 + 6HCl(浓)=KCl +3Cl2↑+ 3H2O;
(2) 装置B是为了除去氯气中的HCl气体,A.饱和食盐水能溶解HCl,可选;B.浓盐酸有挥发性,氯气中还混有HCl杂质,不选;C.饱和氯水能减小氯气的溶解,能溶解HCl,可选;D.NaHCO3溶液可与HCl反应产生CO2,氯气中混有杂质气体,不选;则X溶液可以选用的是:AC;
(3) C中得到紫色固体和溶液,C中通入氯气将氢氧化亚铁氧化,生成高铁酸钾(K2FeO4),化学方程式为:3Cl2 + 2Fe(OH)3 +10KOH =2K2FeO4 + 6KCl + 8H2O;已知K2FeO4不溶于乙醇,为了析出更多固体,措施是:加入乙醇;
(4) ①i.Fe3+离子与SCN-发生络合反应,生成红色的络离子,由方案I中溶液变红可知溶液a中含有Fe3+离子;但该离子的存在不能判断一定是K2FeO4,氧化了Cl2,因为K2FeO4在酸性溶液中不稳定,K2FeO4在酸性溶液中发生反应的离子方程式4FeO+ 20H+=4Fe3++3O2↑+10H2O;
②方案Ⅱ可证明K2FeO4,氧化了Cl-,用KOH溶液洗涤的目的是确保K2FeO4在碱性环境中的稳定性,同时除尽K2FeO4表面吸附的ClO﹣,防止ClO﹣与Cl﹣在酸性条件下反应产生Cl2,避免ClO﹣干扰实验;
(5) 放电时为原电池原理,电池中Fe与K2FeO4反应生成Fe(OH)3,该电池放电时的总反应为Fe+K2FeO4+4H2O=2Fe(OH)3+2KOH,正极为FeO得3mol电子生成Fe(OH)3,电极反应式为:FeO+ 4H2O +3e﹣= Fe(OH)3 + 5OH﹣。
最新高考化学一轮复习【讲通练透】 第10讲 铁及其重要化合物(练透): 这是一份最新高考化学一轮复习【讲通练透】 第10讲 铁及其重要化合物(练透),文件包含第10讲铁及其重要化合物练透教师版docx、第10讲铁及其重要化合物练透学生版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
最新高考化学一轮复习【讲通练透】 第10讲 铁及其重要化合物(讲通): 这是一份最新高考化学一轮复习【讲通练透】 第10讲 铁及其重要化合物(讲通),文件包含第10讲铁及其重要化合物讲通教师版docx、第10讲铁及其重要化合物讲通学生版docx等2份试卷配套教学资源,其中试卷共38页, 欢迎下载使用。
高考化学一轮复习讲练 第3章 第11讲 铁及其重要化合物 (含解析): 这是一份高考化学一轮复习讲练 第3章 第11讲 铁及其重要化合物 (含解析),共21页。试卷主要包含了铁的氢氧化物,025 ml×2=0等内容,欢迎下载使用。












