

高中化学第三节 化学键第2课时学案设计
展开
这是一份高中化学第三节 化学键第2课时学案设计,共8页。学案主要包含了共价键与共价化合物,化学键与分子间作用力等内容,欢迎下载使用。
一、共价键与共价化合物
1.共价键
(1)形成过程(以Cl2、HCl的形成为例):
(2)定义:原子间通过共用电子对所形成的相互作用。
(3)成键粒子:原子。
(4)成键元素:一般是同种的或不同种的非金属元素。
(5)分类
①非极性共价键简称非极性键:共用电子对不偏移的共价键。如Cl2。
②极性共价键简称极性键:共用电子对偏移的共价键。如HCl。
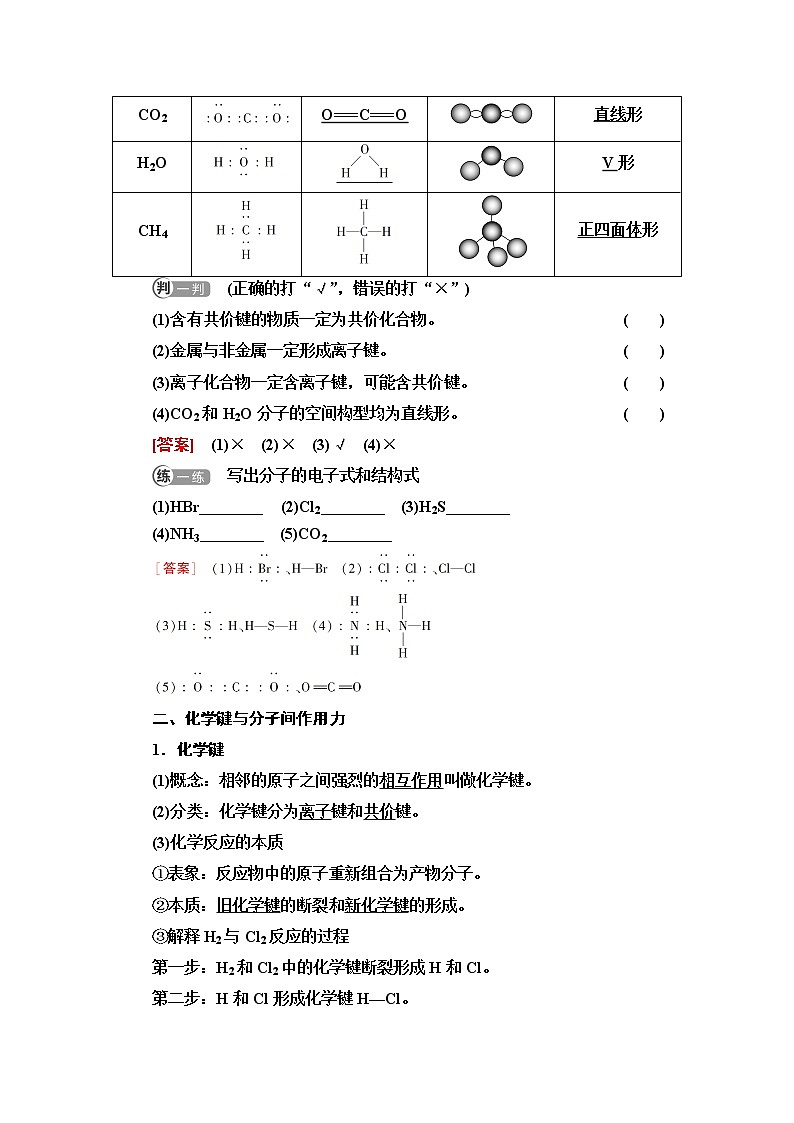
2.共价化合物:以共用电子对形成分子的化合物。如H2O、CO2、HCl等。
3.结构式:用短线“—”表示分子中共用电子对的式子。
如H2O:H—O—H,HCl:H—Cl。
4.分子结构的表示方法
(正确的打“√”,错误的打“×”)
(1)含有共价键的物质一定为共价化合物。( )
(2)金属与非金属一定形成离子键。( )
(3)离子化合物一定含离子键,可能含共价键。( )
(4)CO2和H2O分子的空间构型均为直线形。( )
[答案] (1)× (2)× (3)√ (4)×
写出分子的电子式和结构式
(1)HBr________ (2)Cl2________ (3)H2S________
(4)NH3________ (5)CO2________
二、化学键与分子间作用力
1.化学键
(1)概念:相邻的原子之间强烈的相互作用叫做化学键。
(2)分类:化学键分为离子键和共价键。
(3)化学反应的本质
①表象:反应物中的原子重新组合为产物分子。
②本质:旧化学键的断裂和新化学键的形成。
③解释H2与Cl2反应的过程
第一步:H2和Cl2中的化学键断裂形成H和Cl。
第二步:H和Cl形成化学键H—Cl。
2.分子间作用力
(1)定义:分子之间还存在一种把分子聚集在一起的作用力叫做分子间作用力,最初叫范德华力。
(2)分类:分子间作用力分为范德华力和氢键。其中范德华力比化学键弱的多;氢键不是化学键,比化学键弱,比范德华力强。
3.冰浮在水面上的原因是冰中水分子间以氢键结合成排列规整的晶体,结构中有空隙,造成体积的膨胀,密度减小至低于液态水的密度。
(正确的打“√”,错误的打“×”)
(1)任何分子中均存在化学键。( )
(2)NaOH中存在的化学键有离子键和共价键。( )
(3)分子间作用力的大小影响了一些物质的熔沸点。( )
(4)H2O比H2S稳定的原因是H2O分子间有氢键。( )
(5)DNA的结构和生理活性与氢键有关。( )
[答案] (1)× (2)√ (3)√ (4)× (5)√
下面是同学们熟悉的物质:①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
请回答:
(1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有共价键又含有离子键的是________;不存在化学键的是________。
(2)属于共价化合物的是________;属于离子化合物的是________。
(3)将NaHSO4溶于水,破坏了NaHSO4中的__________________
________,写出其电离方程式_________________________________;
NaHSO4在熔融状态下电离,破坏了________,写出其电离方程式____________________________________________________________________
[答案] (1)①②④ ③ ⑤⑥⑦⑨⑩ ⑧ (2)④
③⑤⑥⑦⑨⑩ (3)离子键和共价键 NaHSO4===Na++H++SOeq \\al(2-,4) 离子键 NaHSO4===Na++HSOeq \\al(-,4)
1.离子键与共价键的区别
2.离子化合物和共价化合物的判断方法
(1)根据化学键的类型来判断;凡含有离子键的化合物一定是离子化合物;只含有共价键的化合物是共价化合物。
(2)根据化合物的类型来判断:大多数碱性氧化物、强碱和大多数盐都属于离子化合物(特例:AlCl3为共价化合物);非金属氢化物、非金属氧化物、含氧酸等都属于共价化合物。
(3)根据化合物的性质来判断:一般熔、沸点较低的化合物是共价化合物;熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导电的化合物是共价化合物,如AlCl3。
1.下列各组物质中,每种物质都是既有离子键又有共价键的一组是 ( )
A.NaOH H2SO4 (NH4)2SO4
B.MgO Na2SO4 HNO3
C.Na2O2 KOH Na3PO4
D.HCl Na2O MgCl2
C [H2SO4中只有共价键,A错误;MgO中只有离子键,HNO3中只有共价键,B错误;各物质中既有离子键又有共价键,C正确;HCl中只有共价键,Na2O、MgCl2中只有离子键,D错误。]
2.下列化合物中,含有非极性键的离子化合物是( )
A.Ba(OH)2 B.H2SO4
C.Na2O2D.CaCl2
C [Ba(OH)2中含有离子键和极性键,A项错误;H2SO4中仅含有共价键,是共价化合物,B项错误;Na2O2中含有离子键(Na+和Oeq \\al(2-,2)之间)和非极性键(Oeq \\al(2-,2)内部),C项正确;CaCl2中仅含有离子键,D项错误。]
3.下列性质中,可以证明某化合物中一定存在离子键的是( )
A.可溶于水B.具有较高的熔点
C.水溶液能导电D.熔融状态下能导电
D [含离子键的化合物属于离子化合物,由阴、阳离子构成,在熔融状态下,阴、阳离子可以在电场中做定向移动而导电,而A、B、C项所述性质并非离子化合物所独有,故不能作为判断某化合物中一定存在离子键的依据,D项正确。]
4.下列说法正确的有________(填序号)。
①NaHSO4中含有离子键和共价键,存在Na+、H+和SOeq \\al(2-,4)
②钠的氧化物中只含离子键
③原子最外层只有一个电子的元素原子跟卤素原子结合时,所形成的化学键一定是离子键
④全部由非金属元素组成的物质可能含离子键
⑤Na2O2与H2O2为均含非极性共价键的离子化合物
⑥冰中既含共价键又含分子间作用力
⑦盐中一定存在离子键,可能共存共价键
⑧NaOH与NH4Cl中既存在离子键又存在共价键
[答案] ④⑥⑧
化学键与化合物的关系
(1)部分物质中不一定含有化学键。例如稀有气体分子中不含有化学键。
(2)金属与非金属形成的化学键不一定都是离子键,也有共价键。例如AlCl3中没有离子键,只有共价键。
(3)含有共价键的化合物不一定是共价化合物,也可能是离子化合物,例如NaOH是离子化合物。
(4)只含有非金属元素的化合物不一定是共价化合物,也可能是离子化合物。例如铵盐中不含有金属元素,但是属于离子化合物。
(5)含非极性键的化合物可能是共价化合物,也可能是离子化合物如H2O2、Na2O2等。
1.下列说法正确的是( )
A.只含有共价键的物质属于共价化合物
B.所有物质中均含有化学键
C.含有离子键的物质肯定含金属元素
D.只要含离子键的化合物就属于离子化合物
D [只含有共价键的化合物属于共价化合物,物质包括单质和化合物,A错误;稀有气体中无化学键,B错误;铵盐是离子化合物,但无金属元素,C错误;只要含离子键的化合物就属于离子化合物,D正确。]
2.某元素原子最外层只有1个电子,它跟卤素原子相结合时,所形成的化学键( )
A.一定是共价键
B.一定是离子键
C.可能是共价键,也可能是离子键
D.以上说法均不正确
C [原子最外层只有1个电子的元素,可以是第ⅠA族元素,也可以是少数过渡金属元素。若是H,与卤素以共价键结合成卤化氢;若是碱金属元素,与卤素以离子键结合成卤化物;若为过渡金属元素,与卤素结合时,可能形成共价键,也可能形成离子键。]
3.人们发现金星大气层有一种称为羰基硫(COS)的分子,其结构与CO2类似,羰基硫是一种与生命密切相关的物质,下列推测不正确的是( )
A.COS是含有极性键的共价化合物
B.COS为直线形分子
C.COS的电子式为
D.COS的结构式为O===C===S
C [COS分子中含有C、O、S三种元素,都是非金属元素,与CO2的结构相似,因此COS是共价化合物,含有C===O键和C===S键,都是极性键,A项、D项正确;COS的结构与CO2类似,即COS为直线形分子,B项正确;COS相当于是CO2分子中的一个O原子换成了S原子得到的化合物,电子式是,C项错误。]
4.以下关于分子间作用力的叙述不正确的是( )
A.分子间作用力是一种较弱的化学键
B.分子间作用力较弱,破坏它所需能量较少
C.分子间作用力对物质的熔、沸点有影响
D.稀有气体分子间存在分子间作用力
A [化学键是相邻原子(离子)间强烈的相互作用,而分子间作用力是一种比化学键弱得多的作用力,不属于化学键,A项错误;分子间作用力较弱,破坏它所需能量较少,B项正确;由分子构成的物质,分子间作用力越大,其熔点、沸点越高,C项正确;稀有气体是单原子分子,不存在化学键,只存在微弱的分子间作用力,D项正确。]
5.现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl| ⑤H2O2 ⑥MgF2
(1)只由离子键构成的物质是________(填序号,下同)。
(2)只由极性键构成的物质是_____________________________。
(3)只由非极性键构成的物质是___________________________。
(4)由极性键和非极性键构成的物质是_____________________。
(5)由离子键和极性键构成的物质是_______________________。
(6)由离子键和非极性键构成的物质是____________________。
(7)属于离子化合物的物质是____________________________。
(8)属于共价化合物的物质是____________________________。
[答案] (1)⑥ (2)④ (3)① (4)⑤ (5)③ (6)② (7)②③⑥ (8)④⑤学 习 任 务
1.了解共价键、极性键、非极性键的概念,会用电子式表示共价键的形成过程。
2.会识别判断共价化合物,熟知分子结构的不同表示方法。
3.了解化学键的概念及化学反应的实质,培养学生“宏观辨识与微观探析”的核心素养。
分子
电子式
结构式
分子结构模型
分子空
间构型
H2
H:H
H—H
直线形
HCl
H—Cl
直线形
CO2
O===C===O
直线形
H2O
V形
CH4
正四面体形
比较两化学键与两化合物
离子键
共价键
概念
带相反电荷离子之间的静电作用
原子间通过共用电子对所形成的相互作用
成键微粒
阴、阳离子
原子
成键
条件
一般是活泼金属与活泼非金属化合时,易发生电子的得失形成离子键
一般是非金属元素的原子最外层电子未达到稳定状态,相互间通过共用电子对形成共价键
影响
因素
离子的半径越小,所带电荷数越多,离子键越强
原子半径越小,共用电子对数越多,共价键越牢固
相关学案
这是一份高中鲁科版 (2019)第3节 离子键、配位键与金属键第2课时导学案
这是一份人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键学案,共19页。
这是一份高中化学人教版 (2019)必修 第一册第三节 化学键第3课时导学案及答案,共9页。










