






人教版九年级上册课题3 制取氧气一等奖ppt课件
展开第3节 制 取 氧 气
氧气的制取方法可分为:
1.掌握实验室制取氧气的三种基本方法的药品和原理。2.了解催化剂的含义和催化剂的重要作用。3.通过实验探究寻找反应的催化剂。
我们知道氧气有许多用途,那么我们如何制取氧气呢?
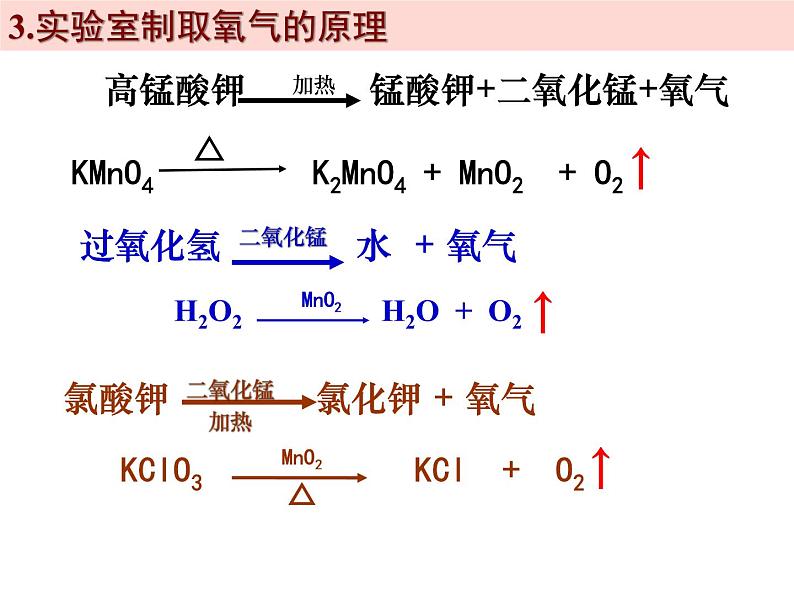
1、实验室制取氧气的常用方法:1.加热高锰酸钾(KMnO4);2.分解过氧化氢(H2O2)溶液;3.加热氯酸钾(KClO3)和二氧化锰(MnO2)的混合物。
快速阅读37页内容,快速找到实验室制取氧气的常用方法,划出横线记号。
(1)高锰酸钾(暗紫色固体)(2)过氧化氢溶液(无色液体) (又叫双氧水)(3)氯酸钾 和 二氧化锰 (白色固体) (黑色固体)
3.实验室制取氧气的原理
用过氧化氢溶液制取氧气,为什么要加入二氧化锰呢?它有什么作用呢?
步骤一:在常温下,在试管中加入5ml的过氧化氢溶液,把带火星的木条伸入试管,观察现象
探究:分解过氧化氢(H2O2)制取氧气的反应中二氧化锰的作用
步骤二:向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
步骤三:待上述试管中没有现象发生时,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象。待试管中有没有现象发生时,再重复上述操作。
少量气泡,木条不能复燃
常温下,过氧化氢分解缓慢,放出氧气很少
过氧化氢的分解速率加快,二氧化锰能加快过氧化氢的分解速率
二氧化锰化学性质没有发生变化
反映前后,二氧化锰质量没有变化
把少量二氧化锰加入到过氧化氢溶液中,把带火星的木条伸入试管中
待试管中没有现象发生时后,重新加入过氧化氢溶液,并把带火星的木条伸入试管中。重复上述操作
待反应结束后,过滤、洗涤干燥、称量
向试管加入5ml的过氧化氢溶液,把带火星的木条伸入试管
二氧化锰:一变:两不变
加快过氧化氢生成氧气的速率
本身的质量和化学性质反映前后不变
催化剂:在化学反应中能改变其他物质的反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。催化剂在化学反应中所起的作用叫做催化作用。
1.改变(增大或减小)其他物质的化学反应的速率。
2.质量和化学性质在反应前后没有发生变化。
1.不使用二氧化锰。过氧化氢会放出氧气么?2.二氧化锰能增加氧气的产量么?3.二氧化锰是反应物,生成物么?4.二氧化锰在反应中到底起什么作用?
不能,能产生氧气的是过氧化氢
都不是,反应物和生成物中都没有二氧化锰
改变化学反应的速率,催化作用
会,二氧化锰仅改变过氧化氢的速率,过氧化氢自身能分解过氧化氢
①特点:“一变,二不变”。 “一变”:改变速率—不是仅指加快反应速率,包括加快和减慢(但不能改变产物的质量)。“二不变”:指在化学反应前后质量不变、化学性质不变(物理性质可能改变)。②某种物质作催化剂是针对某一具体反应而言的。③某一反应的催化剂可以有多种。④催化剂不是反应物,也不是生成物,是反应条件。
要探究某物质是否能做催化剂应从哪些方面进行探究?
一变:改变化学反应速率两不变:催化剂反应前后的质量和化学性质
完成导学案 P29页分组实验和实验再探究
要设计那几个实验来探究呢?
【分组讨论】氧化铁、红砖粉、氧化铜、硫酸铜溶液等也可作为过氧化氢分解的催化剂,请你选择一种进行如下实验探究。
氧化铝加快了过氧化氢的分解速率
[提出问题]氧化铝能否作过氧化氢分解的催化剂?[做出猜想]氧化铝能作过氧化氢分解的催化剂。[实验验证]
向装有过氧化氢溶液的试管中,伸入带火星的木条
氧化铝是否也可作过氧化氢分解的催化剂?请你一起参与他们的探究。
[结论]氧化铝能加快过氧化氢的分解速率,故氧化铝能作过氧化氢分解的催化剂。[讨论与反思]经过讨论,有的同学认为只有上述两个证据,不能证明氧化铝能作过氧化氢分解的催化剂,还要补充一个探究实验。
探究氧化铝在反应前后质量是否改变
探究氧化铝在反应前后化学性质是否改变
实验3:[实验目的]探究 。[实验步骤】①准确称量氧化铝(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里剩余的物质进行过滤,洗涤,干燥,称量;④对比反应前后氧化铝的质量。[讨论]如果氧化铝在反应前后质量不变,则说明氧化铝可以作过氧化氢分解的催化剂。但小华认为:要证明猜想,上述三个实验还不够,还需要再增加一个探究实验,其目的是探究 。
【课堂检测】1.下列关于催化剂的叙述中,正确的是( )A.催化剂能改变其他物质的化学反应速率B.催化剂本身的质量和性质在化学反应前后不变C.不使用二氧化锰作催化剂,加热过氧化氢溶液不会放出氧气D.使用二氧化锰作催化剂,可以增加过氧化氢溶液分解放出氧气的质量2. 下表是根据一些反应事实或现象推理得出的影响化学反应的主要因素,其中不合理的是( )
3.某学生在加热氯酸钾制氧气的实验中,错把高锰酸钾当成二氧化锰放入氯酸钾中,其结果是( )A.反应速率快,生成氧气的量增多 B.反应速率快,生成氧气的量减少C.反应速率不变,生成氧气的量增多 D.反应速率不变,生成氧气的量不变
4.学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:氧化铜(CuO)能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。【作出猜想】猜想1.CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;猜想2.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;猜想3.CuO是反应的催化剂,反应前后_____________________。【进行实验】用天平称量0.2 g CuO,取5 mL 5%的过氧化氢溶液于试管中,进行如下实验:
质量和化学性质没有改变
(2)步骤①的目的是 。(3)过氧化氢能被CuO催化分解放出O2的符号表达式为 。
与实验③做对比,证明氧化铜能加快过氧化氢的分解速率
这节课你知道了哪些知识?
【核心知识要点小结】1.三种物质制取氧气的符号表达式:① ;② ; ③ 。2.催化剂是指在 里能 其他物质的 ,而本身的 和 在化学反应前后都 的物质。3.催化剂只能改变其他物质的 ,而不能改变生成物的 。
初中化学人教版九年级上册第二单元 我们周围的空气课题3 制取氧气优秀课件ppt: 这是一份初中化学人教版九年级上册第二单元 我们周围的空气课题3 制取氧气优秀课件ppt,共19页。PPT课件主要包含了实验步骤,装装入药品,排水集气法,向上排空气法,氧气不易溶于水,谐音茶庄定点收利息,安装注意点,教师点拨1,这是为什么呢,教师点拨2等内容,欢迎下载使用。
初中人教版课题3 制取氧气优秀课件ppt: 这是一份初中人教版课题3 制取氧气优秀课件ppt,共32页。PPT课件主要包含了学习目标,分解反应,化学反应,化合反应,基本反应类型,知识反馈,固液不加热型,固固加热型,气体收集装置,氧气的收集方法等内容,欢迎下载使用。
初中化学课题3 制取氧气课堂教学课件ppt: 这是一份初中化学课题3 制取氧气课堂教学课件ppt,共60页。PPT课件主要包含了H2O2,反应原理,仪器名称,想想看,①查②装,检验与验满等内容,欢迎下载使用。













