
高中化学鲁科版 (2019)选择性必修3第2节 有机化合物的结构与性质第1课时同步达标检测题
展开[核心素养发展目标] 1.了解碳原子的成键特点和成键方式的多样性,理解有机物分子结构决定于原子间的连接顺序、成键方式和空间排布,了解有机物分子的不同表示方法。2.通过有机物分子的结构模型,建立对有机物分子的直观认识,建立根据碳原子的成键方式分析有机物分子空间结构的思维模型。
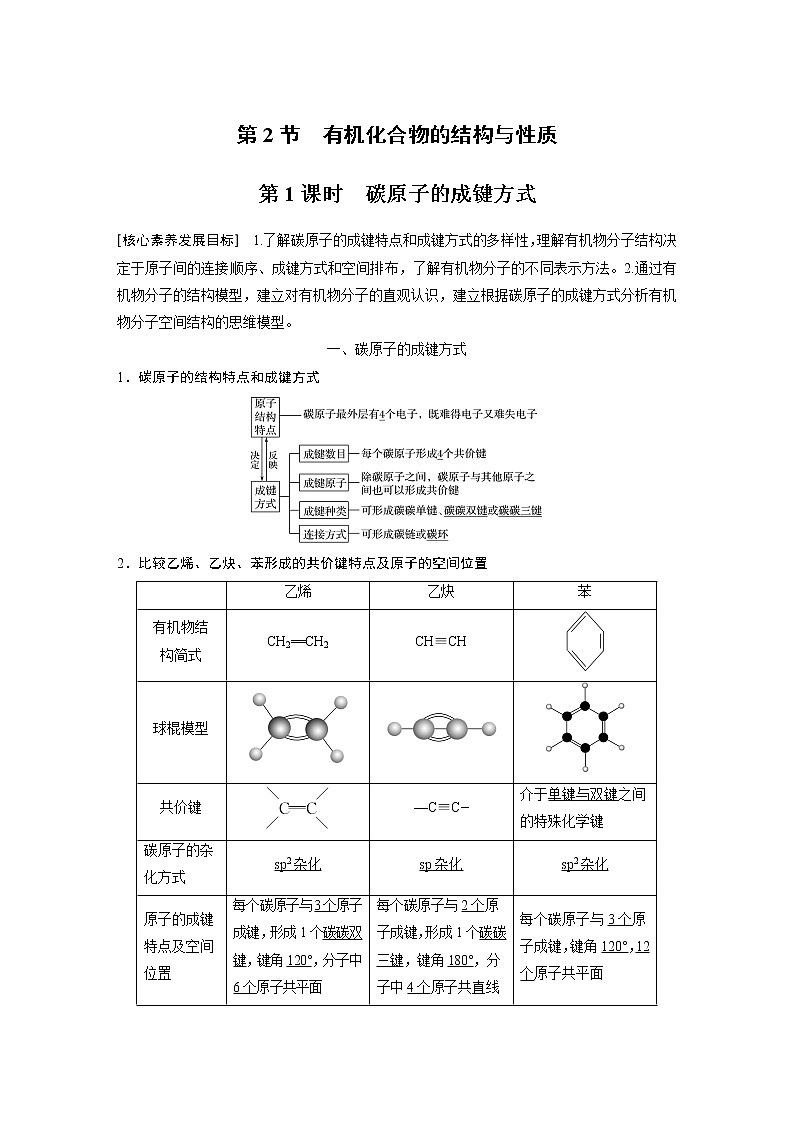
一、碳原子的成键方式
1.碳原子的结构特点和成键方式
2.比较乙烯、乙炔、苯形成的共价键特点及原子的空间位置
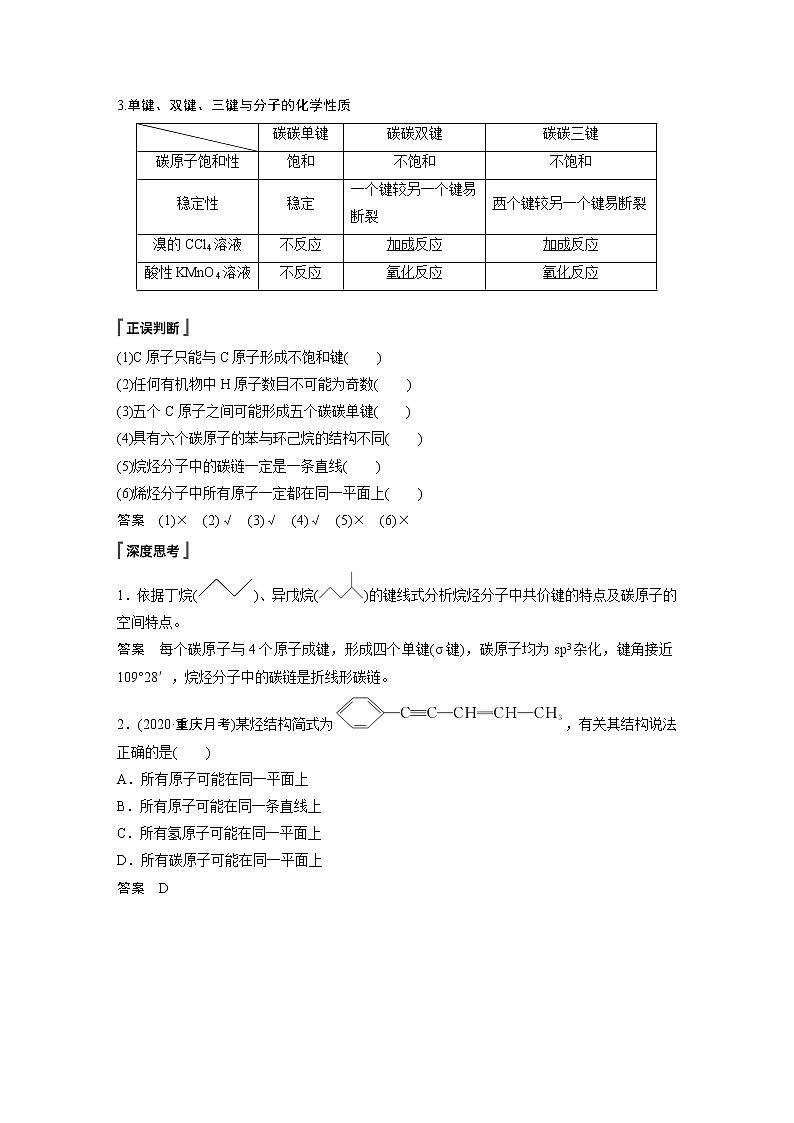
3.单键、双键、三键与分子的化学性质
(1)C原子只能与C原子形成不饱和键( )
(2)任何有机物中H原子数目不可能为奇数( )
(3)五个C原子之间可能形成五个碳碳单键( )
(4)具有六个碳原子的苯与环己烷的结构不同( )
(5)烷烃分子中的碳链一定是一条直线( )
(6)烯烃分子中所有原子一定都在同一平面上( )
答案 (1)× (2)√ (3)√ (4)√ (5)× (6)×
1.依据丁烷()、异戊烷()的键线式分析烷烃分子中共价键的特点及碳原子的空间特点。
答案 每个碳原子与4个原子成键,形成四个单键(σ键),碳原子均为sp3杂化,键角接近109°28′,烷烃分子中的碳链是折线形碳链。
2.(2020·重庆月考)某烃结构简式为,有关其结构说法正确的是( )
A.所有原子可能在同一平面上
B.所有原子可能在同一条直线上
C.所有氢原子可能在同一平面上
D.所有碳原子可能在同一平面上
答案 D
解析 该烃的结构简式可以写为。因为—CH3中的四个原子既不在同一直线上,也不在同一平面上,故A、B错;—CH3上的3个氢原子中,最多只有一个与其余原子共面,C错;如图所示,所有碳原子可能共平面,D对。
方法指导
结构不同的基团连接后原子共面分析
(1)平面与平面连接,如果两个平面结构通过单键相连,由于单键可旋转,两个平面可以重合,但不一定重合。
如苯乙烯:,分子中共平面原子至少12个,最多16个。
(2)平面与立体连接,如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。如分子中所有碳原子不在同一平面上。
二、极性键和非极性键
1.极性键和非极性键的概念
(1)极性键:不同元素的两个原子成键时,它们吸引共用电子的能力不同,共用电子将偏向吸引电子能力较强的一方,所形成的共价键。
存在:A—B、A==B,A≡B型键,成键的两个原子不同,它们吸引电子的能力不同,共用电子对偏向吸引电子对能力强的一方,使该方的原子带部分负电荷(用δ-表示),另一方元素的原子则带部分正电荷(δ+表示)。如碳氢单键(eq \(H,\s\up8(δ+))—eq \(C,\s\up8(δ-)))、碳氧单键(eq \(C,\s\up8(δ+))—eq \(O,\s\up8(δ-)))等。
(2)非极性键:同种元素的两个原子成键时,它们吸引共用电子的能力相同,所形成的共价键是非极性共价键,简称非极性键。
存在:A—A、A==A,A≡A型键,成键的两个原子相同,吸引电子的能力相同,共用电子对不偏向任何一方,因此参加成键的两个原子都不显电性。
2.共价键极性强弱判断
比较共价键极性强弱的实质是比较成键原子的电负性大小,一般成键原子所属元素电负性差值越大,键的极性越强。
3.共价键的极性与物质化学性质的关系
共价键是否具有极性及极性的强弱程度对有机化合物的性质有着重要的影响,一般来说,共价键的极性越强,反应中共价键越容易发生断裂,即反应活性越强。
(1)由不同元素的原子形成的共价键一定是极性键( )
(2)由同种元素的原子形成的双原子分子中的共价键一定是非极性键( )
(3)化合物中不可能含有非极性键( )
(4)当氧原子与氟原子形成共价键时,共用电子偏向氟原子( )
(5)乙烯分子中含有极性键和非极性键( )
(6)乙醇分子中“C—H”键的极性比“O—H”的极性弱( )
答案 (1)√ (2)√ (3)× (4)√ (5)√ (6)√
1.向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠,产生气泡速度较快的是Na与蒸馏水的反应,乙醇分子中“O—H”和水分子中“O—H”键的极性较强的是后者,由此得出的结论是:基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
2.由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,如乙醇与氢溴酸加热时,可断裂碳氧键发生取代反应,写出该反应的化学方程式:
3.(1)写出氯乙烷的结构式,并用①、②、③等数字标出极性键的部位。
答案
(2)已知氯乙烷与NaOH的乙醇溶液共热时,可生成乙烯和NaCl,写出该反应的化学方程式,指出上述结构中的断键部位。
答案 CH3CH2Cl+NaOHeq \(――→,\s\up7(乙醇),\s\d5(△))CH2==CH2↑+NaCl+H2O,断裂①、③极性键。
4.依据教材P18表1-2-2电负性表或元素在周期表中的位置,判断共价键①H—H键、②H—F键、③H—O键、④N—H键、⑤S—H键中,键的极性由弱到强的顺序是①⑤④③②。
1.大多数有机物分子的碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是( )
A.只有极性键 B.只有非极性键
C.有极性键和非极性键 D.只有离子键
答案 C
解析 碳原子最外层有4个电子,一般形成共价键,碳原子之间形成非极性键,与其他元素的原子之间是极性键。
2.(2020·南昌高二期中)目前已知化合物中数量、品种最多的是碳的化合物,下列关于其原因的叙述中不正确的是( )
A.碳原子之间、碳原子与其他原子(如氢原子)之间都可以形成4个共价键
B.碳原子性质活泼,可以与多种元素原子形成共价键
C.碳原子之间既可以形成稳定的单键,又可以形成双键和三键
D.多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合
答案 B
解析 碳原子最外层有4个电子,碳原子与碳原子、其他原子形成4个共价键达到稳定结构,故A正确;碳原子性质不活泼,不容易得失电子,易通过共用电子对形成共价键,故B错误;碳原子与碳原子之间不仅可以形成共价单键,还可以形成双键和三键,故C正确;多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合,故D正确。
3.下列说法中错误的是( )
A.所有的烷烃中都是既有极性键,又有非极性键
B.所有的烯烃中都是既有极性键,又有非极性键
C.因为碳元素的电负性为2.5,而氯元素的为3.0,所以在CCl4中碳元素呈现+4价
D.有机化学反应可能发生在极性键上
答案 A
解析 甲烷分子中不含非极性键,A错。
4.(2020·济南月考)下列化学式对应的结构式从成键情况看不合理的是( )
A.CH3N,
B.CH2SeO,
C.CH4S,
D.CH4Si,
答案 D
解析 D项中,C、Si都未形成稳定结构,正确结构。
5.试分析如图的分子结构:
(1)在同一条直线上最多有______个原子。
(2)能肯定在同一平面内且原子数最多的有________个原子。
(3)可能在同一平面内且原子数最多的有______个原子。
答案 (1)4 (2)12 (3)17
一、选择题:每小题只有一个选项符合题意。
1.下列说法中正确的是( )
A.烷烃中只存在碳碳单键和碳氢单键
B.烯烃中的碳碳双键是完全相同的两个键
C.烯烃和炔烃中所有的碳原子都是共面的
D.烯烃和炔烃都能与氯气发生加成反应生成氯代烃和氯化氢
答案 A
2.下列关于碳原子的成键特点及成键方式的理解中正确的是( )
A.饱和碳原子不能发生化学反应
B.碳原子只能与碳原子形成不饱和键
C.具有六个碳原子的苯与环己烷的结构不同
D.五个碳原子最多只能形成四个碳碳单键
答案 C
解析 饱和碳原子可以发生取代反应或裂化反应等,A错;碳原子也可以与氧原子或氮原子等形成不饱和键,B错;五个碳原子若构成环戊烷,可以形成5个碳碳单键,D错。
3.某共价化合物含C、H、N三种元素,分子内有四个氮原子,且四个氮原子排列成内空的四面体(如白磷的结构),每两个氮原子间都有一个碳原子。已知分子内无碳碳单键,也没有碳碳双键,则该化合物的分子式为( )
A.CH8N4 B.C6H12N4
C.C6H10N4 D.C4H8N4
答案 B
解析 由题意可知四个氮原子构成了四面体结构,碳原子在四面体的六条边上,而碳原子间不存在单键或双键,故碳余下的价键被氢占有,由此可推知其分子式为C6H12N4。
4.下列有关碳原子成键的说法正确的是( )
A.碳碳单键、碳碳双键、碳碳三键均能绕键轴旋转
B.烷烃分子中一个碳原子形成的四个键中每两个键的夹角均为109°28′
C.乙烯分子中碳碳双键与碳氢键的夹角大于120°
D.乙炔分子中碳碳三键与碳氢键的夹角为180°
答案 D
解析 碳碳双键、碳碳三键都不能绕键轴旋转,A项错误;甲烷分子中的四个碳氢键与其他烷烃分子中碳原子形成的四个键不完全相同,B项错误;乙烯分子中碳碳双键与碳氢键的夹角接近120°,C项错误。
5.从碳原子的成键情况来分析,下列结构式不合理的是( )
A.
B.
C.
D.
答案 A
解析 A项的结构式不符合碳原子最外层有4对共用电子的原则。
6.下列说法不正确的是( )
A.只有成键两原子为同种元素的原子,才有可能形成非极性键
B.极性键中吸引共用电子能力强的原子带部分正电荷
C.键的极性除受成键原子吸引共用电子能力的强弱影响,还受邻近原子团的影响
D.不同元素原子的核内质子数不同,核对外层电子吸引作用的强弱程度就不同
答案 B
7.下列叙述正确的是( )
A.CO2分子内存在着非极性键
B.C2H4分子中一定存在双键
C.含有双键的有机化合物分子中所有原子共平面
D.分子中键能越大,键越长,则分子越稳定
答案 B
8.(2020·郑州期中)键线式可以简明扼要的表示碳氢化合物,这种键线式表示的物质是( )
A.丁烷 B.异丁烷 C.异戊烷 D.新戊烷
答案 C
解析 键线式中端点和拐点是碳原子,每个碳原子形成四个共价键,该物质的结构简式为CH3—CH2—CH(CH3)2,为异戊烷。
二、选择题:每小题有一个或两个选项符合题意。
9.下列化学用语不正确的是( )
A.的分子式为C2H4O2
B.丙烷分子的空间填充模型
C.乙烯的结构简式:CH2CH2
D.CH4S的结构式
答案 BC
解析 乙烯的结构简式是CH2==CH2,碳碳双键不能省略。
10.下列关于CH3—C≡C—CH2—CH3的说法正确的是( )
A.分子中含有极性共价键和非极性共价键
B.分子中只有极性键
C.碳碳三键键能是碳碳单键键能的三倍
D.分子中只有非极性键
答案 A
解析 在题给分子中,碳碳单键和碳碳三键属于非极性键,碳氢单键属于极性键,A正确,B、D错误;碳碳三键键能要小于碳碳单键键能的三倍,C错误。
11.(2020·青岛高一期末)下列说法正确的是( )
A.丙烷是直链烃,所以分子中3个碳原子也在一条直线上
B.丙烯所有原子不在同一平面上
C.所有碳原子都在同一平面上
D.至少有16个原子共平面
答案 BD
解析 丙烷的3个碳原子是锯齿形相连的,故A错误;CH3—CH==CH2中甲基上至少有一个氢不和其他原子共平面,故B正确;苯环和乙烯均是平面形结构,碳碳单键可以旋转,所有碳原子有可能都在同一平面上,故C错误;该分子中在同一条直线上的原子有8个,再加上其中一个苯环上的8个原子,所以至少有16个原子共平面,故D正确。
12.下列分子中的所有碳原子均在同一条直线上的是( )
A.CH3CH2CH2CH3
B.CH3—CH==CH—CH3
C.
D.CH3—C≡C—C≡C—CH3
答案 D
解析 CH3CH2CH2CH3是锯齿形分子,所有的碳原子不可能在同一条直线上,A项错误;碳碳双键的键角是120°,所以一定不是共线分子,B项错误;与碳碳三键直接相连的原子与碳碳三键是共线关系,苯环是平面形结构,但苯环上的所有碳原子一定不与碳碳三键都共线,C项错误;该分子中含有2个碳碳三键,所以每个与碳碳三键直接相连的原子与碳碳三键是共线关系,所以该分子中所有C原子共线,D项正确。
三、非选择题
13.从生物体中提取一些对人们有用的物质是有机化学研究的重要内容,如图所示的物质就是某一科研小组从中草药田七中提取出来的,它具有消炎、祛火等作用。
请根据有关知识,填写下列空白:
(1)该物质一个分子中含有______个饱和碳原子,______个不饱和碳原子。
(2)分子中双键有______种,它们是____________________________________________。
(3)写出两种非极性键________,两种极性键________。
(4)写出该有机物的分子式:______________________________________________。
(5)推测该有机物可能具有的三条性质:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
答案 (1)4 11
(2)2 C==O键和C==C键
(3)C==C键、C—C键 C—H键、O—H键(或C==O键)
(4)C15H16O6(答案合理即可)
(5)①能使溴的四氯化碳溶液褪色 ②能发生酯化反应
③能发生水解反应
解析 (1)碳原子全部以单键形式结合时,即为饱和碳原子;碳原子以双键、三键或苯环等形式结合时,即为不饱和碳原子。(2)应注意苯环中的碳碳键不是典型意义上的碳碳双键,而是介于单键和双键之间的一种独特的键。(3)同种原子间形成的共价键为非极性键,不同种原子间形成的共价键为极性键。(5)含可使溴的四氯化碳溶液褪色;含有羧基(—COOH)和羟基(—OH)可发生酯化反应;含有酯基()可发生水解反应等。
14.甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,则得到的有机物分子的结构简式如图所示。
(1)该有机物的分子式为___________________________________________。
(2)该有机物分子中碳碳键之间的键角有______种。
(3)该有机物分子中所含的极性键有______个。
答案 (1)C25H20 (2)2 (3)20
解析 每个苯基有6个碳原子和5个氢原子,则该有机物分子中的碳原子数为6×4+1=25,氢原子数为5×4=20,该有机物的分子式为C25H20。苯环上碳碳键之间的键角为120°,中间的碳原子和苯环上的碳原子形成的键与和它相连的苯环上的碳碳键之间的键角也为120°,中间的碳原子与四个苯环上的碳原子形成的单键之间的键角为109°28′。该有机物分子中含有的极性键只有碳氢键,共20个。
15.有机物的表示方法多种多样,下面是常用的有机物的表示方法:
① ② ③CH4
④ ⑤
⑥
⑦
⑧
⑨
⑩
(1)上述表示方法中属于结构简式的为______________;
属于结构式的为________;
属于键线式的为__________;
属于空间填充模型的为______________;
属于球棍模型的为____________。
(2)写出⑨的分子式:____________。
(3)写出⑩中官能团的电子式:__________、__________。(4)②的分子式为____________,最简式为________。
答案 (1)①③④⑦ ⑩ ②⑥⑨ ⑤ ⑧
(2)C11H18O2 (3) (4)C6H12 CH2乙烯
乙炔
苯
有机物结
构简式
CH2==CH2
CH≡CH
球棍模型
共价键
—C≡C—
介于单键与双键之间的特殊化学键
碳原子的杂化方式
sp2杂化
sp杂化
sp2杂化
原子的成键特点及空间位置
每个碳原子与3个原子成键,形成1个碳碳双键,键角120°,分子中6个原子共平面
每个碳原子与2个原子成键,形成1个碳碳三键,键角180°,分子中4个原子共直线
每个碳原子与3个原子成键,键角120°,12个原子共平面
碳碳单键
碳碳双键
碳碳三键
碳原子饱和性
饱和
不饱和
不饱和
稳定性
稳定
一个键较另一个键易断裂
两个键较另一个键易断裂
溴的CCl4溶液
不反应
加成反应
加成反应
酸性KMnO4溶液
不反应
氧化反应
氧化反应
高中化学鲁科版 (2019)选择性必修3第2节 有机化合物的结构与性质第1课时复习练习题: 这是一份高中化学鲁科版 (2019)选择性必修3第2节 有机化合物的结构与性质第1课时复习练习题,共3页。试卷主要包含了下列说法中不正确的是,下列化学用语表述正确的是,[双选]下列说法中正确的是等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修3第1章 有机化合物的结构与性质 烃第2节 有机化合物的结构与性质一课一练: 这是一份高中化学鲁科版 (2019)选择性必修3第1章 有机化合物的结构与性质 烃第2节 有机化合物的结构与性质一课一练,共9页。
2020-2021学年第2节 有机化合物的结构与性质第1课时一课一练: 这是一份2020-2021学年第2节 有机化合物的结构与性质第1课时一课一练,共6页。试卷主要包含了下列表示乙醇的结构中不正确的是,在①丙烯 ②氯乙烯等内容,欢迎下载使用。













