




化学选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质备课课件ppt
展开1.认识如何借助电负性分析化学键中电荷的分布。2.体会借助电负性认识与预测有机化合物某些性质的思路和方法。3.了解甲醛的性质、对人体健康的危害以及去除方法。
一、解释甲醛的危害产生的原因
二、室内空气中甲醛的检测与去除
1.甲醛的危害当室内空气中甲醛含量超过0.1 mg·m-3时,人会有不适感,甚至会出现免疫功能异常;食用含有甲醛的食品也会损害人体健康。皮肤接触甲醛后可能出现急性皮炎,表现为粟粒大小红色丘疹,周围皮肤潮红或轻度红肿。
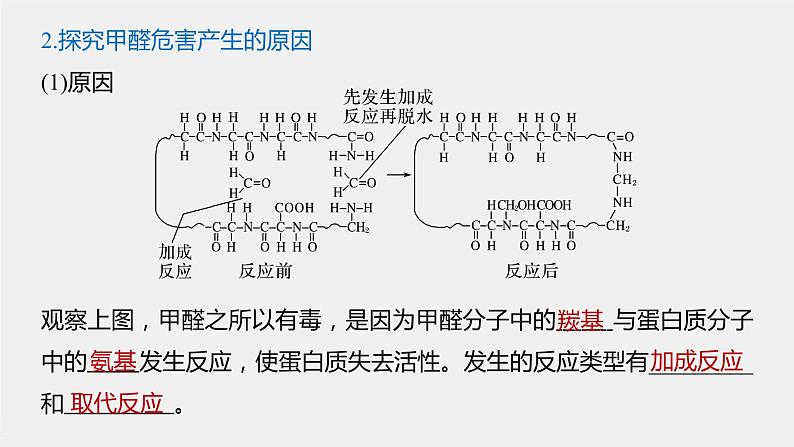
2.探究甲醛危害产生的原因(1)原因
观察上图,甲醛之所以有毒,是因为甲醛分子中的 与蛋白质分子中的 发生反应,使蛋白质失去活性。发生的反应类型有_________和 。
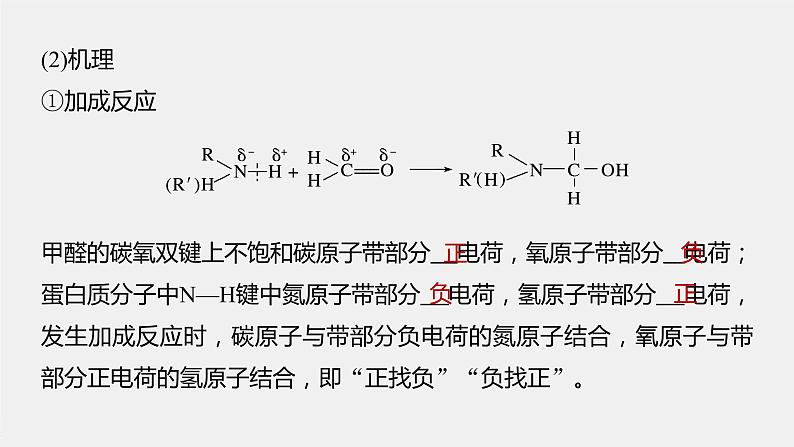
甲醛的碳氧双键上不饱和碳原子带部分 电荷,氧原子带部分 电荷;蛋白质分子中N—H键中氮原子带部分 电荷,氢原子带部分 电荷,发生加成反应时,碳原子与带部分负电荷的氮原子结合,氧原子与带部分正电荷的氢原子结合,即“正找负”“负找正”。
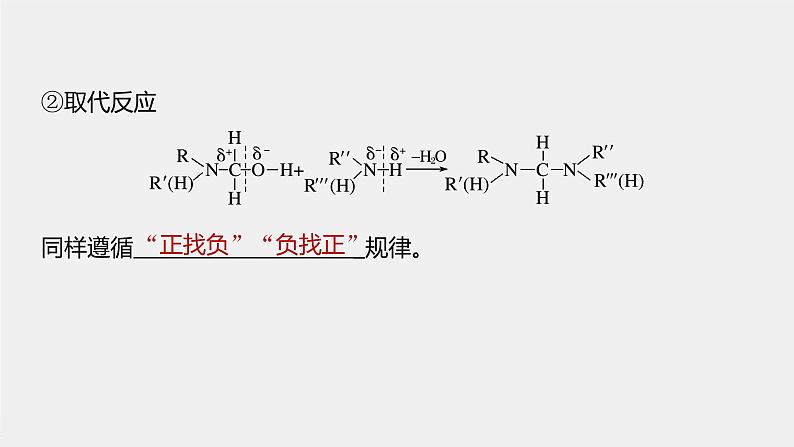
同样遵循 _规律。
(1)当A和B两元素形成共价键时,电负性大的元素原子带较多的负电荷,用δ-表示,电负性小的元素带有较多的正电荷,用δ+表示,如 。(2)可用元素的电负性来判断要断裂的两种元素原子所形成的共价键中电荷的分布,进而预测在生成产物时原子可能会如何重组。
1.甲醛的检测(1)检测试剂:MBTH,常被用来制成甲醛检测试剂盒。(2)检测原理:当空气含有甲醛时,会生成 化合物,颜色越深,说明空气中甲醛浓度越 。
2.甲醛的去除(1)化学方法思考:可用哪些化学试剂去除甲醛?
探究实验用品:甲醛检测试剂盒,甲醛溶液,乙醛溶液,氨水,酸性高锰酸钾溶液,试管,试管架,胶头滴管。探究方案:①取足量氨水于试管中,滴加几滴甲醛溶液,振荡,再用甲醛检测试剂盒检测振荡后的溶液中不含有甲醛。②取少量酸性高锰酸钾溶液于试管内,滴加甲醛溶液,直至高锰酸钾溶液褪色。结论: 。(2)物理方法室内空气流通、使用多孔材料物理吸附,如 等。
氨水、酸性高锰酸钾溶液都可以去除甲醛
去除甲醛的方法(1)氨、胺类、酚类物质等可以与甲醛先发生加成反应,再发生消去反应去除甲醛。(2)强氧化剂如酸性高锰酸钾、二氧化氯等与甲醛发生氧化还原反应去除甲醛。(3)室内空气的流通降低甲醛的含量。(4)使用多孔材料物理吸附。提醒 利用电负性可以判断化学键中电荷的分布以及预测生成物,不过,电负性是一个粗略的标度,在大多数分子中,电荷的分布可能是多种原子协同作用的结果,并与原子、分子所处的化学环境密切相关。
1.已知六种元素H、S、N、Al、Cl、Si的电负性分别为2.1、2.5、3.0、1.5、3.0、1.8。一般认为,如果两种成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果成键元素间的电负性差值小于1.7,通常形成共价键。某有机化合物A的结构简式为 ,下列有关说法正确的是A.A中S和N的共用电子对偏向SB.A中S和N的共用电子对偏向NC.AlCl3、AlN和Al2S3都是离子化合物D.在化合物SiH4中,Si的化合价是-4
解析 S元素的电负性比N元素的小,所以二者之间的共用电子对偏向N,A错误、B正确;H与Si相比,H的电负性大,故H应该显负价,Si显正价,D错误。
2.下面是某些短周期元素的电负性(用x表示):
(1)通过分析电负性变化规律,确定N、Mg的电负性取值范围:_____
解析 根据元素的电负性越强,原子吸引电子的能力越强,共用电子对就偏向于该元素,电负性:N>P,所以共用电子对就偏向于N。
3.元素的电负性(用γ表示)和元素的化合价一样,也是元素的一种性质。下表给出了14种元素的电负性:已知:两成键元素间电负性差值大于1.7时,一般形成离子键;两成键元素间电负性差值小于1.7时,一般形成共价键。(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是________________________________________________________________________________________。
从左到右,元素原子的电负性逐渐增大;同主族从上到下,元素原子的电负性逐渐减小
解析 由题给信息可知,同周期从左到右,元素原子的电负性逐渐增大;同主族从上到下,元素原子的电负性逐渐减小。
(2)估计钙元素的电负性的取值范围:_____<γ<_____。
解析 结合电负性变化规律和元素周期表知,电负性大小:K
解析 电负性数值小的元素在化合物中显正价,NaH、NH3、CH4、ICl中电负性数值小的元素分别是Na、H、H、I。
解析 “对角线规则”指在元素周期表中某些主族元素与其右下方的主族元素的性质相似,其原因是元素的电负性数值相近。
(4)表中符合“对角线规则”的元素有Be和____、B和____,它们的性质分别有一定的相似性,原因是_______________,写出表示Be(OH)2显两性的离子方程式:___________________________________________________________。
Be(OH)2+2H+===Be2++2H2O、Be(OH)2+2OH- ===
鲁科版 (2019)选择性必修2第1章 原子结构与元素性质微项目 甲醛的危害与去除——利用电负性分析与预测物质性质说课课件ppt: 这是一份鲁科版 (2019)选择性必修2第1章 原子结构与元素性质微项目 甲醛的危害与去除——利用电负性分析与预测物质性质说课课件ppt,共28页。
化学选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质课文ppt课件: 这是一份化学选择性必修2微项目 甲醛的危害与去除——利用电负性分析与预测物质性质课文ppt课件,共60页。PPT课件主要包含了课前自主学习,杂化原子轨道,杂化轨道的类型,苯的空间构型,肩并肩,大π键,成键电子对,孤电子对,相互排斥,价电子总数等内容,欢迎下载使用。
鲁科版 (2019)选择性必修2第1章 原子结构与元素性质微项目 甲醛的危害与去除——利用电负性分析与预测物质性质教课内容ppt课件: 这是一份鲁科版 (2019)选择性必修2第1章 原子结构与元素性质微项目 甲醛的危害与去除——利用电负性分析与预测物质性质教课内容ppt课件,共18页。













