




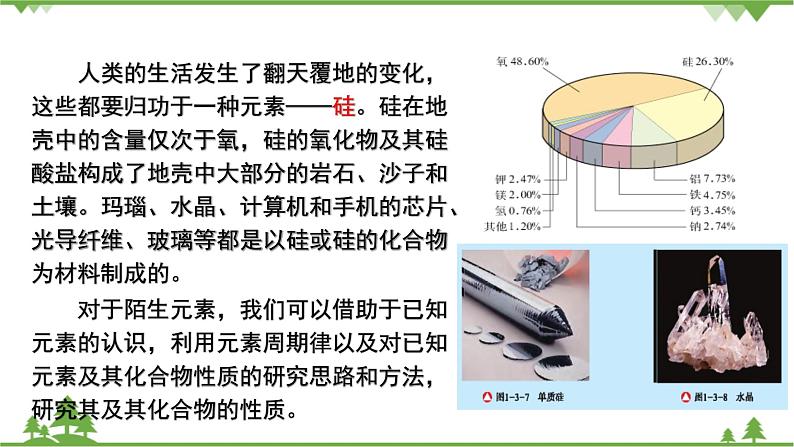










2021学年第3节 元素周期表的应用获奖ppt课件
展开第一章 原子结构 元素周期律
第三节 元素周期表的应用
第三课时 预测元素及其化合物的性质
1.能根据同周期、同主族元素性质的递变规律,预测陌生物质硅及其化合物的性质。
2.能结合有关资料说明元素周期表对合成新物质、寻找新材料等的指导作用。
硅及其化合物性质的预测
同周期元素性质的递变规律:
同主族元素性质的递变规律:
1.3.3 预测元素及其化合物的性质
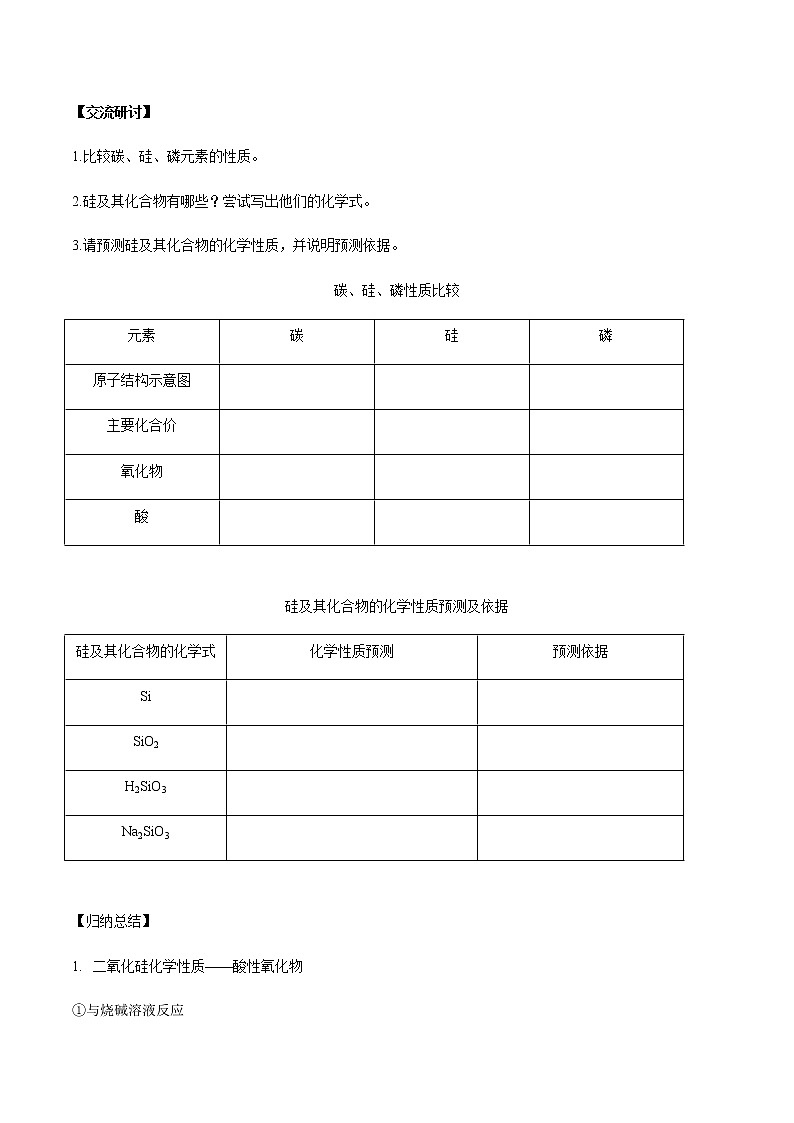
【交流研讨】
1.比较碳、硅、磷元素的性质。
2.硅及其化合物有哪些?尝试写出他们的化学式。
3.请预测硅及其化合物的化学性质,并说明预测依据。
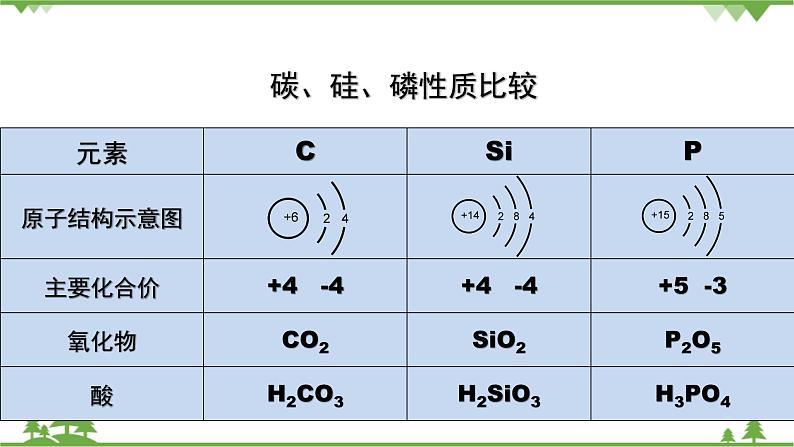
碳、硅、磷性质比较
元素 | 碳 | 硅 | 磷 |
原子结构示意图 |
|
|
|
主要化合价 |
|
|
|
氧化物 |
|
|
|
酸 |
|
|
|
硅及其化合物的化学性质预测及依据
硅及其化合物的化学式 | 化学性质预测 | 预测依据 |
Si |
|
|
SiO2 |
|
|
H2SiO3 |
|
|
Na2SiO3 |
|
|
【归纳总结】
- 二氧化硅化学性质——酸性氧化物
①与烧碱溶液反应
②与氧化钙反应
③弱氧化性
④特性:与氢氟酸反应
2.硅酸的制备:
3.元素周期表的利用
①寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等:
②寻找用于制农药的材料:
③寻找半导体材料:
【身边的化学】
工业制粗硅方法:
①制粗硅
②粗硅提纯
1.2016年命名第七周期ⅦA元素Ts(第117号元素的缩写)为钿(tián)。下列利用元素周期律的相关推测错误的是( )
A.Ts为金属元素
B.原子半径:Ts>Br>O
C.Ts的主要化合价-1、+7
D.酸性:HClO4>HTsO4
2.下列关于元素周期表的说法中正确的是( )
A.同一主族元素的原子序数的差不可能为10
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定为1
C.催化剂一般在金属元素与非金属元素的分界处寻找
D.过渡元素全部是金属元素
3.甲~庚等元素在周期表中的相对位置如下表。己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
[来源:Z#xx#k.Com]
A.丙与戊的原子序数相差18
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
4.科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期ⅣA族,称为类铅。关于它的性质,预测错误的是( )
A.它的最外层电子数为4
B.它的金属性比铅强
C.它具有+2、+4价
D.它的最高价氧化物的水化物是强酸
5.下列有关说法正确的是( )
A.CO2与水反应生成碳酸,是酸性氧化物;SiO2不能与水反应生成相应的硅酸,不是酸性氧化物
B.NaOH溶液不能用带磨口玻璃塞的玻璃瓶盛放
C.除去二氧化硅中少量的碳酸钙杂质应选用水
D.粗硅制备时,发生的反应为SiO2+C=Si+CO2↑
6.如图所示,元素周期表中的金属和非金属元素的分界线处用虚线表示。
下列说法正确的是( )
A.虚线左下方的元素均为非金属元素
B.紧靠虚线两侧的元素都是具有金属性和非金属性的金属元素
C.可在虚线附近寻找半导体材料(如Ge、Si等)
D.可在虚线的右上方,寻找耐高温材料
7.关于二氧化硅,下列叙述不正确的是( )
A.水晶的主要成分是二氧化硅
B.二氧化硅和二氧化碳在物理性质上有很大差别
C.二氧化硅不溶于水,也不能跟水起反应生成酸
D.二氧化硅是一种酸性氧化物,它不跟任何酸起反应
【知识点填空答案】
碳、硅、磷性质比较
元素 | 碳 | 硅 | 磷 |
原子结构示意图 |
|
|
|
主要化合价 | +4 -4 | +4 -4 | +5 -3 |
氧化物 | CO2 | SiO2 | P2O5 |
酸 | H2CO3 | H2SiO3 | H3PO4 |
硅及其化合物的化学性质预测及依据
硅及其化合物的化学式 | 化学性质预测 | 预测依据 |
Si | 化学性质不活泼,但是在一定条件下能与氧气等发生化学反应,由于其性质的特殊性,可能还具有独特的性质 | 与碳同主族,与碳单质具有相似的化学性质 |
SiO2 | 具有酸性氧化物的通性,能与碱、碱性氧化物等发生反应,可能也具有一定的特性 | 与碳同主族,与二氧化碳具有相似的化学性质 |
H2SiO3 | 具有酸的性质,能与碱反应,但酸性较弱,酸性弱于碳酸、磷酸 | 与碳同主族,与磷同周期,非金属性弱于碳和磷 |
Na2SiO3 | 白色固体,易溶于水,与比硅酸酸性强的一些酸反应,生成难溶于水的硅酸 | 属于弱酸的正盐,可与强酸反应生成硅酸 |
【归纳总结】
1.二氧化硅化学性质——酸性氧化物
①与烧碱溶液反应
SiO2+2NaOH == Na2SiO3+H2O
②与氧化钙反应
SiO2+CaO ==高温== CaSiO3
③弱氧化性
SiO2+2C ==高温== Si+2CO↑
④特性:与氢氟酸反应
SiO2+ 4HF == SiF4↑+ 2H2O
2.硅酸的制备:
Na2SiO3+CO2+H2O==Na2CO3+H2SiO3↓
2HCl + Na2SiO3 == H2SiO3↓+ 2NaCl
2H2SO4+ Na2SiO3 == H2SiO3↓+ Na2SO4
3.①寻找优良催化剂,寻找耐高温耐酸碱腐蚀的特种合金,用来制造火箭、导弹、宇宙飞船等:过渡元素
②寻找用于制农药的材料:非金属F、Cl、S、P等
③寻找半导体材料:在金属和非金属分界线处
【身边的化学】
工业制粗硅方法:
①制粗硅
SiO2 +2C ==高温== Si(粗硅) + 2CO↑
②粗硅提纯
Si(粗硅)+2Cl2 ==高温== SiCl4
SiCl4+2H2 ==高温== Si(高纯硅)+4HCl
【检测反馈答案】
1.【答案】 C
【解析】 根据该元素汉字名称为“钿”,可知第七周期ⅦA元素Ts为金属,A正确;根据三种原子的电子层数可知原子半径:Ts>Br>O,B正确;Ts为金属元素,没有负价,C错误;元素非金属性越强,其最高价氧化物的水化物的酸性越强,故酸性:HClO4>HTsO4,D正确。
2.【答案】D
【解析】第ⅠA族的H元素和Na元素的原子序数相差10,A项错误;从第四周期开始,同周期第ⅡA族与第ⅢA族元素的原子序数差值不为1,B项错误;催化剂应在过渡元素区域寻找,C项错误。
3.【答案】 D
【解析】根据题中信息可确定己和甲分别为S和Mg,则乙、丙、丁、戊、庚分别为Ca、B、Si、As和F。B和As原子序数分别为5和33,二者相差28,A项错误;根据非金属性可确定稳定性:HF>H2S>AsH3,B项错误;常温下Mg和水反应非常缓慢,C项错误;SiO2可用于制造光导纤维,D项正确。
4.【答案】D
【解析】原子序数为114的元素在第7周期ⅣA族。ⅣA族元素的最外层电子数为4,A项正确;同主族元素由上到下元素的金属性逐渐增强,故类铅的金属性比铅强,B项正确;类铅元素在第7周期ⅣA族,具有+2、+4价,C项正确;同主族元素由上到下元素的金属性逐渐增强,最高价氧化物对应水化物的酸性减弱,碳酸为弱酸,故类铅的最高价氧化物对应水化物不可能是强酸,D项错误。
5.【答案】B
【解析】酸性氧化物是能与碱反应生成盐和水的氧化物,虽然SiO2不能与水反应生成相应的硅酸,但SiO2能与NaOH溶液反应生成硅酸钠和水,是酸性氧化物,A项错误;玻璃的成分中含大量二氧化硅,碱性试剂都不能用带磨口玻璃塞的玻璃瓶盛放,B项正确;二氧化硅和碳酸钙都不溶于水,不能用水除去二氧化硅中少量的碳酸钙杂质,C项错误;粗硅制备时的反应原理是SiO2+2C ==高温== Si+2CO↑,产物中生成的是CO,不是CO2,且反应需要在高温下进行,D项错误。
6.【答案】C
【解析】A项,虚线左下方的元素均为金属元素,错误;B项,紧靠虚线两侧的元素不一定都是金属元素,如硅是非金属元素,错误;C项,元素周期表中的金属元素和非金属元素分界线附近的元素往往都既具有金属性,也具有非金属性,可在虚线附近寻找半导体材料(如Ge、Si等),正确;D项,在过渡元素中可寻找耐高温材料,在非金属元素中寻找制农药的元素,错误。
7.【答案】D
【解析】水晶的主要成分为SiO2,A正确;CO2是由分子构成的,而SiO2是Si和O按1∶2组成的空间立体网状结构的晶体,二者物理性质差别很大,B正确;SiO2不溶于水也不与水反应,C正确;SiO2是酸性氧化物,但SiO2能和氢氟酸反应,D不正确。
化学必修 第二册第3节 元素周期表的应用图片课件ppt: 这是一份化学必修 第二册第3节 元素周期表的应用图片课件ppt,共31页。PPT课件主要包含了半导体材料,光导纤维,玻璃等,思考交流,原子半径依次减小,原子半径依次增大,失电子能力依次增强,非金属性依次增强,得电子能力依次增强,金属性依次增强等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用教课ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用教课ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用公开课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用公开课课件ppt,文件包含新教材精创132研究同主族元素的性质课件2-鲁科版高中化学必修第二册共22张PPTpptx、新教材精创132研究同主族元素的性质学案2-鲁科版高中化学必修第二册docx、新教材精创132研究同主族元素的性质教学设计2-鲁科版高中化学必修第二册docx、新教材精创132研究同主族元素的性质练习2原卷版docx、新教材精创132研究同主族元素的性质练习2解析版docx等5份课件配套教学资源,其中PPT共21页, 欢迎下载使用。













