
















鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第1节 化学键与物质构成精品ppt课件
展开第二章 化学键 化学反应规律
第1节 化学键与物质构成
在前边原子结构和元素周期律知识的基础上,引导学生进一步探索原子是如何结合成为分子的。通过对化学键概念的建立,将学生的宏观辨识与微观探析素养从基于分子原子和离子得孤立微粒观进阶到基于微粒及其微粒间相互作用的水平层次。同时化学键的概念提供了一个将微粒与能量相结合的重要认识角度——微粒之间存在着相互作用,而且是很强的相互作用,不同的微粒之间存在不同的强相互作用。在学生形成这种认识后,使学生进一步认识到新物质生成的本质是旧键的断裂、新键生成,化学键断裂需要吸收能量,形成化学键可以释放能量。进一步加深学生对物质构成的认识,进而深入认识化学反应的物质变化本质和能量变化本质,为后续进一步认识物质的结构与性质的关系等打下基础。
宏观辨识与微观探析:
认识构成物质的微粒之间存在相互作用,结合典型实例认识离子键和共价键的形成,建立化学键概念。能判断简单离子化合物,和共价化合物中化学键类型。
知道分子存在一定的空间结构能用电子式、结构式、分子结构模型描述微粒结构。
变化观念与平衡思想:
认识化学键的断裂和形成是化学反应中物质变化的实质,能从化学键视角认识物质的多样性,会分析物质变化中的化学变化。
化学键概念,离子键、共价键的成因和本质。
用电子式描述离子键和共价键的形成过程。
准备常见分子CO2、H2O、NH3、CH4的分子模型,氯化钠、氯化氢形成过程动画
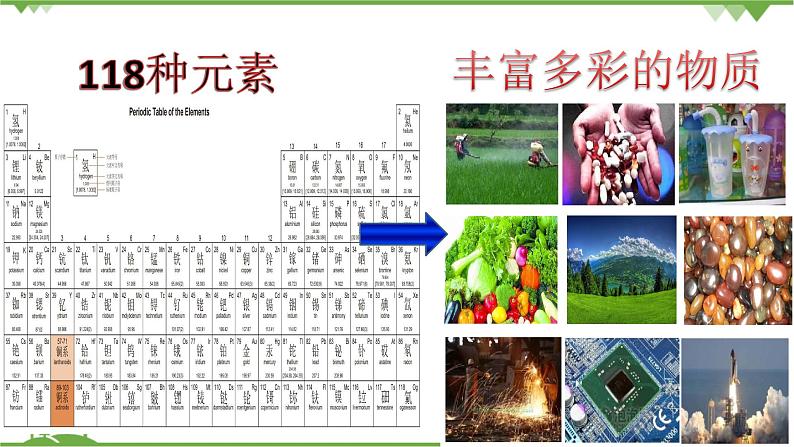
【引入】前边通过元素周期律、周期表的学习,我们知道目前已知的元素种类只有一百多种,可这些元素却构成了已发现或合成的一千多万种物质。
【观察思考】展示常见分子的模型
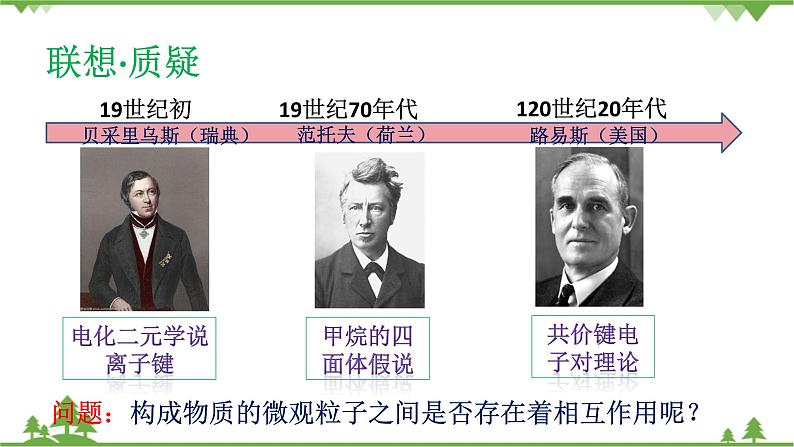
为什么一百多种元素可形成千千万万种物质?元素的原子间通过什么作用形成如此丰富多彩的物质呢?物质中原子为什么总是按照一定数目相结合?人类对构成物质的微粒之间的结合方式也再不断的进行探索。请大家阅读教材“联想质疑”栏目,了解科学家们对微粒之间结合方式的认识。
【联想质疑】学生完成教材联想质疑栏目,提出自己观点和认识。
【过度】通过科学家的观点,可以看出形成物质的微粒之间是通过一定的方式进行结合的,那么这些微粒之间是否存在相互作用呢?请大家完成教材“交流·研讨”栏目。
【交流·研讨】
1.加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供的能量的作用是什么?
2.加热至2200℃以上时,水会分解。在这一过程中,外界提供的能量的作用是什么?
3.为什么使水分解需要加热到2200℃以上,而使水沸腾只需要加热到100℃?
【引导】通过这些问题的思考,你对“微粒之间是否存在着相互作用”这一问题有了什么认识?请大家小组交流自己的认识,并形成自己的观点。
【交流展示】选各小组展示自己小组交流研讨的结果和观点。
【归纳点评】
1.水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
2.水分子内氢原子和氧原子之间也存在相互作用,加热提供能量用来破坏这种作用力使水分解。
3.水分子内氢原子和氧原子之间的作用力,远远大于水分子之间的作用力。这种作用力称为化学键。
【总结】
一.化学键
定义:相邻原子之间的强相互作用称为化学键
强调:(1)首先必须相邻。不相邻一般就不强烈
(2)只相邻但不强烈,也不叫化学键
(3)水分子之间的作用力不是化学键,称为分子间作用力,比化学键弱。
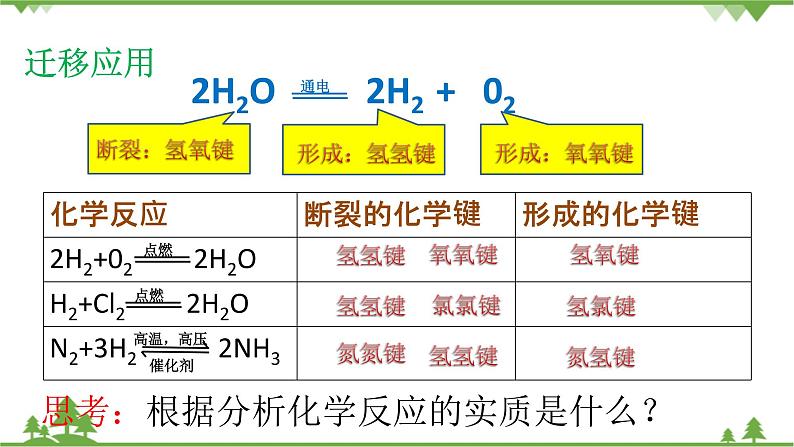
【质疑】不同物质中存在的化学键是不同的,因此物质在发生化学反应时,必然会存在化学键的变化,那么在化学反应中,化学键会如何变化呢?请大家结合教材“迁移应用”的示例,小组合作完成相关表格。
【迁移应用】学生组内合作完成教材“迁移应用”栏目
【思考】通过讨论你对化学反应过程中化学键的变化有何认识?
学生:化学变化过程中伴随着化学键的断裂和形成。
【归纳总结】
化学反应的实质——旧化学键的断裂和新化学键的形成。
旧化学键的断裂需要吸收能量,新化学键的形成会释放能量。
【引入】元素有一百多种,这些元素从大的角度分两类:金属元素、非金属元素。金属元素一般容易失电子,非金属元素一般容易得电子。我们发现非金属和非金属元素之间可以形成共价键如H2O分子中的H-0,非金属元素和金属元素之间也可以形成化学键如NaCl。那么这些不同元素之间形成化学键是否相同呢?请同学们完成教材“交流研讨”栏目
【交流研讨】金属钠在氯气中燃烧能够生成氯化钠,氢气在氯气中燃烧能够生成氯化氢。那么,氯气原子与钠原子是如何形成氯化钠的,氯原子与氢原子又是如何形成氯化氢的?二者的形成过程有什么不同,又为什么会有不同?
【方法引导】请大家从三种元素的原子结构上进行分析。
【动画演示】多媒体投影氯化钠和氯化氢的形成过程。并结合动画进行总结。
【总结】在氯化钠的形成过程中,由于钠是金属元素很容易失电子,氯是非金属元素很容易得电子,当钠原子和氯原子靠近时,钠原子就失去最外层的一个电子形成钠阳离子,氯原子最外层得到钠的一个电子形成氯阴离子(两者最外层均达到稳定结构),阴、阳离子靠静电作用形成化学键——离子键,构成氯化钠。由于钠和氯原子之间是完全的得失电子,他们已形成了离子,因此NaCl中的微粒不能再叫原子,而应该叫离子。
在氯化氢的形成过程中,由于氢和氯都是非金属元素,都有得电子的趋势,最终谁也不能把对方的电子完全得到,而是氯原子和氢原子各提供一个电子组成共用电子对,从而使两者的最外层都达到稳定结构并产生强烈的相互作用——形成化学键。这样的化学键叫共价键。由于氯和氢都没有完全得失电子,因此,都不形成离子,HCl中的氢和氯不能叫氢离子氯离子,只能叫氢原子氯原子。
【自主学习】根据刚才的分析请大家自主阅读教材P42-43页内容,了解离子键、共价键的概念和形成条件。
【总结】
离子键:阴阳离子之间通过静电作用形成的化学键。
形成条件:活泼金属元素原子与活泼非金属元素原子之间
共价键:原子间通过共用电子形成的化学键。
形成条件:非金属元素原子之间
【强调】
(1)共价键的成键微粒是原子,而离子键的成键微粒是阴阳离子
(2)一般情况下活泼金属元素原子与活泼非金属元素原子之间容易形成离子键(特例AlCl3共价键)。非金属原子之间形成的化学键是共价键。
(3)共价键和离子键的实质相同,都属于电性作用。成键原因都是原子都有使自己的最外层达到稳定结构状态的趋势。(稀有气体原子的最外层都已达到稳定结构,因此稀有气体分子都是单原子分子,分子内不形成化学键)
(4)有共价键形成的分子具有一定的空间构型。(投影常见分子的空间构型)
【引入】离子键和共价键的形成过程可以用电子式来进行表示。
【投影】电子式:一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
原子的电子式:
简单阳离子的电子式: Na+、Mg2+、Al3+
简单阴离子的电子式:
离子化合物的电子式:
共价化合物的电子式:
【迁移应用】用电子式写出H2O、CaCl2的形成过程。
【引入】根据物质的构成可以将化合物分为离子化合物和共价化合物,由阳离子和阴离子构成的化合物称为离子化合物,由原子通过共价键构成的化合物称为共价化合物。
【投影】离子化合物:由阳离子和阴离子构成的化合物
共价化合物: 由原子通过共价键构成的化合物
【质疑】离子化合物和共价化合物中所含的化学键有什么特点呢?请大家根据教材“迁移应用”进行分析总结。
【迁移应用】学生完成教材迁移应用表格,并展示结果。
【投影】“迁移应用”表格答案并进行总结
【总结】离子化合物一定含有离子键,可能含有共价键;共价化合物一定含有共价键,一定不含离子键。
【拓展视野】通过本节课的学习,我们认识到元素原子在形成形形色色的物质时,是通过化学键的作用结合到一起的,那么,化学键对物质的性质有什么影响呢?同种元素形成的共价键和不同种元素形成的共价键有什么区别呢?有兴趣的同学可以自学教材后的“拓展视野”栏目。
【课堂小结】
本节课主要是通过观察思考引发学生对物质内部结构的探究,通过交流研讨使学生认识到化学键的存在,并从物质的微观结构入手去分析和感悟离子键和共价键的形成过程,构建化学键的相关概念,运用化学键对物质和化学反应进行再认识。
鲁科版 (2019)必修 第二册第2章 化学键 化学反应规律第1节 化学键与物质构成教学演示课件ppt: 这是一份鲁科版 (2019)必修 第二册<a href="/hx/tb_c4002560_t3/?tag_id=26" target="_blank">第2章 化学键 化学反应规律第1节 化学键与物质构成教学演示课件ppt</a>,共36页。PPT课件主要包含了联想·质疑,化学键,交流·研讨,迁移·应用,离子键和共价键,概括整合,练习与活动等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1节 化学键与物质构成精品ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第1节 化学键与物质构成精品ppt课件,共45页。PPT课件主要包含了吸收能量,释放能量,阳离子,共用电子,·Na,阳离子与阴离子,共价键等内容,欢迎下载使用。
鲁科版 (2019)必修 第二册第1节 化学键与物质构成评课ppt课件: 这是一份鲁科版 (2019)必修 第二册第1节 化学键与物质构成评课ppt课件,共59页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。














