






化学必修 第二册第3节 元素周期表的应用课文内容课件ppt
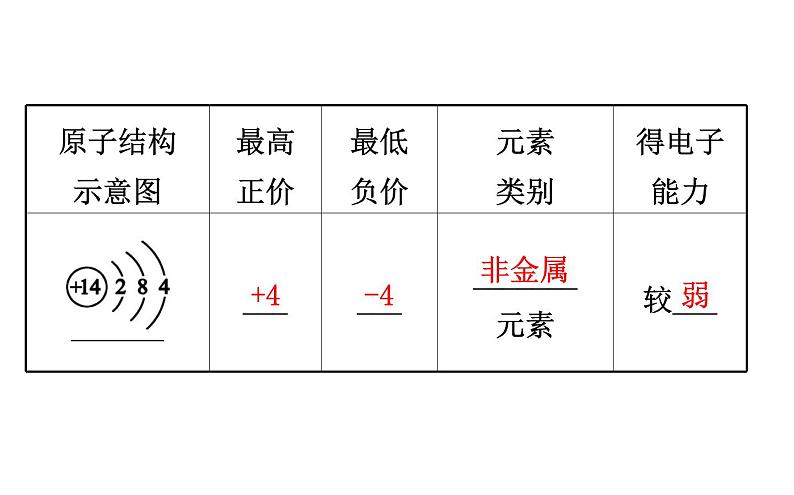
展开一、根据同周期、同主族元素性质的递变规律预测硅的性质1.性质的预测(1)硅元素的原子结构及性质分析。
2.化学性质验证(1)单质硅的化学性质①常温下,硅的化学性质不活泼,只与F2、HF、强碱(如NaOH)溶液反应。Si+__F2====____,Si+__HF====____________, Si+2NaOH+H2O====_____________。
Na2SiO3+2H2↑
②加热条件下和某些非金属单质(如O2、Cl2)发生反应。Si+O2 ____。
【巧判断】(1)因为硅的化学性质不活泼,所以在自然界中有游离态的硅存在。( )提示:×。硅的化学性质虽然不活泼,但是在自然界中硅元素全部以化合态的形式存在。
(2)硅单质不与任何酸发生化学反应。( )提示:×。硅可以与氢氟酸发生化学反应。
(2)SiO2的化学性质①具有酸性氧化物的通性:a.常温下SiO2与强碱溶液反应生成盐和水:SiO2+2NaOH====___________;
Na2SiO3+H2O
b.高温下SiO2与碱性氧化物反应生成盐:SiO2+CaO ______。②弱氧化性:SiO2+2C _____________。③特性:与氢氟酸(HF)反应:SiO2+__HF====___________。此反应常被用来刻蚀_____。
【巧判断】(1)SiO2是酸性氧化物,所以SiO2能与H2O反应生成硅酸。( )提示:×。SiO2虽然是酸性氧化物,但是不与H2O反应生成硅酸。
(2)因为SiO2能导电,所以SiO2能用于制造光导纤维。( )提示:×。SiO2不能导电。
(3)H2SiO3的化学性质。H2SiO3是一种弱酸,具有酸的性质,但是酸性比碳酸的弱。验证:Na2SiO3+_______====________+Na2CO3。
【微思考】非金属性硅比碳弱,你还能用什么方式进行证明?提示:可以用气态氢化物的稳定性进行验证,其中硅烷的稳定性不如甲烷的稳定性强。
【情境·思考】“玛瑙”早期被书写成“马脑”。因“色如马脑,故从彼名”。自佛经传入中国后,翻译人员考虑到“马脑”属玉石类,于是巧妙地译成“玛瑙”。
玛瑙的主要成分为二氧化硅,由于其与水化二氧化硅(硅酸)交替而常重复成层。因其夹杂氧化金属,颜色可从极淡色到暗色。想一想如何由二氧化硅制取硅酸。提示:二氧化硅不与水反应,故应先与碱(如NaOH溶液)反应生成硅酸盐,再与酸(如盐酸)反应生成硅酸。
二、元素周期表的应用1.科学预测根据元素在周期表中的位置,推测元素的原子结构,预测其主要性质,为研究物质结构、发现新元素、合成新物质等提供许多有价值的指导。
2.在生产生活中的应用利用元素周期表寻找新材料。将下面左右两侧对应内容连线:
【情境思考】人工合成氨是科学史上的里程碑之一。一百多年来,工业合成氨需要高温高压的苛刻条件,而自然界的生物固氮是在常温常压下进行的。因此高效的人工模拟生物固氮成为催化科学领域的圣杯。
若要研制新型的高效催化剂,应该在元素周期表的什么位置寻找合适的元素?提示:在元素周期表中的过渡元素部分寻找合适的催化剂。
知识点一 硅及其化合物的特性【重点释疑】1.硅的特性(1)一般情况下,非金属单质熔、沸点低,硬度小,但晶体硅熔、沸点高,硬度大;非金属单质一般不导电,但Si为半导体,有一定的导电能力。
(2)非金属单质一般不跟非氧化性酸反应,但Si却能与HF反应:Si+4HF====SiF4↑+2H2↑。(3)Si的还原性大于C,但C却能在高温下还原出Si:SiO2+2C Si+2CO↑。
(4)非金属单质跟碱液的作用一般非金属单质既作氧化剂又作还原剂,且无H2放出,但Si与碱液(如NaOH溶液)反应只作还原剂,且放出H2:Si+2NaOH+H2O====Na2SiO3 +2H2↑。
2.硅的化合物的特性(1)SiO2是H2SiO3的酸酐,但它不溶于水,不能直接用它与水反应来制取H2SiO3。(2)非金属氧化物的熔、沸点一般较低,但SiO2的却很高。(3)酸性氧化物一般不与酸作用,但SiO2能跟HF作用: SiO2+4HF====SiF4↑+2H2O。
(4)H2CO3的酸性大于H2SiO3,所以有Na2SiO3+CO2+H2O ====H2SiO3↓+Na2CO3,但在高温下Na2CO3+SiO2 Na2SiO3+CO2↑也能发生,原因是CO2是低沸点、易挥发的气体,SiO2是高沸点、难挥发的固体。(5)无机酸一般易溶于水,但H2SiO3却难溶于水。且易分解:H2SiO3 SiO2+H2O。
【易错提醒】SiO2和CO2的物理性质差别很大,是由于二者结构上的差别造成的。SiO2是立体网状结构的晶体,不存在SiO2分子,而CO2是由碳、氧原子结合成的分子,微粒间的作用力远小于SiO2。
这样的结构差异也决定了CO2和SiO2的化学性质有很大的不同。虽然两者都是酸性氧化物,但由于结构的稳定性,SiO2不能像CO2那样在水溶液中和气体状态时与许多物质发生反应。
【思考·讨论】(1)将少量CO2通入Na2SiO3溶液会生成白色沉淀,写出相关的化学方程式,并比较碳酸和硅酸的强弱。
提示:反应方程式为H2O+CO2+Na2SiO3====Na2CO3+ H2SiO3↓,说明硅酸的酸性比碳酸的还弱。
(2)根据反应SiO2+Na2CO3 CO2↑+Na2SiO3,能判断硅酸的酸性比碳酸强吗?为什么?
提示:不能。“强酸制弱酸”一般用于水溶液中的反应。该反应由SiO2生成CO2是在高温下进行的,不是在水溶液环境中进行的。反应能发生是因为产物CO2是气态能脱离反应体系,使反应正向进行。
【案例示范】【典例】(2019·银川高一检测)下列有关说法中正确的是( )A.硅是非金属元素,与任何酸都不发生反应B.SiO2溶于水生成硅酸,其水溶液显酸性C.硅的性质很稳定,但在自然界中不存在游离态D.二氧化硅是酸性氧化物,可以与碱反应,但是不能与酸反应
【解题指南】解答本题注意以下两点:(1)硅与二氧化硅性质都比较稳定,除氢氟酸之外,一般不与酸反应;(2)酸性氧化物是指能与碱反应只生成盐和水的氧化物,不一定与水反应。
【解析】选C。硅在常温下可以与氢氟酸反应,A项错误;SiO2不溶于水,也不能与水反应,所以B错误;自然界中没有游离态的硅,化合态的硅几乎全部是二氧化硅和硅酸盐, C项正确;SiO2是酸性氧化物,但是可以与氢氟酸反应,D错误。
【母题追问】上题C中,如何制备单质硅?制得的硅中可能含有哪些杂质?如何提纯?
提示:工业上一般用焦炭还原二氧化硅制得粗硅,粗硅中可能含有碳单质以及二氧化硅,接着让硅与氯气反应,生成四氯化硅液体,过滤,除去其中的固体杂质,然后用氢气还原所得到的四氯化硅,便得到纯净的硅。
【迁移·应用】1.2019年,华为推出了麒麟985芯片,用于新一代5G智能手机。芯片是通过专门的工艺可以在硅晶片上刻蚀出数以百万计的晶体管,被广泛应用于集成电路的制造。对硅芯片技术的掌握已经成为国家经济与技术发展的重要力量。下列说法正确的是( )
A.硅的化学性质很稳定,常温下不能与其他物质发生反应B.硅在自然界中的含量很大,自然界中存在大量的单质硅C.高纯度的硅被用于制作计算机芯片D.高纯度的硅常被用来制造光导纤维
【解析】选C。硅的化学性质很稳定,但在常温下能与强碱溶液、HF、F2等反应,A不正确;自然界中硅以化合态形式存在,没有单质硅,B不正确;SiO2用于制造光导纤维,而不是Si,D不正确。
2.(2019·淮北高一检测)2018世界光纤光缆大会于11月5~7日在杭州召开。光缆的主要成分为SiO2。碳和硅均为第ⅣA族的元素,二者性质既有一定的相似性又有一定的递变性。下列关于SiO2和CO2的说法中,正确的是( )
A.CO2与SiO2都能跟H2O反应生成相应的酸B.SiO2与CO2都不能与酸反应C.SiO2与CO2(干冰)都能够与氢氧化钠溶液反应D.水晶的主要成分是SiC
【解析】选C。A项,CO2与水反应,SiO2不与水反应,也不溶于水;B项,SiO2为酸性氧化物,能与HF反应,但CO2不与酸反应;C项,SiO2、CO2均能与NaOH溶液反应:SiO2+ 2NaOH====Na2SiO3+H2O,CO2+2NaOH====Na2CO3+H2O;D项,水晶是纯净的SiO2,SiC俗称金刚砂。
【补偿训练】(2019·泉州高一检测) 现有下列五个转化,其中不可能通过一步反应实现的是( )①SiO2→Na2SiO3 ②CuSO4→CuCl2③SiO2→H2SiO3 ④CuO→Cu(OH)2⑤Na2O2→NaOHA.①② B.③④ C.②③④ D.②③④⑤
【解析】选B。SiO2 Na2SiO3,CuSO4 CuCl2,Na2O2 NaOH。
【素养提升】在食品或者鞋子等包装盒中往往会加入变色硅胶的包装袋,以防商品受潮。变色硅胶吸水前后的颜色变化如图所示:
硅胶和石英的主要成分都是SiO2,前者是结构疏松的SiO2,后者是结构致密的SiO2。二者成分相同,结构不同,化学性质相同,物理性质上表现出差别,具有不同的用途。由石英制取硅胶,经历以下三步,试写出每步反应的化学方程式。
(1)用NaOH(aq)溶解石英,则溶解过程中石英发生了哪些反应?提示:石英主要成分是酸性氧化物SiO2,与碱反应生成盐和水: 2NaOH+SiO2====Na2SiO3+H2O
(2)过滤,向滤液中加入盐酸,至沉淀不再产生,此过程中发生了哪些反应?提示:过滤,除去石英中的杂质,得滤液为Na2SiO3(aq),硅酸是弱酸,Na2SiO3与盐酸发生复分解反应: Na2SiO3+2HCl====2NaCl+H2SiO3↓。
(3)微热,浓缩硅酸溶液,加热蒸干溶液,并使固体完全分解,加热蒸干后固体物质的成分是什么?中间发生了什么变化?提示:微热,H2SiO3(aq)浓缩,H2SiO3聚合为胶体,加热硅酸溶胶脱水,生成多孔硅胶: H2SiO3 H2O↑+SiO2。
知识点二 “预测元素性质”的基本方法【重点释疑】 1.由原子序数确定元素位置的规律只要记住了稀有气体元素的原子序数(He—2、Ne—10、Ar—18、Kr—36、Xe—54、Rn—86),就可由主族元素的原子序数推出主族元素的位置。
(1)若比相应的稀有气体元素多1或2,则应处在下周期的第ⅠA族或第ⅡA族,如88号元素:88-86=2,则应在第七周期第ⅡA族;(2)若比相应的稀有气体元素少1~5时,则应处在同周期的第ⅦA族~第ⅢA族,如84号元素应在第六周期第ⅥA族;
(3)若预测新元素,可与未发现的稀有气体元素(118号)比较,按上述方法推测知:114号元素应为第七周期第ⅣA族。
2.性质与位置互推问题是解题的关键熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:(1)元素的金属性、非金属性。(2)气态氢化物的稳定性。(3)最高价氧化物对应水化物的酸碱性。(4)金属与H2O或酸反应的难易程度。
3.结构和性质的互推问题是解题的要素(1)最外层电子数是决定元素原子的氧化性和还原性的主要原因。(2)原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质。(3)同主族元素最外层电子数相同,性质相似。
【思考·讨论】(1)已知,S和Se同主族,试比较H2SO4和H2SeO4哪者酸性更强?提示:因为S、Se同主族,自上至下,元素的非金属性减弱,最高价氧化物对应的水化物酸性减弱,故酸性:H2SO4>H2SeO4。
(2)根据元素周期律可以推知Ba(OH)2和Ca(OH)2哪者碱性更强?提示:在元素周期表中,Ba和Ca位于同一主族,且Ba位于Ca的下方,故碱性:Ca(OH)2
下列叙述正确的是( )A.锗是一种金属性很强的元素B.锗的单质具有半导体的性能C.锗化氢(GeH4)稳定性很强D.锗酸(H4GeO4)是难溶于水的强酸
【思维建模】推测元素性质的流程如下:
【解析】选B。锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,常用于作半导体材料;锗化氢(GeH4)稳定性很弱;锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以锗酸酸性比硅酸弱,为弱酸,碳酸溶于水,硅酸不溶于水,推知锗酸(H4GeO4)应难溶于水,故D错误。
【方法规律】推断陌生元素性质的“3”个分析角度(1)与同周期前、后元素相比较,根据同周期元素性质的递变规律推测元素的性质。(2)与同主族上、下元素相比较,依据同主族元素性质的递变规律推测元素的性质。
(3)比较不同周期、不同主族元素的性质时,可借助“三角”规律推断若A、B、C三种元素位于元素周期表中如图所示位置,有关元素的各种性质均可排出顺序(但D不能参与排序)。
①原子半径:C>A>B;②金属性:C>A>B;③非金属性:B>A>C。
【迁移·应用】1.根据下列元素在元素周期表中的位置预测物质的性质,对下列物质的认识错误的是( )A.铍(Be)的原子失电子能力比镁弱B.砹(At)的氢化物不稳定C.硒(Se)化氢比硫化氢稳定D.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
【解析】选C。硒(Se)和硫是同主族元素,硫非金属性强,氢化物的稳定性强。
2.科学家根据元素周期律和原子结构理论预测,原子序数为114的元素位于第7周期ⅣA族,称为类铅元素。下面关于它的原子结构和性质预测正确的是( )
A.类铅元素原子的最外层电子数为6B.其常见价态为+4、-4C.它的金属性比铅强D.它的原子半径比铅小
【解析】选C。114号元素位于第7周期第ⅣA族,因此其最外层电子数为4,故A项错误。因同主族从上到下,金属性逐渐增强,原子半径逐渐增大,故114号类铅元素是一种典型的金属元素,且其金属性比铅强,原子半径比铅大,故C项正确,D项错误;金属元素没有负化合价,故B项错误。
【补偿训练】(2019·洛阳高一检测)某主族元素R的最高正化合价与最低负化合价的代数和为4,由此可以判断 ( )
A.R一定是第4周期元素B.R一定是ⅣA族元素C.R的气态氢化物比同周期其他元素气态氢化物稳定D.R的气态氢化物化学式为H2R
【解析】选D。根据最高正化合价与最低负化合价的代数和为4,推出R最高正化合价为+6,是ⅥA族元素,但不能确定其周期数;其气态氢化物可表示为H2R,其稳定性比同周期的ⅦA族的小。
【素养提升】镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属ⅢA族。镓的熔点为29.78 ℃,沸点高达2 403 ℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120 ℃。
由此判断下列有关镓的性质及其用途的叙述不正确的是________。 ①镓是制造高温温度计的上佳材料②镓能溶于强酸和强碱中
③镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中④近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体家族的新成员”,这是利用了镓的导电性介于导体和绝缘体之间的性质
【提示】④。镓的熔点为29.78 ℃,沸点高达2 403 ℃;镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120 ℃,因此①③正确。铝能溶于强酸和强碱中,铝是电的良导体而不是半导体,镓是“类铝”元素,所以镓能溶于强酸和强碱中,镓是电的良导体而不是半导体,即②正确,④不正确。
知识点三 元素“位—构—性”三者之间的关系【重点释疑】 同一元素的“位置、结构、性质”之间的关系可表示如下:
应用“位置、结构、性质”三者之间的关系解答问题时要注意以下几个方面:
1.元素的原子结构与元素在周期表中位置的关系
2.原子结构与元素性质的关系
3.元素性质与元素在周期表中位置的关系
【易错提醒】元素推断的思路分析
【思考·讨论】(1)什么元素(放射性元素除外)的金属性最强?什么元素的非金属性最强?分别位于元素周期表中的什么位置?提示:铯的金属性最强,氟的非金属性最强,分别位于元素周期表的左下角和右上角。
(2)如果已知X、Y为周期表中相邻的两元素,且它们的最高价氧化物对应水化物的酸性强弱为X>Y,能否确定它们的相对位置?
提示:可根据元素非金属性的变化规律确定它们的相对位置。由已知条件可确定非金属性为X>Y,所以,如果它们同周期,则X在Y的右面;如果它们同主族,则X在Y的上面。
【案例示范】【典例】(2019·全国卷Ⅱ)今年是门捷列夫发现元素周期律150周年。如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W
【解析】选D。主族元素的最高化合价与最外层电子数相等,由“W与X的最高化合价之和为8”可知,W为N,X为Al,Y为Si,Z为P。原子半径:N
A.原子半径:丙<丁<戊B.金属性:甲>丙C.氢氧化物碱性:丙>丁>戊D.最外层电子数:甲>乙
【解析】选C。同周期元素原子半径从左至右是依次减小的,故A项错误;同主族元素金属性自上而下是增强的,故B项错误;同周期元素的金属性从左至右越来越弱,故对应氢氧化物的碱性是逐渐减弱的,故C项正确;同周期元素的原子最外层电子数从左到右越来越多,故D项错误。
【补偿训练】(2019·东莞高一检测) a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是 ( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1B.b与其他三种元素均可形成至少两种二元化合物C.c的原子半径是这些元素中最大的D.d与a形成的化合物的溶液呈弱酸性
【解析】选A。由题中所给的信息可知,a为H,b为O,c为Na,d为S。A项中,H与Na可以形成化合物NaH,H的化合价为-1;B项中,O与其他三种元素可以形成H2O、H2O2、Na2O、Na2O2、SO2、SO3等二元化合物;C项中,四种元素原子半径大小顺序为Na>S>O>H;D项中,H与S形成化合物H2S,其水溶液呈弱酸性。
【核心整合】1.同周期、同主族元素性质的预测
2.元素“位—构—性”三者之间的关系
【素养迁移】1.1782年,奥地利首都维也纳一家矿场监督缪勒(Franz Jseph Muller)是第一个提取出碲的人,他在罗马尼亚的一个矿坑中发现当地人称为“奇异金”的矿石提取出碲。碲(Te)是与O、S同主族的元素,位于第五周期。
据此,推断碲的相关性质错误的是( )A.碲的单质在常温下是固态B.碲的常见化合价是-2、+4、+6C.碲可能作半导体材料D.碲的氢化物H2Te很稳定
【解析】选D。第ⅥA族,从上到下,非金属性逐渐减弱,所以H2Te不稳定。
2.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
A.元素X与元素Z的最高正化合价之和的数值等于8B.原子半径的大小顺序为r(X)>r(Y)>r(Z)>r(W)>r(Q)C.离子Y2-和Z3+的核外电子数和电子层数都不相同D.元素W的最高价氧化物对应的水化物的酸性比元素Q的强
【解析】选A。X、Y、Z、W、Q分别为N、O、Al、S、Cl。X(N)的最高正价为+5价,Z(Al)的最高正价为+3价,X(N)、Z(Al)的最高正价之和为8,A项正确;原子半径r(Z)>r(X),B项错误;Y2-为O2-,Z3+为Al3+,它们的核外电子数和电子层数均相同,C项错误;元素W的最高价氧化物对应的水化物为H2SO4,其酸性比Q的最高价氧化物对应的水化物HClO4弱,D项错误。
3.古诗云:“唯有儿时不可忘,持艾簪蒲额头王。”意思是说端午节这天,孩子们拿了艾叶,戴上菖蒲,额头上用雄黄酒写了“王”字,以辟邪防疫。雄黄是一种矿物质,俗称“鸡冠石”,其主要成分是硫化砷,As位于元素周期表第ⅤA族,另外Sr、Tl、Se在生活中有广泛应用,在周期表中分别位于第ⅡA、ⅢA、ⅥA族,请应用元素周期律科学地推断它们的化合物的性质。
下列说法正确的是( )A.Sr(锶)的碳酸盐难溶于水B.Tl(铊)的氢氧化物是两性氢氧化物C.H2Se比H2S更稳定D.H3AsO4酸性比H3PO4强
【解析】选A。Sr与Ca同主族,化合物性质相似,碳酸钙不溶于水,则Sr(锶)的碳酸盐难溶于水,故A正确;Al与Tl同主族,金属性Tl强,则Tl(铊)的氢氧化物是强碱,故B错误;S、Se同主族,非金属性S>Se,则H2S比H2Se更稳定,故C错误;P、As同主族,非金属性P>As,则H3AsO4酸性比H3PO4弱,故D错误。
4.锂广泛应用于电池、陶瓷、玻璃、润滑剂、制冷液、核工业以及光电等行业。随着电脑、数码相机、手机、移动电动工具等电子产品的不断发展,电池行业已经成为锂最大的消费领域。
镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等。下列关于锂的叙述不正确的是( )
A.Li2SO4能溶于水B.LiOH是易溶于水、受热不分解的强碱C.Li遇浓硫酸不产生“钝化”现象D.Li2CO3受热分解,生成Li2O和CO2
【解析】选B。根据题中信息,将镁的有关性质进行迁移应用,可推测锂的有关性质。由Mg、Mg(OH)2、MgCO3、MgSO4的性质推测相应的Li及其化合物的性质。MgSO4易溶于水,Mg(OH)2是难溶、易分解的中强碱,Mg与浓硫酸能发生反应,MgCO3受热易分解生成MgO和CO2,故B项不正确。
5.(2019·潍坊高一检测)近年来,我国在超导研究方面居世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第六周期ⅢA族。
下列对铊的性质推导可能正确的是( )①铊是易导电的银白色金属②Tl(OH)3是两性氢氧化物③Tl3+的氧化能力比Al3+的强④单质能跟稀硝酸反应生成硝酸盐A.①④B.②③C.只有①D.只有④
【解析】选A。铊位于第六周期ⅢA族,与Al同主族,同主族元素,随着原子序数增大,元素原子失电子能力逐渐增强,金属离子的氧化性逐渐减弱,最高价氧化物对应水化物的碱性逐渐增强。故①④正确。
【补偿训练】碳硅硫净化器是一种利用物理处理方法,使处理过的水在工业、民用循环、冷却水系统应用中,能彻底防止和清除碳酸钙、硅酸钙、硫酸钙结垢问题。下面是研究碳、硅、硫性质的相似性和递变性的实验,请回答相关问题。
(1)请判断:硫、碳、硅的非金属性由强到弱的顺序是什么?提示:硫>碳>硅。
(2)请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:H2SiO3难溶于水)。实验试剂:浓盐酸、稀硫酸、饱和H2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液。
①甲乙丙三个仪器中各盛放什么试剂?提示:稀硫酸、Na2CO3粉末、Na2SiO3溶液。②乙仪器中的现象有哪些?提示:产生大量气泡。
化学必修 第二册第3节 元素周期表的应用图片课件ppt: 这是一份化学必修 第二册第3节 元素周期表的应用图片课件ppt,共31页。PPT课件主要包含了半导体材料,光导纤维,玻璃等,思考交流,原子半径依次减小,原子半径依次增大,失电子能力依次增强,非金属性依次增强,得电子能力依次增强,金属性依次增强等内容,欢迎下载使用。
2021学年第3节 元素周期表的应用获奖ppt课件: 这是一份2021学年第3节 元素周期表的应用获奖ppt课件,文件包含新教材精创133预测元素及其化合物的性质课件2-鲁科版高中化学必修第二册共19张PPTpptx、新教材精创133预测元素及其化合物的性质学案2-鲁科版高中化学必修第二册docx、新教材精创133预测元素及其化合物的性质教学设计2-鲁科版高中化学必修第二册docx、新教材精创133预测元素及其化合物的性质练习2原卷版docx、新教材精创133预测元素及其化合物的性质练习2解析版docx等5份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用教案配套课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用教案配套课件ppt,













