

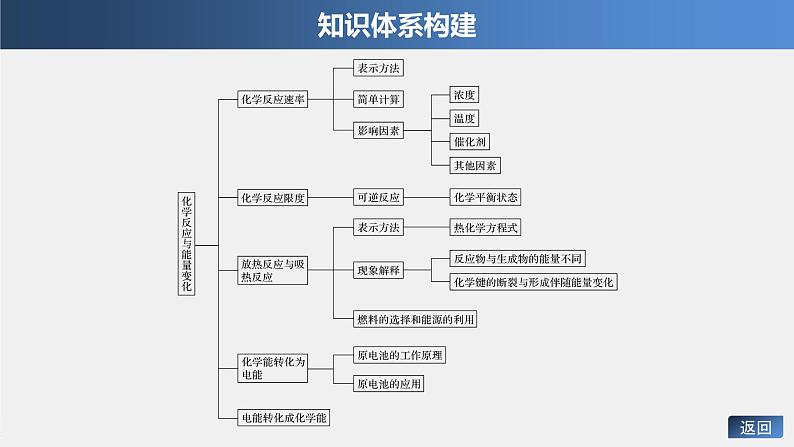





高中化学苏教版 (2019)必修 第二册专题6 化学反应与能量变化本单元综合与测试一等奖ppt课件
展开1.变化观念与平衡思想通过本章的学习,让学生知道化学反应过程中不但有物质变化,而且伴随着能量变化,能量变化也可以是多样的,化学反应速率受温度、反应物浓度、催化剂等外界条件的影响,增强化学反应是动态变化的观念。通过原电池原理和可逆反应的学习,让学生建立起平衡的思维模型,知道原电池中正负极得失电子守恒,对一定条件下的可逆反应,当v正=v逆时,反应达到平衡,反应体系中各组分浓度保持不变,增强平衡思想的培养。
例1 在1×105Pa和298 K时,将1 ml气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·ml-1)。下面是一些共价键的键能(已知N2分子中有一个N≡N,氨分子中有三个等价的N—H):
(1)根据表中的数据判断工业合成氨的反应N2(g)+3H2(g) 2NH3(g)是______(填“吸热”或“放热”)反应。
解析 化学反应的实质就是反应物中化学键断裂、生成物中化学键形成的过程,断裂化学键吸收能量,形成化学键放出能量。N2(g)+3H2(g)2NH3(g)的反应中断裂化学键共吸收的能量为945 kJ+3×436 kJ=2 253 kJ,形成化学键共放出的能量为2×3×391 kJ=2 346 kJ,所以该反应为放热反应。
(2)在298 K时,取1 ml氮气和3 ml氢气放入一密闭容器中,在催化剂存在下进行反应。理论上(假设完全反应生成2 ml NH3)放出或吸收的热量为Q1,则Q1的数值为_____ kJ。
解析 理论上放出的热量为2 346 kJ-2 253 kJ=93 kJ。
(3)实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是______(填字母)。A.Q1>Q2B.Q1
该反应为可逆反应,在密闭容器中反应达到平衡时,1 ml N2和3 ml H2不能完全反应生成2 ml NH3,因而放出的热量小于93 kJ
例2 利用NO2平衡混合气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程。①按图所示连接实验装置。②向甲烧杯中加入一定量的CaO固体,此时烧杯中NO2平衡混合气体的颜色变深:向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体的颜色变浅。回答下列问题:(1)CaO与水反应的化学方程式为_______________________,该反应为______(填“吸热”或“放热”)反应。
CaO+H2O===Ca(OH)2
解析 根据题给信息可知,甲烧杯中NO2平衡混合气体颜色加深,说明CaO溶于水时发生的反应CaO+H2O===Ca(OH)2为放热反应。
(2)NH4NO3晶体溶于水时,乙烧杯内温度______(填“升高”或“降低”)。NH4NO3溶于水________(填“是”或”不是”)吸热反应。
解析 乙烧杯中NO2平衡混合气体颜色变浅,说明NH4NO3晶体溶于水时吸热,乙烧杯内温度降低,但不是吸热反应,因为NH4NO3晶体溶于水无新物质生成,不是化学反应。
(3)查阅资料知,NO2的平衡混合气体中存在可逆反应2NO2(g) N2O4(g),已知NO2为红棕色,N2O4为无色。结合实验知,当温度升高时,平衡__________(填“未被破坏”或“发生移动”),此时反应速率______(填“增大”“减小”或“不变化”)。混合气体的颜色不变_____(填“能”或“不能”)证明反应已达到平衡状态。
解析 两烧杯中的现象说明,温度能影响可逆反应2NO2(g) N2O4(g),因此升温或降温时,该平衡会发生移动。升高温度,反应速率增大。当混合气体颜色不变时,说明NO2的浓度不再变化,能证明反应已达到平衡状态。
2.科学态度与社会责任通过本专题的学习,让学生理解化学反应都伴随着能量变化,可以将化学能转化为热能、电能等。因此可以合理利用传统能源,大力开发新能源,实现“绿色环保”理念,形成简约适度,绿色低碳的发展模式。通过对化学反应速率及限度的学习,让学生理解在工业生产中,可以通过选择适当条件,加快反应速率,提高产品产率,如控制变量,实现工业生产的最佳产能,降低能耗,减少污染,从而促进社会的可持续发展。
例3 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理处理尾气:2NO+2CO 2CO2+N2。(1)写出CO2的结构式:___________。
解析 CO2为直线形分子,其结构式为O==C==O。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:则反应速率v(a)、v(b)、v(c)的大小关系是___________________。
解析 反应开始时反应物的浓度最大,故反应速率最大,当反应达到平衡时,反应速率保持不变。
(3)为研究如何提高该转化过程的反应速率,某课题组进行了以下实验探究。【资料查阅】A.不同的催化剂对同一反应的催化效率不同;B.使用等质量的同种催化剂时,催化剂的比表面积对催化效率有影响。【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
【结论】①实验编号Ⅱ的实验目的为________________________________________。②课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是_______,且__________反应速率将______(填“增大”“减小”或“无影响”)。
探究同种催化剂的比表面积对反应速率的影响
解析 对比表格中各组数据,找出答案。
高中化学人教版 (2019)选择性必修2第一章 原子结构与性质本章综合与测试课堂教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一章 原子结构与性质本章综合与测试课堂教学ppt课件,共16页。PPT课件主要包含了知识体系构建,核心素养提升,内容索引,d24s2,Li+核电荷,数较大,哑铃纺锤,Zn原子核外电子排布,HCO,OGeZn等内容,欢迎下载使用。
苏教版 (2019)必修 第二册专题9 金属与人类文明本单元综合与测试优秀ppt课件: 这是一份苏教版 (2019)必修 第二册专题9 金属与人类文明本单元综合与测试优秀ppt课件,共33页。PPT课件主要包含了知识体系构建,核心素养解读,内容索引,溶液无明显变化,干燥管,badfce,检验生成的SO3,品红溶液,品红溶液褪色,+SO3↑等内容,欢迎下载使用。
苏教版 (2019)必修 第二册专题8 有机化合物的获得与应用本单元综合与测试优质ppt课件: 这是一份苏教版 (2019)必修 第二册专题8 有机化合物的获得与应用本单元综合与测试优质ppt课件,共26页。PPT课件主要包含了知识体系构建,核心素养解读,内容索引,化学性质,氧化反应,催化氧化,羟基OH,淡蓝色,羧基COOH,酯化反应等内容,欢迎下载使用。













