




(新高考)高考化学大一轮复习课件第8章第52讲难溶电解质的溶解平衡(含解析)
展开1.了解难溶电解质的溶解平衡。2.理解溶度积(Ksp)的含义,能进行相关的计算。
1.物质在水中的溶解度20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
2.沉淀溶解平衡(1)概念在一定温度下,当沉淀和溶解的速率 时,形成 ,达到平衡状态,把这种平衡称为沉淀溶解平衡。
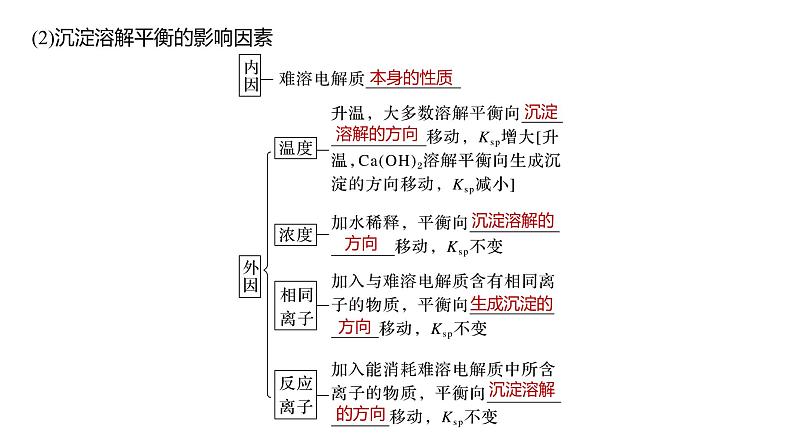
(2)沉淀溶解平衡的影响因素
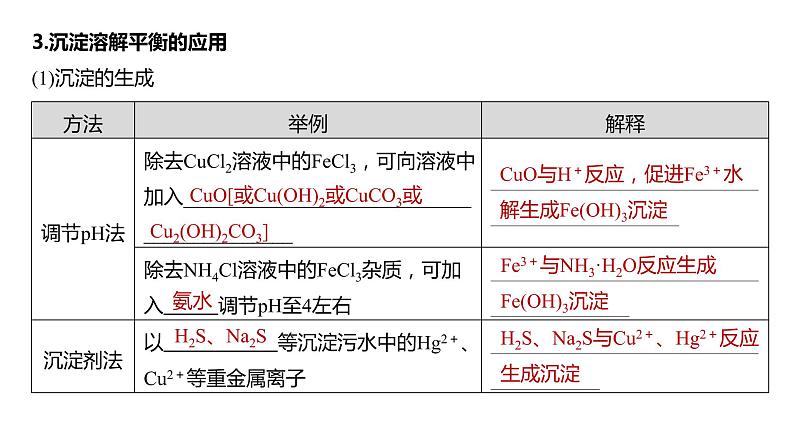
3.沉淀溶解平衡的应用(1)沉淀的生成
CuO与H+反应,促进Fe3+水解生成Fe(OH)3沉淀
Fe3+与NH3·H2O反应生成Fe(OH)3沉淀
H2S、Na2S与Cu2+、Hg2+反应生成沉淀
CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3]
(2)沉淀的溶解如要使Mg(OH)2沉淀溶解,可加入 。(3)沉淀的转化锅炉除垢,将CaSO4转化为CaCO3的离子方程式为__________________________________________;ZnS沉淀中滴加CuSO4溶液得到CuS沉淀的离子方程式为____________________________________。
1.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止( )2.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同( )3.在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀( )4.为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀( )5.洗涤沉淀时,洗涤次数越多越好( )6.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH会增大( )7.钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出( )
一、沉淀溶解平衡及其移动1.已知溶液中存在平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下,向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥ B.①⑥⑦ C.②③④⑥ D.①②⑥⑦
已知:室温下,CaCO3的溶解度为0.001 3 g。下列说法不正确的是A.a→b电导率上升是由于CaCO3固体部分溶解于水中B.c和e对应的时刻分别加入了10 mL蒸馏水C.c→d、e→f,电导率下降,说明CaCO3的溶解平衡逆向移动D.g后的电导率几乎不再改变,说明CaCO3的溶解达到平衡状态
2.室温下向100 mL蒸馏水中加入1 g CaCO3,一段时间后再向其中加入10 mL蒸馏水,一段时间后继续加入10 mL蒸馏水。该过程中电导率的变化如下图:
AgCl的澄清饱和溶液,加水稀释,沉淀溶解平衡右移,但离子浓度减小,而AgCl悬浊液加水稀释,平衡右移,但c(Ag+)和c(Cl-)不变。AgCl沉淀溶解达到平衡时,再加入AgCl固体对平衡无影响。
A.实验①白色沉淀是难溶的AgClB.若按②①顺序实验,能看到白色沉淀C.若按①③顺序实验,能看到黑色沉淀D.由实验②说明AgI比AgCl更难溶
二、沉淀溶解平衡的实验探究3.(2022·北京海淀区模拟)取1 mL 0.1 ml·L-1 AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 ml·L-1),下列说法不正确的是
B.②中颜色变化说明上层清液中含有SCN-C.③中颜色变化说明有AgI生成D.该实验可以证明AgI比AgSCN更难溶
4.为研究沉淀的生成及转化,某小组进行如下实验。关于该实验的分析不正确的是
三、沉淀溶解平衡的应用5.金属氢氧化物在酸中的溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ml·L-1)如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是_______(填化学式)。
据图知pH=4~5时,Cu2+开始沉淀为Cu(OH)2,因此pH=3时,主要以Cu2+形式存在。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为____(填字母)。A.<1 B.4左右 C.>6
若要除去CuCl2溶液中的Fe3+,应保证Fe3+完全沉淀,而Cu2+还未沉淀,据图知应控制溶液pH为4左右。
(3)在Ni(NO3)2溶液中含有少量的C2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________________________________。
据图知,C2+和Ni2+沉淀的pH范围相差太小,无法通过调节溶液pH的方法除去Ni(NO3)2溶液中的C2+。
C2+和Ni2+沉淀的pH范围相差太小
(4)已知一些难溶物的溶度积常数如下表:
在FeS、CuS、PbS、HgS四种硫化物中,FeS的溶度积最大,且与其他三种物质的溶度积差别较大,在废水中加入FeS,Cu2+、Pb2+、Hg2+均可分别转化为溶度积更小的沉淀,过量FeS也可一起过滤除去,且不会引入新的杂质。
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的______(填字母)除去它们。A.NaOH B.FeS C.Na2S
1.溶度积和离子积以AmBn(s) mAn+(aq)+nBm-(aq)为例:
cm(An+)·cn(Bm-)
2.Ksp的影响因素(1)内因:物质本身的性质。(2)外因:仅与 有关,与浓度、压强、催化剂等无关。
5.向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成,则Ksp(AgCl)>Ksp(AgI) ( )
1.已知:Ksp(Ag2CrO4)<Ksp(AgCl),则Ag2CrO4的溶解度小于AgCl的溶解度( )2.常温下,向BaCO3的饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小( )3.溶度积常数Ksp只受温度影响,温度升高,Ksp增大( )
一、Ksp的大小比较1.分别进行下列操作,由现象得出的结论正确的是
二、和Ksp有关的计算与判断2.常温下,若向50 mL 0.002 ml·L-1 CuSO4溶液中加入50 mL 0.004 4 ml·L-1 NaOH溶液,生成了沉淀。已知Ksp[Cu(OH)2]=2.0×10-20,计算沉淀生成后溶液中c(Cu2+)=____________ ml·L-1。
3.(2022·安徽合肥一中模拟)298 K时,向c(Ce3+)=0.02 ml·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?_____(填“是”或“否”),判断的理由是_______________________________________________________________________________________________________。(要求列式计算,已知:Ksp[Ce(OH)3]=1.0×10-20,c(Ce3+)<1.0×10-5 ml·L-1时视为沉淀完全)
1.0×10-8 ml·L-1<1.0×10-5 ml·L-1,所以Ce3+沉淀完全
4.(2022·四川仁寿二中模拟)已知25 ℃时,Al(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2O Al(OH)3+3H+的平衡常数为_____________。
常温下,用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为Fe3+,加碱调节至pH为______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 ml·L-1时,即可认为该离子沉淀完全);继续加碱至pH为_____时,锌开始沉淀(假定Zn2+浓度为0.1 ml·L-1)。若上述过程不加H2O2后果是_____________________,原因是___________________________。
5.有关数据如表所示:
Zn2+和Fe2+不能分离
Fe(OH)2和Zn(OH)2的Ksp相近
三、沉淀滴定6.KClO4样品中常含少量KCl杂质,为测定产品纯度进行如下实验:准确称取5.689 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为Cl-,反应为3KClO4+C6H12O6===6H2O+6CO2↑+3KCl,加入少量K2CrO4溶液作指示剂,用0.200 0 ml·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积21.00 mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。(1)已知:Ksp(AgCl)=1.8×l0-10,Ksp(Ag2CrO4)=1.1×10-12,若终点时c( )=1.1×10-4 ml·L-1,则此时c(Cl-)=____________ml·L-1。
(2)计算KClO4样品的纯度(请写出计算过程)。
答案 n(AgNO3)=0.200 0 ml·L-1×0.021 L=0.004 2 ml,25.00 mL溶液中n(KCl)总=n(AgNO3)=0.004 2 ml,n(KClO4)+n(KCl)=0.004 2 ml,n(KClO4)×138.5 g·ml-1+n(KCl)×74.5 g·ml-1=0.568 9 g,
1.(2020·全国卷Ⅱ,9)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如图所示。下列叙述错误的是
蓝色沉淀溶解,溶液变成深蓝色
(5)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因:______________________________________________________________________________________________________________________________________________。
游客呼出的CO2可与钟乳石的主要成分
向移动,CaCO3减少,钟乳石被破坏
4.[2020·全国卷Ⅲ,27(1)(2)(3)(4)]某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)“碱浸”中NaOH的两个作用分别是_____________________________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式:____________________________。
除去油脂,溶解铝及其氧化物
(2)“滤液②”中含有的金属离子是_____________________。
Ni2+、Fe2+、Fe3+
滤饼①加稀硫酸酸浸,产生的滤液中的金属离子有Ni2+、Fe2+、Fe3+。
(3)“转化”中可替代H2O2的物质是___________。若工艺流程改为先“调pH”后“转化”,即 ,“滤液③”中可能含有的杂质离子为_____。
过程中加入H2O2的目的是氧化Fe2+,由于Fe2+的还原性强,能与氧气反应,因此也可以用氧气或空气代替H2O2;如果过程中先“调pH”后“转化”,结合金属离子沉淀的有关pH数据可知,当调节pH小于7.2时,Fe2+不能形成沉淀,加入H2O2后Fe2+被氧化为Fe3+,因此滤液③中可能混有杂质Fe3+。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=__________________________________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 ml·L-1,则“调pH”应控制的pH范围是__________。
0.01×(107.2-14)2[或10-5×(108.7-14)2]
根据溶度积的表达式得Ksp[Ni(OH)2]=c(Ni2+)·c2(OH-)=0.01×(107.2-14)2[或10-5×(108.7-14)2];
所以当pH=6.2时,Ni2+开始产生沉淀,根据流程图可知,调pH的目的是让Fe3+沉淀完全,所以需要调节pH大于3.2,综合分析,应控制pH的范围为3.2~6.2。
1.下列有关AgCl沉淀溶解平衡的说法正确的是A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl沉淀的溶解度减小D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
2.下列化学原理的应用,可以用沉淀溶解平衡原理来解释的是①热纯碱溶液洗涤油污的能力比冷纯碱溶液强 ②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒 ③石灰岩(喀斯特地貌)溶洞的形成 ④BaCO3不能作“钡餐”,而BaSO4可以 ⑤泡沫灭火器灭火原理A.②③④ B.①②③C.③④⑤ D.①②③④⑤
3.(2022·保定模拟)在一定温度下,当过量的Mg(OH)2固体在水溶液中达到平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体增加,c(OH-)增加,可采取的措施是A.加适量的水B.通入少量HCl气体C.加少量NaOH固体D.加少量MgSO4固体
4.在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法正确的是A.饱和CuS溶液中Cu2+的浓度为1.3×10-36 ml·L-1B.25 ℃时,FeS的溶解度大于CuS的溶解度C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成D.向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
由FeS的Ksp=6.3×10-18、CuS的Ksp=1.3×10-36可知,二者的组成形式相同,FeS的溶解度大于CuS的溶解度,故B正确;FeS的Ksp=6.3×10-18、ZnS的Ksp=1.3×10-24,向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,首先生成溶解度小的ZnS沉淀,故C错误;饱和ZnS溶液中存在ZnS的溶解平衡,加入少量ZnCl2固体,锌离子浓度增大,溶解平衡逆向移动,但温度不变,ZnS的Ksp不变,故D错误。
5.往锅炉注入Na2CO3溶液浸泡,将水垢中的CaSO4转化为CaCO3,再用盐酸去除,下列叙述正确的是A.温度升高,Na2CO3溶液的Kw增大,c(OH-)减小B.CaSO4能转化为CaCO3,说明Ksp(CaCO3)>Ksp(CaSO4)C.CaCO3溶解于盐酸而CaSO4不溶,是因为硫酸酸性强于盐酸
温度升高,水的电离平衡正向移动,Kw增大;温度升高,Na2CO3的水解平衡正向移动,c(OH-)增大,A项错误;Ksp(CaCO3)<Ksp(CaSO4),B项错误;CaCO3与盐酸反应生成可溶性的氯化钙、水和二氧化碳,CaSO4与盐酸不满足复分解反应发生的条件,与酸性强弱无关,C项错误;
6.25 ℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。下列说法错误的是A.若向Mg(OH)2悬浊液中加入少量NH4Cl(s),c(Mg2+)会增大B.若向Mg(OH)2悬浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色C.若向Mg(OH)2悬浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动D.若向Mg(OH)2悬浊液中加入少量Na2CO3(s),固体质量将增大
A项,向Mg(OH)2悬浊液中加入少量NH4Cl(s),c(OH-)减小,平衡正向移动,促进氢氧化镁的溶解,c(Mg2+)会增大,正确;B项,向Mg(OH)2悬浊液中滴加CuSO4溶液,由于Ksp[Mg(OH)2]=1.8×10-11>Ksp[Cu(OH)2]=2.2×10-20,则沉淀将由白色的氢氧化镁逐渐变为蓝色的氢氧化铜,正确;C项,加入少量蒸馏水,Ksp保持不变,平衡正向移动,促进氢氧化镁的溶解,错误;D项,向Mg(OH)2悬浊液中加入少量Na2CO3(s),由于碳酸根离子水解呈碱性,所以c(OH-)增大,平衡逆向移动,有固体析出,则固体质量将增大,正确。
C.向0.5 L 0.10 ml·L-1ZnSO4溶液中加入等体积0.02 ml·L-1AgNO3溶液,即可生成 Ag2SO4沉淀D.常温下,要除去0.20 ml·L-1ZnSO4溶液中的Zn2+,要调节pH≥8
7.硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25 ℃时,Ksp[Zn(OH)2]=1.0×10-17,Ksp(Ag2SO4)=1.4×10-5,则下列说法正确的是A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小
C.ZnS+2H2O===Zn(OH)2+H2S↑D.Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O
8.已知25 ℃时,一些难溶物质的溶度积常数如下:
根据上表数据,判断下列化学方程式不正确的是A.2AgCl+Na2S===2NaCl+Ag2S
A.向①中加入酚酞,溶液显红色说明物质的“不溶性”是相对的B.分别向少量Mg(OH)2沉淀中加入适量等体积的②③,沉淀均能快速彻底溶解
9.某些盐能溶解沉淀,利用下表三种试剂进行实验,相关分析不正确的是
D.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
C.实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
10.某兴趣小组进行下列实验:①将0.1 ml·L-1 MgCl2溶液和0.5 ml·L-1 NaOH溶液等体积混合得到浊液②取少量①中浊液,滴加0.1 ml·L-1 FeCl3溶液,出现红褐色沉淀③将①中浊液过滤,取少量白色沉淀,滴加0.1 ml·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解下列说法不正确的是A.将①中所得浊液过滤,所得滤液中含少量Mg2+
11.NiSO4·6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下:已知:25 ℃时,Ksp(CuS)=8.9×10-35、Ksp(FeS)=4.9×10-18。
下列说法错误的是A.溶解废渣时不能用稀盐酸代替稀H2SO4B.除去Cu2+可采用FeSC.流程中a~b的目的是富集NiSO4D.“操作Ⅰ”为蒸发浓缩、冷却结晶
12.我国《生活饮用水卫生标准》中规定生活饮用水中镉的排放量不超过0.005 mg·L-1。处理含镉废水可采用化学沉淀法。试回答下列问题:(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式为Ksp=__________________ 。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,那么它们在水中的溶解量__________较大。
(3)向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8 ml·L-1时,废水中Cd2+的浓度为___________ ml·L-1[已知:Ksp(CdS)=7.9×10-27,Mr(Cd)=112],此时是否符合生活饮用水卫生标准? ______(填“是”或“否”)。
新高考化学一轮复习课件 第8章 第52讲 难溶电解质的溶解平衡: 这是一份新高考化学一轮复习课件 第8章 第52讲 难溶电解质的溶解平衡,共60页。PPT课件主要包含了高考化学一轮复习策略,难溶电解质的溶解平衡,沉淀溶解平衡及应用,归纳整合,专项突破,溶度积常数及其应用,真题演练明确考向,课时精练等内容,欢迎下载使用。
(新高考)高考化学大一轮复习课件第9章第59讲卤代烃醇酚(含解析): 这是一份(新高考)高考化学大一轮复习课件第9章第59讲卤代烃醇酚(含解析),共60页。PPT课件主要包含了复习目标,卤代烃,卤素原子,碳卤键,NaBr,NaBr+H2O,1实验流程,醇的结构和性质,苯环侧链,易溶于等内容,欢迎下载使用。
(新高考)高考化学大一轮复习课件第9章第58讲烃(含解析): 这是一份(新高考)高考化学大一轮复习课件第9章第58讲烃(含解析),共60页。PPT课件主要包含了复习目标,芳香烃,真题演练明确考向,课时精练等内容,欢迎下载使用。












