

高中第二章 化学反应与能量综合与测试课后测评
展开一、单选题
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①地热能 ②煤 ③天然气 ④太阳能 ⑤生物质能 ⑥石油 ⑦风能 ⑧氢能
A.②⑤⑦⑧B.①④⑤⑦⑧C.④⑤⑦⑧D.②③⑥⑦⑧
2.下列关于化学反应与能量变化说法不正确的是( )
①在高温、高压条件下发生的反应一定是吸热反应
②H2在Cl2中燃烧、H2与Cl2的混合气体光照发生爆炸,都放出热量,且后者放出热量多
③水汽化需要吸收能量,所以水汽化属于吸热反应
④对于吸热反应,生成物总能量一定低于反应物总能量
⑤X(s)=Y(s)是放热反应,则X比Y稳定
⑥等量的硫蒸气和固态硫分别完全燃烧,后者放出的热量更多
A.①②③④⑤⑥B.③④⑤⑥ C.①②③⑤⑥D.②③④
3.据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是( )
A. B.
C. D.
4.H2O2分解速率受多种因素影响。实验测得70℃ 时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
5.下列实验现象不能说明相应的化学反应一定是放热反应的是( )
A.AB.BC.CD.D
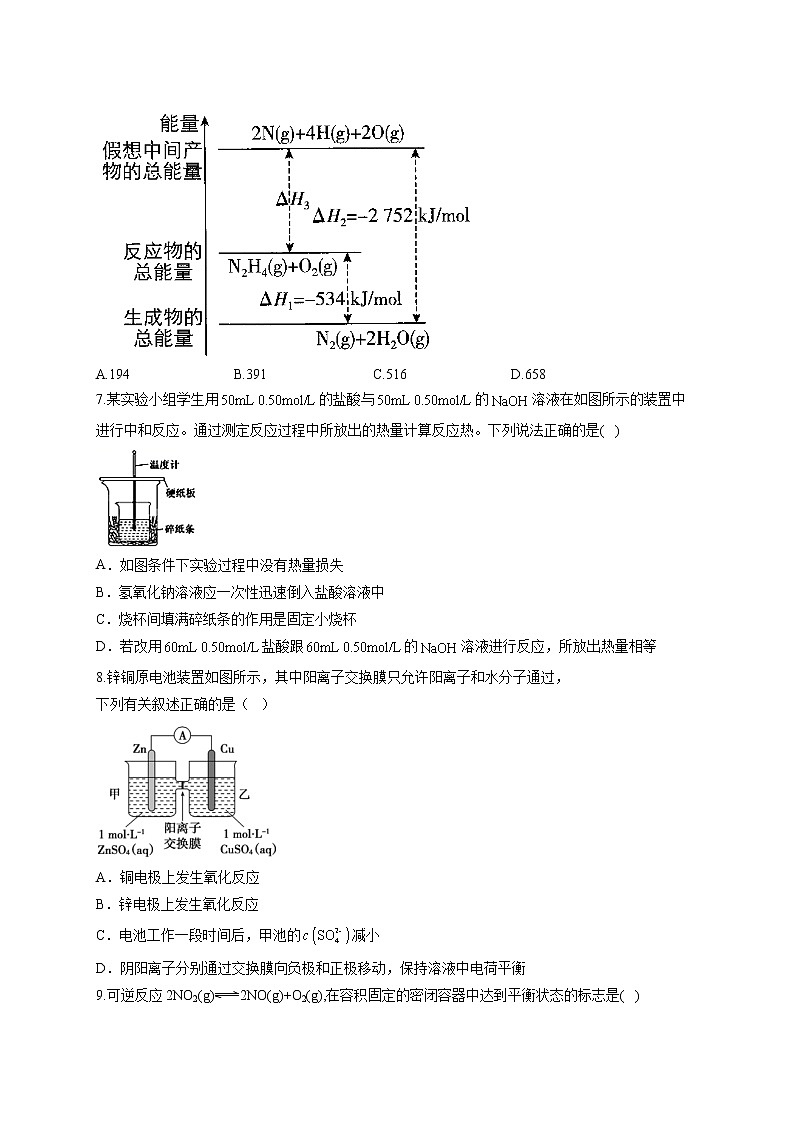
6.肼是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1ml化学键所需的能量:键为942kJ、O==O键500kJ、N—N键为154kJ,则断裂键所需的能量(kJ)是( )
A.194B.391C.516D.658
7.某实验小组学生用的盐酸与的溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.氢氧化钠溶液应一次性迅速倒入盐酸溶液中
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用盐酸跟的溶液进行反应,所放出热量相等
8.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,
下列有关叙述正确的是( )
A.铜电极上发生氧化反应
B.锌电极上发生氧化反应
C.电池工作一段时间后,甲池的减小
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
9.可逆反应2NO2(g)2NO(g)+O2(g),在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成n ml O2的同时生成NO2
②单位时间内生成n ml O2的同时生成NO
③用NO2、NO、O2表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
10.反应4A(s)+3B(g)2C(g)+D(g),经2min,B的浓度减少0.6ml·L-1。下列说法中,正确的是( )
A.用A表示的反应速率是0.4ml·(L·min)-1
B.分别用B、C、D表示反应速率,其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3ml·(L·min)-1
D.在这2min内B和C两物质的浓度都减小
11.某金属-空气电池的工作原理如图所示。下列说法错误的是( )
A.金属M作电池负极,放电时发生氧化反应
B.放电时,空气中的氧气得到电子
C.电池总反应为
D.放电时,外电路电子由碳材料电极流向金属M电极
12.溶液在不同温度下均可被过量氧化,当完全消耗即有析出,依据析出所需时间可以求得的反应速率。将浓度均为溶液(含少量淀粉)10.0mL、酸性溶液40.0mL混合,记录10~55℃间溶液变蓝所需时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断正确的是( )
A.40℃之前,温度升高反应速率减慢,变色耗时变长
B.40℃之后溶液变蓝的时间随温度的升高变短
C.图中b、c两点对应的的反应速率相等
D.图中a点对应的的反应速率为
13.化学家正在研究尿素燃料电池,尿素燃料电池结构如图所示,用这种电池直接去除城市废水中的尿素,下列有关描述正确的是( )
A.甲电极为电池的正极
B.乙电极的电极反应式为:
C.电池工作时氢离子向甲电极移动
D.电池工作时,理论上净化消耗标准状况下浓度的废水
14.一定温度下,向溶液中加入适量溶液,不同时刻测得生成的体积(已折算为标准状况)如表所示:
资料显示,反应分两步进行:①,②。反应过程中能量变化如图所示。下列说法错误的是( )
A.的作用是增大过氧化氢的分解速率
B.反应①是吸热反应、反应②是放热反应
C.反应的
D.0~6min的平均反应速率
二、填空题
15.汽车排放的尾气为大气污染物之一,目前,可利用以下化学原理处理汽车尾气:2NO+2CO2CO2+N2。
(1)写出CO2的结构式:____________。
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如下所示:
则反应速率v(a)、v(b)、v(c)的大小关系是_______。
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
【结论】① 实验编号Ⅱ的实验目的为______________。
② 课题中探究外界条件对汽车尾气转化反应速率的影响的另一因素是_______,且_______反应速率将_______(填“增大”“减小”或“无影响”)。
参考答案
1.答案:B
解析:煤、石油、天然气是化石能源,不可再生,不是新能源;常见未来新能源有太阳能、地热能、潮汐能、风能、氢能、生物质能等,这些能源对环境污染小,属于环境友好型能源,即符合条件的是①④⑤⑦⑧,答案选B。
2.答案:A
解析:
3.答案:B
解析:分解水属于吸热反应,催化剂可以降低活化能,分析四个图像可知B正确。
4.答案:D
解析:A.由甲图可知,双氧水浓度越大.分解越快,A错误;B.由图乙可知,溶液的碱性越强,即pH越大,双氧水分解越快,B错误;C.由图丙可知,有一定浓度的Mn2+存在时,并不是碱性超强H2O2分解速率就越快,C错误;由图丙可知,碱性溶液中,Mn2+对双氧水分解有影响,图丁说明Mn2+浓度越大,双氧水分解越快.图丙和图丁均能表明碱性溶液中,Mn2+对H2O2分解影响大,D正确。
5.答案:B
解析:A处红色水柱下降,可知瓶内空气受热膨胀,说明相应的化学反应是放热反应,故A不符合题意;B.Zn与稀硫酸反应生成氢气,氢气可使针筒活塞向右移动,不能充分说明相应的化学反应是放热反应,故B符合题意;C.温度计的水银柱不断上升,则中和反应放出热量,说明相应的化学反应是放热反应,故C不符合题意;D.饱和石灰水变浑浊,则有氢氧化钙固体析出,而氢氧化钙的溶解度随温度的升高而降低,说明镁条与稀盐酸的反应是放热反应,故D不符合题意。
6.答案:B
解析:化学反应的焓变等于生成物的能量总和与反应物的能量总和的差值,旧键断裂吸收能量,新键生成释放能量,根据图中内容,可以看出 ,设断裂键所需的能量为,旧键断裂吸收的能量为,解得,故B项正确。
7.答案:B
解析:
8.答案:C
解析:
9.答案:A
解析:从平衡状态的两个重要特征上判断:(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变。①单位时间内生成n ml O2的同时生成2n ml NO2,v(正)=v(逆),正确;②单位时间内生成n ml O2的同时生成2n ml NO,二者均为正反应速率,不能作平衡标志,错误;③用NO2、NO、O2表示的反应速率的比为2:2:1的状态,没有明确正、逆反应速率,不能作平衡标志,错误;④混合气体的颜色不再改变时,二氧化氮的浓度不再改变,达到平衡状态,正确;⑤该反应在体积固定的密闭容器中混合气体的密度不随反应的进行而变化,密度不变不能作为平衡标志,错误;⑥该反应前后气体物质的量不等,混合气体的压强不再改变的状态为平衡状态,正确;⑦该反应前后气体物质的量不等,混合气体的平均相对分子质量不再改变的状态为平衡状态,正确。
10.答案:B
解析:A为固体,一般不用固体表示化学反应速率,因为固体的浓度一般视为常数,A项错误。在同一反应中,不同物质表示的化学反应速率的比值等于它们的化学计量数之比,B项正确。v(B)=0.3ml·(L·min)-1为平均值并非2min末的反应速率,C项错误。B为反应物,C为生成物,两者不可能同时减小,D项错误。
11.答案:D
解析:由示意图中离子的移动方向可知,金属M电极为原电池的负极,M失去电子发生氧化反应生成M2+,碳材料电极为正极,氧气在正极得到电子发生还原反应生成氢氧根离子,电池的总反应方程式为。A.由分析可知,金属M电极为原电池的负极,M失去电子发生氧化反应生成M2+,故A正确;B.由分析可知,碳材料电极为正极,氧气在正极得到电子发生还原反应生成氢氧根离子,故B正确;C.由分析可知,电池的总反应方程式为,故C正确;D.原电池工作时,外电路电子由负极流向正极,则放电时,外电路电子由M电极流向金属碳材料电极,故D错误;故选D。
12.答案:D
解析:从图像中可以看出,40℃以前,温度越高,变色所需时间越短,反应速度越快,40℃后温度越高,变色所需时间越长而55℃时溶液未变蓝,说明在较高温度时,淀粉不能作为该反应的指示剂,A、B错误;图中b、c点对应的其他条件相同,但反应温度不同,故反应速率不同,C错误;a点变蓝所需时间为80s,浓度变化量为,对应的的反应速率为,D正确。
13.答案:D
解析:
14.答案:C
解析:反应①+②可得总反应的化学方程式为,故是催化剂,可增大的分解速率,故A正确;反应①中生成物的能量大于反应物的能量,是吸热反应,反应②中生成物的能量小于反应物的能量,是放热反应,故B正确;焓变=生成物的总能量-反应物的总能量,由题图可知反应的,故C错误;0~6min生成的物质的量是0.001ml,消耗的物质的量是0.001ml×2=0.002ml,所以,故D正确。
15.答案:(1)O=C=O(2)v(a)>v(b)=v(c)(3)①探究催化剂比表面积对反应速率的影响②温度升高温度增大
解析:(1)CO2为直线形分子,C和O形成两对共用电子对。
(2)开始时反应物的浓度最大,故反应速率最大,当反应达到平衡时,反应速率不再改变。
(3)对比表格中各组数据,找出答案。
选项
A
B
C
D
反应装置
实验现象
试管中生石灰和水合后,A处红色水柱下降
反应开始后,针筒活塞向右移动
温度计的水银柱不断上升
饱和石灰水变浑浊
0
2
4
6
0
9.9
17.2
22.4
实验编号
实验目的
T/℃
NO初始浓度/(ml/L)
CO初始浓度/(ml/L)
同种催化剂的比表面积/(m2/g)
c(CO)不变时所用的时间/min
Ⅰ
参照实验
280
6.50×10-5
4.00×10-3
80
t
Ⅱ
280
6.50×10-3
4.00×10-3
120
0.5t
Ⅲ
360
6.50×10-3
4.00×10-3
80
0.2t
高中化学人教版 (2019)必修 第二册有机化合物单元综合与测试一课一练: 这是一份高中化学人教版 (2019)必修 第二册有机化合物单元综合与测试一课一练,共10页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
化学必修 第二册化学反应与能量单元综合与测试同步训练题: 这是一份化学必修 第二册化学反应与能量单元综合与测试同步训练题,共11页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
化学必修 第二册化学反应与能量单元综合与测试课堂检测: 这是一份化学必修 第二册化学反应与能量单元综合与测试课堂检测,共7页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。














