



2020-2021学年第三节 化学反应的速率和限度集体备课课件ppt
展开1、掌握可逆反应的定义;2、了解化学平衡的含义;2、掌握化学平衡的特点与判断标志。
本节课在《化学反应速率及其影响因素》的基础上,分析化学反应开始之后速率的变化情况,引入本节课的内容:通过科学探究及理论分析,总结化学平衡状态的特点及其判断标志,并配以考点和常见题型的练习,帮助学生理解和掌握知识点。 在讲解化学平衡状态的特点时,可以借助速率-时间图像帮助学生更加形象生动的理解和记忆。 在讲解化学平衡状态的判断标志时,要抓住平衡状态的特点进行分析,对于有气体参与的可逆反应,在判断化学平衡状态时要强调气体的物质的量的变化情况。
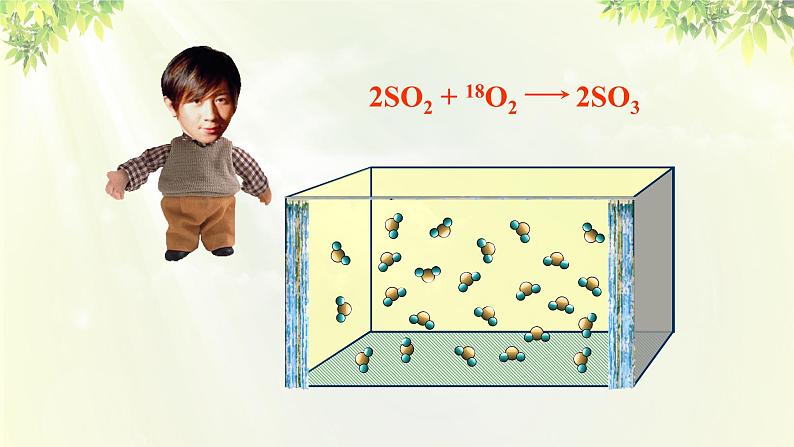
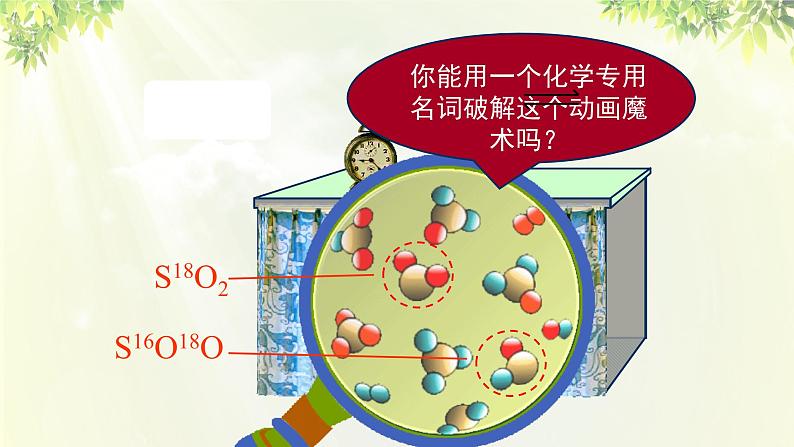
2SO2 + 18O2
2SO2 + 18O2
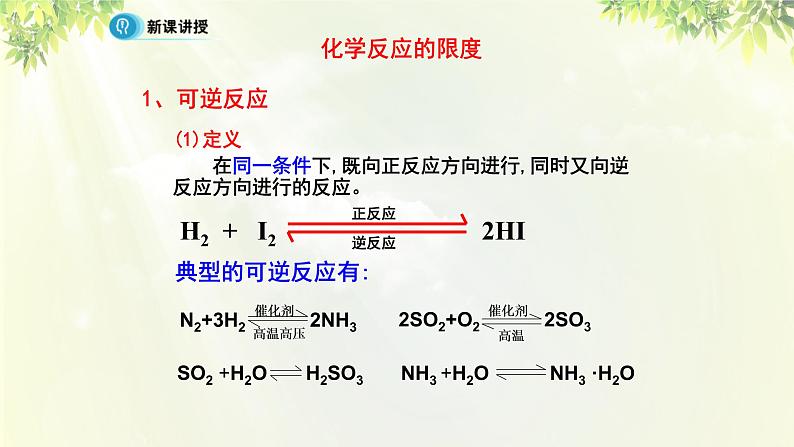
(1)定义 在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应。
(1)水的生成(H2+O2)与电解,(2)二次电池的放电与充电,(3)CO2和H2O在植物中通过光合作用合成糖与糖在体内氧化生成CO2和H2O,它们是否属于“可逆反应”?
双向性、同时性、共存性
1、可逆反应中反应物能否完全转化为生成物?
2、其他化学反应在实际进行时,反应物都能完全转变为生成物?
C+O2=CO2C+CO2==2COFe2O3+3CO==2Fe+3CO2
炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
某温度和压强下的密闭容器中,2SO2+O2 2SO3
此条件下进行到什么时候达到了这个反应的限度?达到反应限度时该反应是否停止了?
2SO2 + O2 2SO3
(1)开始时c(SO2) 、c(O2)大, c(SO2)=0
只有正反应,v(逆)=0
(2)瞬间后c(SO2)、c(O2 )变小,c(SO3)≠0
正逆反应都进行,v(逆) ≠0,v(正)> v(逆)
2SO2 + O2 2SO3
c(SO2) 、c(O2 )变小 ,v(正)减小
c(SO3) 增大,v(逆)增大
(3)c(SO2)、c(O2)逐渐变小,c(SO3)逐渐增大,三种物质的浓度达到一个特定值。
一定时间段内有什么特征?
v(正)= v(逆) ≠0
2SO2 + O2 2SO3
1、由于v(正)= v(逆)≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化.
2、从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。
可逆反应反应速率的特点
(1)0~t1:v(正)>v(逆)
(2)t1:v(正)=v(逆)
2SO2+O2 2SO3
(1)定义 在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正)= v(逆) ≠0
外在标志:反应混合物中各组分 的浓度保持不变
(2)化学平衡状态的特征
③动:动态平衡(v(正)= v(逆) ≠0)
②等:v(正)= v(逆)
④定:各组分的浓度和含量保持不变。
⑤变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。
(3)如何判断达到化学平衡状态?
从平衡状态的定义入手:各组分的百分含量保持不变;正反应速率等于逆反应速率。
③ 颜色、混合气体的总压、总体积、总物质的量、密度、平均摩尔质量保持不变
①速率:v(正)=v(逆)②各成分的含量保持不变
为什么要控制反应的条件:
对有利于我们的或我们需要的化学反应,要想办法增大反应速率,并提高原料的利用率或转化率。 对有害于我们的或我们不需要的化学反应,要设法降低反应的速率,或隔离会引起反应的物质。 对应用于特定环境下及特殊需要的化学反应,则需要对反应的条件进行特殊的控制。
现在,假设你是一名工程师,你要使到你工厂的煤尽可能的完全燃烧,提高煤的燃烧效率,你认为应该从哪些方面进行分析?
怎样提高煤的燃烧效率?
煤的状态与燃烧的速率有何关系?与煤的充分燃烧有何关系?空气的用量对煤的充分燃烧有什么影响?原因是什么?应选用什么样的炉膛材料?如何充分利用煤燃烧后的废气中的热量?
尽可能的使煤充分燃烧,提高能量的转化率,关键是燃料与空气或氧气要尽可能充分的接触,且空气要适当过量。燃料与空气要有足够大的接触面积。尽可能充分地利用燃料燃烧所放出来的热能,提高热能的利用率。实质是从多方面控制燃烧反应的条件,它的意义在于节约能源,节省资源,减少污染等。
1、可逆反应达到平衡的重要特征( ) A.反应停止了 B.正、逆反应速率都为零 C.反应物和生成物的浓度相等 D.正、逆反应的速率相等
2、对于可逆反应M+N Q达到平衡状态时,下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等B. M、N全部变成了QC. M、N、Q的浓度都保持不变D. 反应已经停止
3、下列说法可以证明反应N2+3H2 2NH3,已达平衡状态的是( )A.1mlN≡N键断裂的同时,有3mlH-H键形成B.1mlN≡N键断裂的同时,有3mlH-H键断裂C.1mlN≡N键断裂的同时,有6mlN-H键断裂D.1mlN≡N键断裂的同时,有6mlN-H键形成
4、14CO2 + C CO,达到化学平衡后,平衡混合物中含14C的粒子有 。
14CO2、14C、14CO
化学第三节 化学反应的速率和限度集体备课课件ppt: 这是一份化学第三节 化学反应的速率和限度集体备课课件ppt,共26页。PPT课件主要包含了化学反应速率,vNH3等内容,欢迎下载使用。
高中人教版 (新课标)第二章 化学反应与能量第三节 化学反应的速率和限度教学ppt课件: 这是一份高中人教版 (新课标)第二章 化学反应与能量第三节 化学反应的速率和限度教学ppt课件,共52页。PPT课件主要包含了化学反应与能量,第二章,正反应方向,逆反应方向,同一条件下,同时进行,不再改变,正反应速率,逆反应速率,着火点等内容,欢迎下载使用。
高中化学人教版 (新课标)必修2第二章 化学反应与能量第三节 化学反应的速率和限度说课ppt课件: 这是一份高中化学人教版 (新课标)必修2第二章 化学反应与能量第三节 化学反应的速率和限度说课ppt课件,共46页。













