






2021高考化学专题讲解 专题八 弱电解质的电离平衡和溶液的酸碱性(讲解部分)课件
展开考点一 弱电解质的电离平衡
基础知识一、强电解质和弱电解质1.定义在水溶液中能① 完全 电离的电解质称为强电解质。在水溶液中只能② 部分 电离的电解质称为弱电解质。2.常见物质强电解质:③ 强酸 、④ 强碱 、大多数盐等。弱电解质:⑤ 弱酸 、⑥ 弱碱 、少数盐、水等。
二、电离1.电离的条件:离子化合物在溶于水或熔融时发生电离,共价化合物在溶于 水时发生电离。2.电离方程式的书写
(1)强电解质的电离用“ ”,弱电解质的电离用“ ”。(2)多元弱酸分步电离,以第一步为主,如碳酸存在电离H2CO3 HC +H+(主),HC H++C (次)。多元弱碱的电离以一步电离表示,如Fe(OH)3 ⑦ Fe3++3OH- 。(3)强酸的酸式盐完全电离,弱酸的酸式盐中酸式酸根离子不完全电离。例 如:NaHSO4:NaHSO4 Na++H++S (水溶液中)NaHCO3:NaHCO3 Na++HC
说明在熔融状态时:NaHSO4 Na++HS
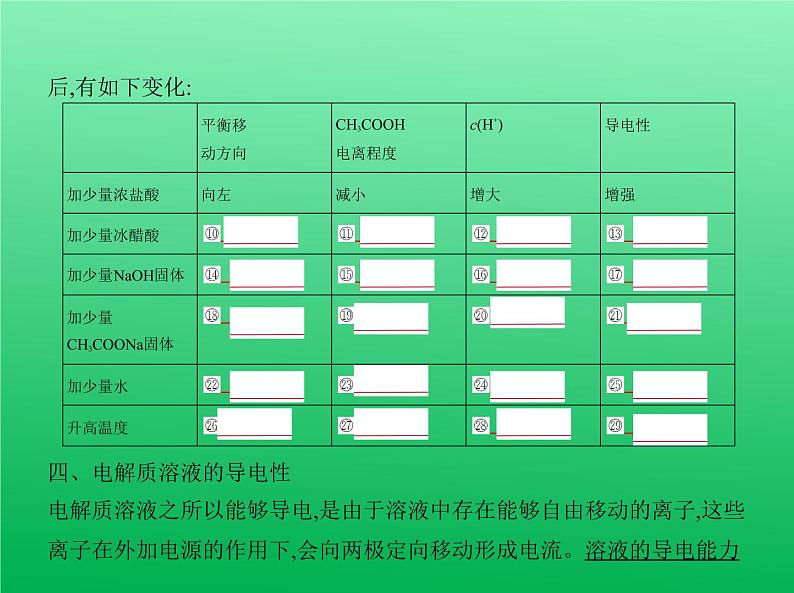
三、弱电解质的电离平衡1.在一定温度下,当弱电解质在水溶液中电离达到最大程度时,电离过程并 没有停止。此时弱电解质分子电离成离子的速率与离子结合成弱电解质 分子的速率相等,溶液中各分子和离子的浓度都不再发生变化,达到⑧ 电 离平衡 状态。弱电解质的电离平衡特点:(1)动态平衡,电离方程式中用“ ”;(2)平衡时溶液中离子浓度和分子浓度⑨ 保持不变 ;(3)条件改变,平衡发生移动。2.外界条件对电离平衡的影响如0.1 ml·L-1的醋酸溶液[CH3COOH H++CH3COO-(ΔH>0)],若改变条件
四、电解质溶液的导电性电解质溶液之所以能够导电,是由于溶液中存在能够自由移动的离子,这些 离子在外加电源的作用下,会向两极定向移动形成电流。溶液的导电能力
主要取决于溶液中离子的浓度和离子所带的电荷数,离子浓度越大,离子所 带的电荷越多,溶液的导电能力也就越强。五、电离平衡常数及其应用1.电离平衡常数弱电解质的电离是一个可逆过程,弱电解质溶液中除水分子外还存在弱电 解质分子。在一定条件下达到电离平衡时,弱电解质电离形成的各种离子 浓度幂的乘积与溶液中 未电离 的分子的浓度之比是一个常数,这个常数叫作电离平衡常数。通常用 Ka 表示弱酸的电离平衡常数,用 Kb 表示弱碱的电离平衡常数。如醋酸在水溶液中达到电离平衡时,醋酸的电离平衡常数:Ka= 。
2.电离平衡常数的意义根据电离平衡常数数值的大小,可以估算弱电解质电离的程度,K值越大,电 离程度越大。对于弱酸来讲,Ka越大,酸性越强;对于弱碱来讲,Kb越大,碱性 越强。相同条件下常见弱酸的酸性强弱顺序:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO。3.电离平衡常数的影响因素(1)电离平衡常数随温度变化而变化,但由于电离过程的热效应较小,温度 改变对电离平衡常数影响不大,其数量级一般不变,所以室温范围内可忽略 温度对电离平衡常数的影响。(2)电离平衡常数与弱酸、弱碱的浓度无关,同一温度下,不论弱酸、弱碱 的浓度如何变化,电离平衡常数是不会改变的。
考点二 水的电离 溶液的酸碱性
基础知识一、水的电离1.电离方程式水是一种极弱的电解质:H2O+H2O ① H3O++OH- 。简写为② H2O H++OH- 。2.纯水在室温下的常用数据(1)c(H+)=c(OH-)=③ 1.0×10-7 ml·L-1。(2)KW=c(H+)·c(OH-)=④ 1.0×10-14 。(3)pH=⑤z。
二、影响水的电离平衡的因素1.水的电离过程是⑥ 吸 热过程,升高温度能促进电离,所以降温时KW 减小,升温时KW增大。但不论温度升高或降低,纯水中c(H+)和c(OH-)始终相等。
2.向纯水中加入酸或碱,可以增大水中的H+或OH-浓度,均可使水的电离平 衡向⑦ 逆向 移动(即分子化的方向)。向水中加入可溶性的盐,若组成 盐的离子能与水电离产生的H+或OH-发生反应,生成难电离的物质,则能够 破坏水的电离平衡,使水的电离平衡向⑧ 电离方向 移动,可使水溶液 呈碱性或酸性;若所加的盐既不能与水中的H+或OH-发生反应,又不能电离 产生H+或OH-,则不能破坏水的电离平衡,不使水的电离平衡发生移动。若 向水中加入活泼金属,由于活泼金属与水电离出的H+反应,促进水的电离, 溶液中c(OH-)⑨ 增大 ,c(H+) 减小 。
三、溶液的酸碱性和pH1.溶液的酸碱性溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
(1)c(H+) > c(OH-),溶液呈酸性;(2)c(H+) = c(OH-),溶液呈中性;(3)c(H+) < c(OH-),溶液呈碱性。
四、pH的测定方法1.pH试纸的使用方法:把pH试纸放在洁净干燥的 表面皿 (或玻璃片)上,用玻璃棒蘸取待测液滴在pH试纸上,待变色后与 标准比色卡 对比,读出pH(整数)。
2.常用酸碱指示剂及其变色范围
五、酸碱中和滴定1.实验用品(1)主要仪器: 酸式 滴定管(如图A)、 碱式 滴定管(如图B)、滴定管夹、铁架台、锥形瓶。
(2)试剂:标准液、待测液、指示剂、蒸馏水。(3)滴定管的使用a.酸性、氧化性的试剂一般用 酸式 滴定管盛装,因为酸性和氧化性物质易腐蚀橡胶。b.碱性的试剂一般用 碱式 滴定管盛装,因为碱性物质易腐蚀玻璃,致使玻璃活塞无法打开。2.实验操作(以标准盐酸滴定待测NaOH溶液为例)(1)滴定前的准备a.滴定管: 查漏 →洗涤→ 润洗 →装液→调液面→记录。b.锥形瓶:注碱液→记读数→加指示剂(酚酞或甲基橙均可)。
(3)终点判断等到滴入最后一滴标准液,溶液变色,且半分钟内不恢复原来的颜色,视为 滴定终点,记录标准液的体积。
= 计算。4.中和滴定的误差分析以标准盐酸滴定NaOH溶液为例:V(HCl)·c(HCl)=V(NaOH)·c(NaOH)⇒c(NaOH)=
3.数据处理按上述操作重复两至三次,求出用去标准盐酸体积的平均值,根据c(NaOH)
核心精讲正确理解和运用水的离子积常数(KW)1.KW与温度有关,因为水的电离过程是吸热过程,所以温度升高,有利于水 的电离,KW增大。2.KW不仅适用于纯水,还适用于稀的电解质水溶液。不管哪种溶液均有c(H+ =c(OH- 。如酸溶液中:[c(H+)酸+c(H+ ]·c(OH- =KW;碱溶液中:[c(OH-)碱+c(OH- ]·c(H+ =KW。3.水的离子积常数揭示了在任何水溶液中均存在水的电离平衡,都有H+和 OH-,只是相对含量不同而已,并且在稀酸或稀碱溶液中,当温度为25 ℃时, KW=c(H+)·c(OH-)=1×10-14,仍为同一个常数。
4.在研究水溶液体系中离子的成分时,不要忽略H+和OH-共同存在。另外,通过对水的离子积的研究,知道水溶液的酸碱性是由c(H+)和c(OH-)的相对 大小决定的。
一、强、弱电解质的判断方法1.从是否完全电离的角度判断在溶液中强电解质完全电离,弱电解质部分电离。据此判断HA是强酸还 是弱酸的方法有:
强电解质不存在电离平衡,弱电解质存在电离平衡,在一定条件下电离平衡 会发生移动。据此判断HA是强酸还是弱酸的方法有:(1)从一定pH的HA溶液稀释前后pH的变化判断如将pH=3的HA溶液稀释至原体积的100倍后,再测其pH,若pH=5,则为强 酸;若pH<5,则为弱酸。(2)从升高温度后pH的变化判断若升高温度,溶液的pH明显减小,则是弱酸。因为弱酸存在电离平衡,升高 温度时,电离程度增大,c(H+)增大。而强酸不存在电离平衡,升高温度时,只 有水的电离程度增大,pH变化幅度小。
2.从是否存在电离平衡的角度判断
3.从酸根离子是否能发生水解的角度判断强酸的酸根离子不水解,弱酸的酸根离子易发生水解,据此可以判断HA是 强酸还是弱酸。可直接测定NaA溶液的pH:若pH=7,则HA是强酸;若pH>7,则HA是弱酸。
例1 (2019福建莆田调研,13)室温下,用相同物质的量浓度的 HCl溶液,分 别滴定物质的量浓度均为 0.1 ml/L 的三种碱溶液,滴定曲线如图所示。 下列判断正确的是 ( )
A.滴定前,三种碱溶液中水电离出的 c(H+)大小关系:DOH>BOH>AOHB.pH=7时,c(A+)=c(B+)=c(D+)C.滴定至p点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)D.当中和百分数达 100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)= c(H+)-c(OH-)
解题导引 起始时,pH:DOH>BOH>AOH,说明碱性:DOH>BOH>AOH。
解析 由图可知,起始时pH都小于13,说明三种碱均为弱碱,且碱性:AOH< BOH
=3.3。(3)两强碱溶液混合由c(OH-)混= 先求出混合后的 ,再通过KW求出c(H+)混,最后求pH。若两强碱溶液等体积混合,可采用速算方法:混合后溶液的 pH等于混合前溶液pH大的减0.3。如pH=9和pH=11的两种烧碱溶液等体 积混合后,pH=10.7。(4)强酸溶液与强碱溶液混合强酸溶液与强碱溶液混合的实质为中和反应,H++OH- H2O,中和后溶液的pH有以下三种情况:①若恰好中和,pH=7;②若剩余酸,先求中和后剩余的c(H+),再求pH;③若剩余碱,先求中和后剩余的c(OH-),再通过KW求出c(H+),最后求pH。
(5)已知酸溶液和碱溶液的pH之和,判断等体积混合后溶液的pH①若强酸与强碱溶液的pH之和等于14,则混合后溶液显中性,pH=7。②若强酸与强碱溶液的pH之和大于14,则混合后溶液显碱性,pH>7。③若强酸与强碱溶液的pH之和小于14,则混合后溶液显酸性,pH<7。④若酸、碱溶液的pH之和为14,酸、碱中有一强、一弱,则酸、碱溶液混 合后,谁弱显谁性。
例2 (2019湖南、湖北八市十二校一调,8)现有室温下四种溶液,有关叙述 不正确的是 ( )
A.相同体积的③、④两溶液分别与NaOH完全反应,消耗NaOH的物质的量:③>④B.分别加水稀释至原体积的10倍,四种溶液的pH:①>②>④>③C.①、④两溶液等体积混合,所得溶液中c(N )>c(Cl-)>c(OH-)>c(H+)D.Va L④与Vb L②混合(近似认为混合溶液体积=Va L+Vb L),若混合后溶液 pH=5,则Va∶Vb=9∶11
解题导引 弱酸、弱碱不完全电离,强酸、强碱完全电离。
解析 pH相同的盐酸与醋酸溶液,醋酸溶液浓度大于盐酸,故相同体积的 ③、④两种溶液与NaOH完全反应,消耗NaOH的物质的量③>④,A正确;同 样稀释至原体积的10倍,①的pH在9~10之间,②的pH=9,③的pH在4~5之间, ④的pH=5,则pH:①>②>④>③,B正确;①、④两溶液等体积混合后,氨水过 量,溶液显碱性,c(N )>c(Cl-)>c(OH-)>c(H+),C正确;由题意可列式: =10-5,解得Va∶Vb=11∶9,D不正确。
滴定操作不仅适用于酸碱中和反应,也可迁移应用于氧化还原反应进行物 质含量的测定,计算方法主要是“关系式”法。
例 (2019广东佛山一模,27)钛白粉(TiO2)广泛应用于涂料、化妆品、食品 以及医药等行业。利用黑钛矿石[主要成分为(Mg0.5Fe0.5)Ti2O5,含有少量Al2Ca(SiO4)2]制备TiO2,工艺流程如下。已知:TiOSO4易溶于水,在热水中易水 解生成H2TiO3。回答下列问题: (1)(Mg0.5Fe0.5)Ti2O5中钛元素的化合价为 ,“焙烧”所需的容器名 称是 ,“滤渣”的主要成分是 (填化学式)。(2)制取H2TiO3的化学方程式为 。(3)矿石粒度对TiO2的提取率影响如图,原因是 。
(4)相关的金属难溶化合物在不同pH下的溶解度(S,ml·L-1)如图所示,步骤 ④应该控制的pH范围是 (填标号)。
A.1~2 B.2~3 C.5~6 D.10~11(5)常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定钛白粉的纯度,其步骤为:用足量 酸溶解a g二氧化钛样品,用铝粉作还原剂,过滤、洗涤,将滤液定容为100 mL,取20.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反 应原理为Ti3++Fe3+ Ti4++Fe2+。①滴定终点的现象为 。
②滴定终点时消耗b ml·L-1 NH4Fe(SO4)2溶液V mL,则TiO2纯度为 (写表达式)。
解析 (1)(Mg0.5Fe0.5)Ti2O5中Fe化合价为+2,设Ti的化合价为x,则有(+2)×0.5 +(+2)×0.5+2x+(-2)×5=0,解得x=+4;“焙烧”所需的温度高,一般选用坩埚; 结合元素守恒可知滤渣为CaSO4、CaSiO3。(2)TiOSO4在热水中易水解,根 据水解规律可知TiOSO4水解生成H2TiO3和H2SO4,方程式为TiOSO4+2H2O H2TiO3↓+H2SO4。(3)由题图可知,矿石颗粒越小,反应速率越快,TiO2提取率越高。(4)H2TiO3沉淀完全的pH约为2,Al3+、Fe2+、Mg2+等开始沉淀 的pH大于3,所以应该控制的pH范围是2
2021高考化学专题讲解 专题二 物质的量(讲解部分)课件: 这是一份2021高考化学专题讲解 专题二 物质的量(讲解部分)课件,共30页。
2021高考化学专题讲解 专题十八 化学常用仪器和实验基本操作(讲解部分)课件: 这是一份2021高考化学专题讲解 专题十八 化学常用仪器和实验基本操作(讲解部分)课件,共51页。
2021高考化学专题讲解 专题十五 烃及其衍生物的结构和性质(讲解部分)课件: 这是一份2021高考化学专题讲解 专题十五 烃及其衍生物的结构和性质(讲解部分)课件,共51页。












