




2021高考化学专题讲解 专题十五 烃及其衍生物的结构和性质(讲解部分)课件
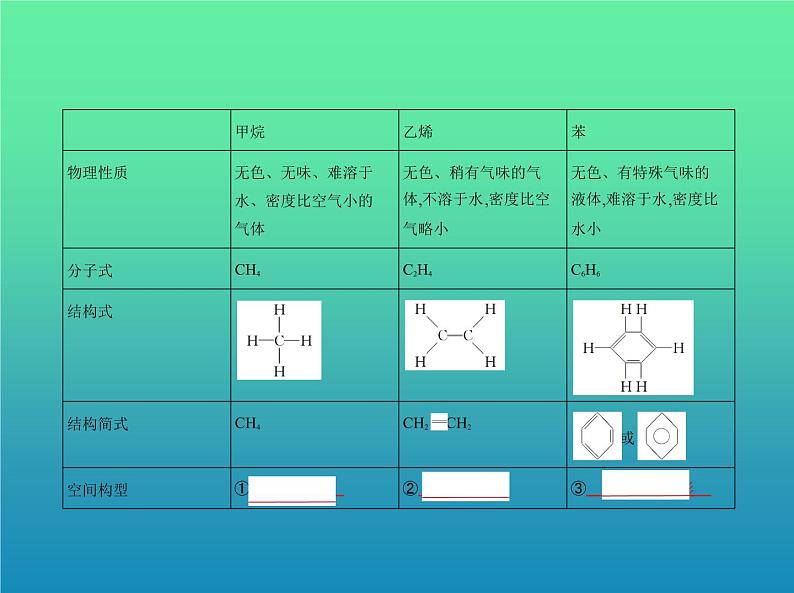
展开基础知识一、烃1.甲烷、乙烯、苯的物理性质与结构比较
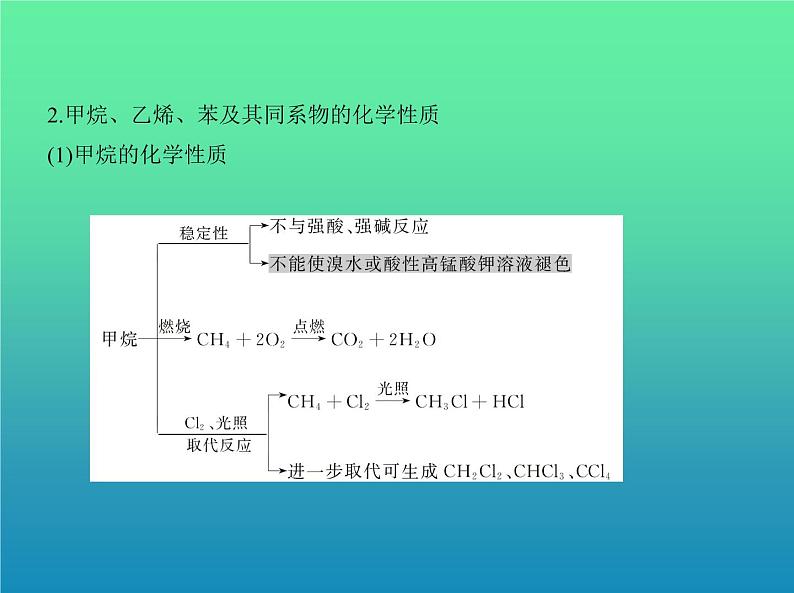
2.甲烷、乙烯、苯及其同系物的化学性质(1)甲烷的化学性质
(4)苯的同系物及结构上的相互影响分子中含有苯环的烃叫芳香烃,分子中只有一个苯环,苯环上的侧链全为烷 烃基的烃是苯的同系物,其通式为CnH2n-6(n≥7)。苯的同系物中,由于侧链对苯环的影响,使苯环侧链所在碳原子邻、对位碳
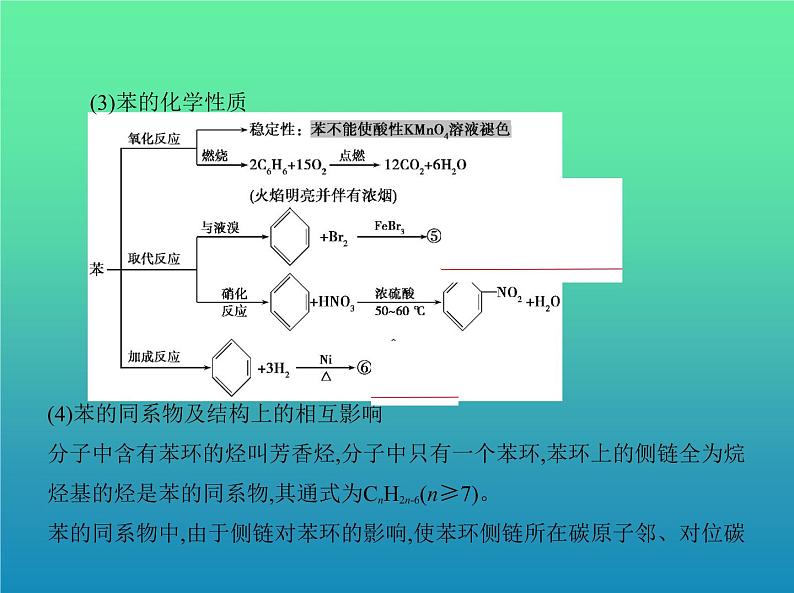
(3)苯的化学性质
原子上的氢原子活化,如甲苯与浓硝酸反应时,生成2,4,6-三硝基甲苯。在 苯的同系物中,由于苯环对侧链的影响,苯的同系物能被酸性KMnO4溶液 氧化,从而使酸性KMnO4溶液褪色。二、卤代烃1.卤代烃的概念(1)卤代烃是烃分子里的氢原子被卤素原子取代后生成的化合物。通式可 表示为R—X(其中R—表示烃基)。(2)官能团是卤素原子。2.卤代烃的物理性质(1)沸点:比同碳原子数的烃沸点要高;(2)溶解性:水中难溶,有机溶剂中易溶;(3)密度:一般一氟代烃、一氯代烃比水小,其余比水大。
3.卤代烃水解反应和消去反应比较
核心精讲1.烷烃、烯烃、炔烃的组成、结构特点和通式
3.脂肪烃的化学性质比较
4.苯的同系物的同分异构体(以C8H10芳香烃为例)
5.两类卤代烃不能发生消去反应
6.卤代烃中与卤素原子相连的碳原子有两种或三种邻位碳原子,且邻 位碳原子上均带有氢原子时,发生消去反应可生成不同的产物。例如: CH2 CH—CH2—CH3(或CH3—CH CH—CH3)+NaCl+H2O7. 型卤代烃,发生消去反应可以生成 。
例如:BrCH2CH2Br+2NaOH
基础知识一、醇、酚的概念1.醇是羟基与烃基或苯环侧链上的碳原子相连的化合物,饱和一元醇的分 子通式为Cn OH(n≥1)。2.酚是羟基与苯环直接相连而形成的化合物,最简单的酚为苯酚 ( )。
二、乙醇的结构和性质1.乙醇的分子组成和结构分子式为C2H6O,结构式为 ,结构简式为① CH3CH2OH ,官能团为② —OH 。2.乙醇的物理性质乙醇俗称酒精,是一种无色且具有特殊香味的液体,密度比水小,沸点低,具 有挥发性,能与水以任意比互溶。体积分数为75%的乙醇溶液可作医用酒 精。无水乙醇的制备方法:加入新制的③ 生石灰 ,蒸馏制无水乙醇。检验酒精中是否含有水的方法:加入④ 无水CuSO4 ,若变蓝,说明酒精中
含水;否则,不含水。3.乙醇的化学性质(1)与活泼金属反应乙醇跟活泼金属钠反应的化学方程式为2CH3CH2OH+2Na 2CH3CH2ONa+H2↑。(2)氧化反应a.燃烧:乙醇在足量O2中完全燃烧的化学方程式为CH3CH2OH+3O2 2CO2+3H2O。b.催化氧化:乙醇在加热和铜(或银)的催化作用下,能被氧气氧化成乙醛,化 学方程式为⑤ 2CH3CH2OH+O2 2CH3CHO+2H2O 。
将乙醇、浓H2SO4在170 ℃下共热,乙醇分子内脱水生成乙烯,化学方程式 为CH3CH2OH +H2O。 (4)取代反应C2H5OH+HBr C2H5Br+H2OCH3CH2OH+HOCH2CH3 +H2O三、苯酚的结构和性质1.苯酚的物理性质(1)纯净的苯酚是⑥ 无色 晶体,有⑦ 特殊 气味,易被空气氧化呈⑧ 粉红色 。(2)苯酚常温下在水中的溶解度不大,当温度高于⑨ 65 ℃ 时,能与水混 溶,苯酚易溶于酒精。
(3)苯酚有毒,对皮肤有强烈的腐蚀作用,如果不慎沾到皮肤上应立即用⑩ 酒精 洗涤。2.由基团之间的相互影响理解酚的化学性质由于苯环对羟基的影响,酚羟基比醇羟基活泼;由于羟基对苯环的影响,苯 酚中苯环上的氢比苯中的氢活泼。(1)弱酸性苯酚电离方程式为C6H5OH C6H5O-+H+,俗称石炭酸,但酸性很弱,不能使石蕊溶液变红。苯酚与NaOH反应的化学方程式: +NaOH +H2O
(2)苯环上氢原子的取代反应苯酚与饱和溴水反应,产生白色沉淀,反应的化学方程式: +3Br2 ↓+3HBr(3)显色反应苯酚跟FeCl3溶液作用显紫色,利用这一反应可检验苯酚的存在。
核心精讲醇的反应规律1.醇的催化氧化规律醇在一定条件下(Cu或Ag作催化剂,加热),可发生去氢氧化。(1)反应机理 (2)醇的催化氧化(或去氢氧化)形成碳氧双键的条件连有羟基(—OH)的碳原子上必须有氢原子,否则该醇不能被催化氧化。
2.醇的消去反应规律(1)醇发生消去反应的原理 +H2O (2)醇发生消去反应的条件在有浓H2SO4存在且加热条件下,与羟基相连的碳原子的邻位碳原子上有 氢原子,才可能发生消去反应形成不饱和键。当与羟基相连的碳原子无邻位碳原子或与羟基相连的碳原子的邻位碳原 子上无氢原子时,醇不能发生消去反应。
基础知识一、醛1.醛的结构和性质 (1)醛:由烃基或氢原子与醛基相连而构成的化合物,可表示为RCHO。甲 醛是最简单的醛。饱和一元醛分子的通式为CnH2nO(n≥1)。(2)甲醛、乙醛
2.醛的化学性质醛类物质既有氧化性又有还原性,其氧化、还原关系为
醇 醛 羧酸以乙醛为例写出醛类发生反应的主要化学方程式:(1)氧化反应A.银镜反应③ CH3CHO+2Ag(NH3)2OH CH3COONH4+2Ag↓+3NH3+H2O B.与新制Cu(OH)2悬浊液的反应④ CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O (2)还原反应(催化加氢)⑤ CH3CHO+H2 CH3CH2OH
特别提示 (1)醛基只能写成—CHO或 ,不能写成—COH。(2)醛与新制的Cu(OH)2悬浊液反应时碱必须过量且应加热煮沸。(3)银镜反应口诀:银镜反应很简单,生成羧酸铵,还有一水二银三个氨。二、羧酸(1)羧酸:由烃基或氢原子与羧基相连构成的有机化合物。官能团为⑥ — COOH 。饱和一元羧酸分子的通式为⑦ CnH2nO2(n≥1) 。(2)甲酸和乙酸的分子组成和结构
(3)羧酸的化学性质a.酸的通性乙酸是一种弱酸,其酸性比碳酸强,在水溶液中的电离方程式为CH3COOH CH3COO-+H+。b.酯化反应CH3COOH和CH3C OH发生酯化反应的化学方程式为⑨ CH3COOH+C2 OH CH3CO18OC2H5+H2O 。三、酯(1)酯:羧酸分子羧基中的—OH被—OR'取代后的产物。可简写为⑩ RCOOR' ,官能团为 。
(2)酯的物理性质 (3)酯的化学性质
特别提示 酯的水解反应为取代反应;在酸性条件下为可逆反应;在碱性 条件下,能中和产生的羧酸,反应能完全进行。
核心精讲一、乙酸和乙醇的酯化反应实验探究1.原理CH3COOH+CH3CH2OH CH3COOC2H5+H2O2.装置
3.反应的特点(1)通常反应速率很慢。(2)反应是可逆的,即反应生成的乙酸乙酯在同样的条件下又部分发生水解 反应生成乙酸和乙醇。4.反应的条件及其意义(1)加热。加热的主要目的是提高反应速率,其次是使生成的乙酸乙酯挥发 而被收集,使平衡向正反应方向移动,提高乙醇、乙酸的转化率。(2)用浓硫酸作催化剂,提高反应速率。(3)用浓硫酸作吸水剂,提高乙醇、乙酸的转化率。5.实验室里制取乙酸乙酯时的注意事项(1)化学药品加入大试管时,不能先加浓硫酸。(2)加热要小心均匀地进行,以防乙酸、乙醇大量挥发,液体暴沸。(3)导气管不能伸入饱和Na2CO3溶液内,以防倒吸。
6.实验室里制乙酸乙酯时用饱和碳酸钠溶液吸收乙酸乙酯的主要优点(1)挥发出来的乙酸与碳酸钠反应生成易溶于水的盐,乙醇易溶于碳酸钠溶 液,利于乙酸乙酯与乙酸、乙醇的分离。(2)乙酸乙酯在无机盐溶液中溶解度较小,易于分层。7.反应的规律有机酸与醇发生酯化反应时,酸脱羟基醇脱氢。二、酯化反应的五大类型(1)一元羧酸与一元醇之间的酯化反应,如CH3COOH+HOC2H5 CH3COOC2H5+H2O(2)一元羧酸与多元醇之间的酯化反应,如2CH3COOH+ +2H2O
(3)多元羧酸与一元醇之间的酯化反应,如 +2CH3CH2OH +2H2O(4)多元羧酸与多元醇之间的酯化反应:此时反应有三种情形,可得普通 酯、环酯和高聚酯。如 + HOOC—COOCH2CH2OH+H2O + +2H2OnHOOC—COOH+nHOCH2CH2OH
高聚酯。如 +H2O +2H2O OH+(n-1)H2O
(5)羟基酸自身的酯化反应:此时反应有三种情形,可得到普通酯、环酯和
有机推断题的解题突破口(1)根据反应中的特殊条件进行推断①NaOH的水溶液——卤代烃、酯类的水解反应。②NaOH的醇溶液,加热——卤代烃的消去反应。③浓硫酸,加热——醇消去、酯化、苯环的硝化等反应。④溴水或溴的CCl4溶液——烯烃、炔烃的加成反应。⑤O2、Cu,加热——醇的催化氧化反应。⑥新制的Cu(OH)2悬浊液,加热(或银氨溶液,水浴加热)——醛氧化成羧酸 的反应。⑦稀硫酸——酯的水解等反应。
⑧H2,催化剂——烯烃、炔烃的加成,芳香烃的加成,醛还原成醇的反应。⑨光照——烷基上的氢原子被卤素原子取代。⑩Fe或FeX3(X为卤素原子)——苯环上的氢原子被卤素原子取代。(2)根据有机物的性质推断官能团有机物的官能团往往具有一些特征反应和特殊的化学性质,这些都是有机 物结构推断的突破口。①能使溴的四氯化碳溶液褪色的物质可能含有“ ”“ ”或是酚类物质。②能使酸性KMnO4溶液褪色的物质可能含有“ ”“ ”“—CHO”或是酚类、苯的同系物等。③能发生银镜反应或与新制Cu(OH)2悬浊液反应生成红色沉淀的物质一定
含有—CHO。④能与Na反应放出H2的物质可能为醇、酚、羧酸等。⑤能与Na2CO3溶液作用放出CO2或使石蕊试液变红的有机物中含有—COOH。⑥能水解的有机物中可能含有酯基( )、肽键( )或是卤代烃。⑦能发生消去反应的可能是醇或卤代烃等。(3)根据性质和有关数据推知官能团的数目①—CHO ②2—OH(醇、酚、羧酸) H2
③2—COOH CO2,—COOH CO2④ (4)根据某些产物推知官能团的位置①由醇氧化成醛(或羧酸),—OH一定在链端;由醇氧化成酮,—OH一定在链 中;若该醇不能被催化氧化,则与—OH相连的碳原子上无氢原子。②由消去反应的产物可确定“—OH”或“—X”的位置。③由取代产物的种类可确定碳链结构。④由加氢后碳架结构确定 或 的位置。
例 (2019湖北1月联考,36)芳纶可以制成防弹衣、防弹头盔、防弹装甲 等,对位芳纶纤维J(聚对苯二甲酰对苯二胺)是重要的国防军工材料。化合 物A、乙烯、苯制备J的一种合成路线如下: J回答下列问题:(1)A的化学名称为 。(2)A→B的反应类型是 。
(3)实验室由苯制备F所需试剂、条件分别为 。(4)G中官能团的名称是 。(5)E与I反应生成J的化学方程式为 。(6)写出只含酯基的D的同分异构体的结构简式(核磁共振氢谱为四组峰,峰 面积比为2∶2∶1∶1): 。(7)参照上述合成路线,以1,3-戊二烯和丙烯为原料(无机试剂任选),设计制 备邻苯二甲酸的合成路线。
解题导引 有机合成题的解题思路
解析 (1)A的结构简式为CH3CH CHCH CHCH3,其名称为2,4-己二烯。(2)A为共轭二烯,与乙烯发生1,4-加成反应形成六元环,所以A→B的反 应是加成反应。(4)G中所含官能团为氨基。(5)由题意知J是聚对苯二甲酰 对苯二胺,属于高分子化合物,由E和I发生缩聚反应生成。(6)D的分子式为 C8H6O4,不饱和度为6,其同分异构体含2个酯基和一个苯环,4种等效氢原子 的个数比为2∶2∶1∶1,可推测含2个甲酸酯基(—OOCH)且处于间位,结构 简式为 。
答案 (1)2,4-己二烯(2)加成反应(3)浓硝酸/浓硫酸、加热(4)氨基(5)n +n (2n-1)HCl+ (6)
(7)
结构(官能团)决定性质,性质决定用途。以陌生有机物的结构为载体,通过 官能团探究物质的结构,预测、描述和解释有机物的性质。
例 (2019湖南师大附中月考,12)头孢羟氨苄(如图所示)被人体吸收的效 果良好,疗效明显,且毒性反应极小,因而广泛应用于敏感细菌所致的多种 疾病的治疗。已知酰胺键( )可以在碱性条件下水解。下列对头孢羟氨苄的说法正确的是 ( )
A.头孢羟氨苄的分子式为C16H14N3O5S·H2OB.1 ml头孢羟氨苄分别与NaOH溶液和浓溴水反应时,需消耗4 ml NaOH和3 ml Br2C.在催化剂存在的条件下,1 ml头孢羟氨苄可与7 ml H2发生反应D.头孢羟氨苄能在空气中稳定存在
解析 A项,头孢羟氨苄的分子式为C16H17N3O5S·H2O,故A错误;B项,(酚)羟 基、酰胺键、羧基均可以与NaOH溶液反应,1 ml头孢羟氨苄消耗4 ml NaOH,1 ml头孢羟氨苄与浓溴水反应消耗3 ml Br2,故B正确;C项,苯环、 碳碳双键可以与氢气反应,消耗H2 4 ml,酰胺键、羧基不能与氢气反应,故 C错误;D项,头孢羟氨苄分子中含有酚羟基,易被空气中的氧气氧化,故D错 误。
山东专用高考化学一轮复习专题十六烃及其衍生物的结构和性质_应用篇课件: 这是一份山东专用高考化学一轮复习专题十六烃及其衍生物的结构和性质_应用篇课件,共7页。PPT课件主要包含了实践探究等内容,欢迎下载使用。
山东专用高考化学一轮复习专题十六烃及其衍生物的结构和性质_基础篇课件: 这是一份山东专用高考化学一轮复习专题十六烃及其衍生物的结构和性质_基础篇课件,共45页。
2021高考化学专题讲解 专题十四 有机物的分类、组成和结构(讲解部分)课件: 这是一份2021高考化学专题讲解 专题十四 有机物的分类、组成和结构(讲解部分)课件,共34页。PPT课件主要包含了②核磁共振氢谱等内容,欢迎下载使用。












