




人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动2 强酸与强域的中和滴定示范课课件ppt
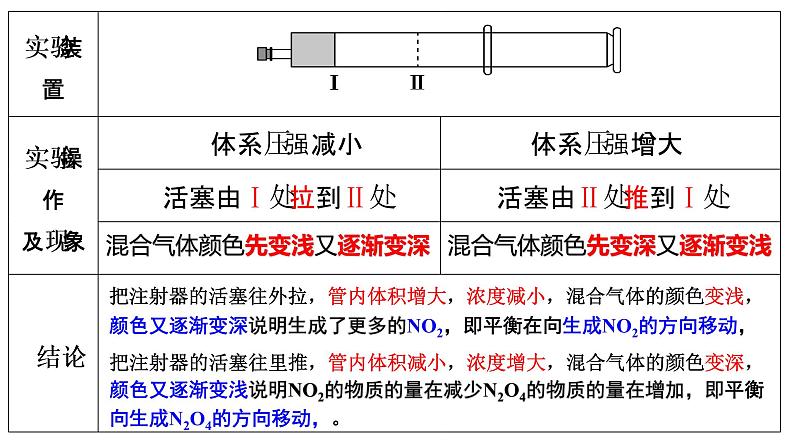
展开【实验2-2】如图所示,用50 mL注射器吸入约20 mL NO2与N2O4的混合气体(使注射器的活塞处于Ⅰ处),将细管端用橡胶塞封闭。然后把活塞拉到Ⅱ处,观察管内混合气体颜色变化。当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化。
2.压强对化学平衡的影响
2NO2(气)⇌N2O4(气)
把注射器的活塞往里推,管内体积减小,浓度增大,混合气体的颜色变深,颜色又逐渐变浅说明NO2的物质的量在减少N2O4的物质的量在增加,即平衡向生成N2O4的方向移动,。
把注射器的活塞往外拉,管内体积增大,浓度减小,混合气体的颜色变浅,颜色又逐渐变深说明生成了更多的NO2,即平衡在向生成NO2的方向移动,
混合气体颜色先变浅又逐渐变深
混合气体颜色先变深又逐渐变浅
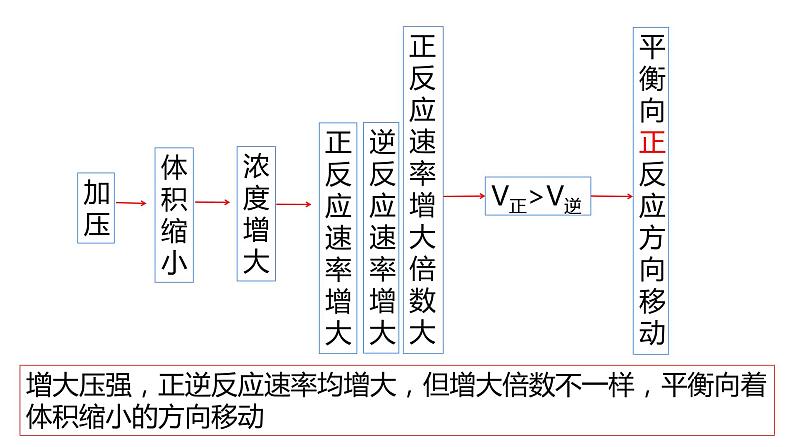
增大压强,正逆反应速率均增大,但增大倍数不一样,平衡向着体积缩小的方向移动
正 反应速率增大
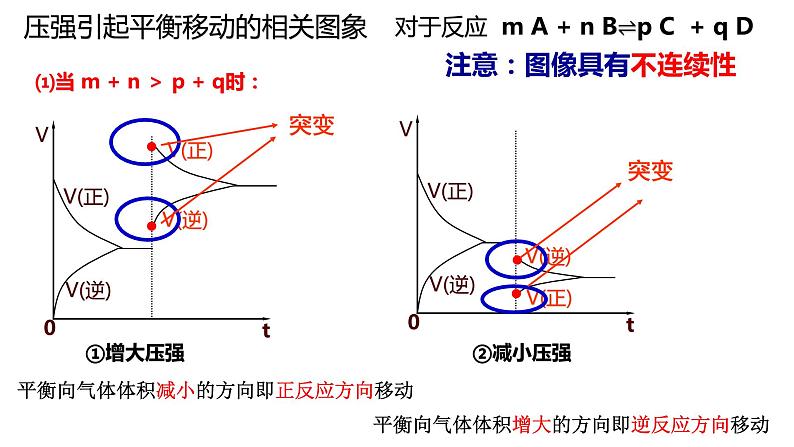
压强引起平衡移动的相关图象
对于反应 m A + n B⇌p C + q D
⑴当 m + n > p + q时:
平衡向气体体积减小的方向即正反应方向移动
平衡向气体体积增大的方向即逆反应方向移动
注意:图像具有不连续性
⑵当 m + n < p + q 时:
平衡向气体体积减小的方向即逆反应方向移动
平衡向气体体积增大的方向即正反应方向移动
[注意] 对于反应前后气体总体积相等的反应,改变压强对平衡无影响
例:对如下平衡 A(气) + B (气) 2C (气) + D (固)
增大(减小)压强,正逆反应速率均增大(减小),而且增大(减小)倍数一样, ,平衡不移动。
a+b>c 加压
(以aA(g)+bB(气) cC(气)为例)
a+b>c 减压
a+b
a+b=c 减压
①适用对象:有气体参加的可逆反应。②影响规律当其他条件不变时:a.若为体积不等的反应增大压强(减小容器的容积) ,平衡向气体体积减小的方向移动;减小压强(增大容器的容积),平衡向气体体积增大的方向移动。
b.若为等体积反应增大压强时,v正、v逆同等程度地增大;减小压强时,v正、v逆同等程度地减小,平衡均不发生移动。
体积缩小:即气体化学计量数减少体积增大:即气体化学计量数增多
说明:增大压强,正逆反应速率均增大,但增大倍数不一样,平衡向着体积缩小的方向移动
→ 正反应速率增大 逆反应速率增大
→平衡向正反应方向移动。
①对于反应前后气体总体积相等的反应,改变压强对平衡无影响;②平衡混合物都是固体或液体的,改变压强不能使平衡移动;③压强的变化必须改变混合物浓度(即容器体积有变化)才能使平衡移动。④恒容时,通入稀有气体,压强增大,平衡不移动;恒压时,通入稀有气体,体积增大,平衡向气体体积增大的方向移动。⑤在恒容容器中,改变其中一种气态物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析。⑥同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。⑦溶液稀释或浓缩与气体减压或增压的化学平衡移动规律相似
1.有气体参加的反应,增大体系的压强后,平衡一定会移动吗?2.反应A(g)+B(g)=C(g)达到平衡后,增加A的量使平衡向正反应方向移动,A、B的转化率如何改变?
答案:反应前后气体体积未发生改变的可逆反应,改变压强后平衡不会移动,如H2+I2 2HI。
答案:A的转化率降低,B的转化率升高。
(1)化学平衡发生移动时,化学反应速率一定改变;化学反应速率改变时,化学平衡也一定发生移动。 ( )(2)平衡时,其他条件不变,分离出固体生成物,v(正)减小。 ( )(3)往平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅。 ( )(4)对于2NO2(g) N2O4(g)的平衡体系,压缩容器体积,增大压强,平衡正向移动,混合气体的颜色变浅。 ( )(5)改变压强后,平衡一定发生移动。 ( )(6)改变外界条件使平衡正向移动的原因是v(正)增大,v(逆)减小。 ( )
1.判断正误(正确的打“√”,错误的打“×”)
2、两个体积相同的密闭容器A、B,在A中充入SO2和O2各1 ml,在B中充入SO2和O2各2 ml,加热到相同温度,有如下反应2SO2(g)+O2(g) 2SO3(g),对此反应下述不正确的是( )A.反应速率B>A B.SO2 的转化率B>AC.平衡时各组分含量B=A D.平衡时容器的压强B>A
解析: A项,两容器的体积相同,B中SO2、O2物质的量浓度都是A中的两倍,在相同条件下反应物浓度越大反应速率越快,反应速率B>A,正确;要将A、B两容器平衡时的物理量进行比较,可建立如下模型:(1)另取一个2倍体积的容器,充入SO2、O2各2 ml,则在相同条件下,该容器达平衡时SO2的转化率、平衡时各组分含量、平衡时的压强与A中对应相等;(2)B相当于在该容器的基础上将体积缩小为一半,即增大压强,平衡正向移动。B项,增大压强平衡正向移动,反应物的转化率增大,SO2的转化率B>A,正确;C项,由于平衡正向移动,SO3的含量:B>A,SO2、O2的含量:A>B,错误;D项,平衡时B中的压强pA
解析: A项,该反应为反应前后气体物质的量不变的反应,平衡不受压强影响,减小容器体积,平衡不移动,X的转化率不变,正确;B项,增大c(X),平衡正向移动,Y的转化率增大,X的转化率减小,正确;C项,相当于只增加Y的浓度,X的转化率会增大,正确;D项,催化剂不能使平衡移动,不改变产物的产率,错误。
A.反应向逆反应方向移动 B.Y可能是固体或液体C.系数n>m D.Z的体积分数减小
解析:反应已达平衡,此时c(X)=0.3 ml·L-1,其他条件不变,将容器缩小到原来的 ,若此时平衡不移动,c(X)=0.6 ml·L-1,但平衡移动之后c(X)=0.5 ml·L-1,说明加压使平衡向正反应方向移动,正反应为气体体积减小的反应,若Y为固体或液体,则需要满足m>2m,A、B项错误;Y应是气体,则m+n>2m,所以n>m,C项正确;平衡正向移动,产物Z的体积分数应该增大,D项错误。
5.一定量混合气体在密闭容器中发生如下反应: xA(g)+yB(g) nC(g),达到平衡后,测得A气体的浓度为0.5 ml·L-1,保持温度不变将容器的容积扩大1倍,再达平衡时,测得A气体的浓度为0.3 ml·L-1,则下列叙述中正确的是( )A.x+y
6.可以作为判断化学平衡发生移动的标志的是( )A.反应混合物中各组分的浓度发生改变B.正、逆反应速率发生改变C.反应物的转化率发生改变D.体系的压强发生改变
解析:对于反应H2(g)+I2(g) 2HI(g),压缩体积增大压强,混合物中各组分的浓度发生改变,正、逆反应速率发生改变,但平衡不发生移动。反应物的转化率发生改变,平衡一定移动。
7.对于密闭容器中的可逆反应mX(g)+nY(s) pZ(g) ΔH<0,达化学平衡后,改变条件,下列说法不正确的是 ( )A.增大压强,化学平衡不一定发生移动B.通入氦气,化学平衡不一定发生移动C.增加X或Y的物质的量,化学平衡一定发生移动D.其他条件不变,升高温度,化学平衡一定发生移动
解析:由于Y为固体,改变其用量不影响化学平衡,C项不正确;D项,该反应的正反应是放热反应,升高温度,化学平衡向逆反应方向移动。
8.在密闭容器中,反应xA(g)+yB(g) zC(g),在一定条件下达到平衡状态,试回答下列问题。(1)若x+y>z,缩小体积,增大压强,则平衡向 方向移动。 (2)若保持体积不变,通入He,则平衡 移动。 (3)若保持压强不变,通入He,平衡向正反应方向移动,则x、y、z的关系为 。 (4)若x+y=z,缩小体积,增大压强,则平衡 移动。
解析:一看化学计量数之间的关系:是等体积反应还是非等体积反应。二看平衡建立的条件:是恒温恒容还是恒温恒压。然后根据平衡移动原理进行分析。
人教版 (2019)选择性必修1第二节 化学平衡课文内容课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡课文内容课件ppt,共59页。
人教版 (2019)选择性必修1第二节 化学平衡优秀ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡优秀ppt课件,共26页。PPT课件主要包含了学习目标,一化学平衡的移动等内容,欢迎下载使用。
化学选择性必修1第二节 化学平衡教学ppt课件: 这是一份化学选择性必修1第二节 化学平衡教学ppt课件,文件包含选择性必修1第二章第二节第3课时影响化学平衡的因素-教学课件pptx、选择性必修1第二章第二节第3课时影响化学平衡的因素-学案doc、选择性必修1第二章第二节第3课时影响化学平衡的因素-教学设计1docx、选择性必修1第二章第二节第3课时影响化学平衡的因素-作业设计docx等4份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













