





化学必修 第二册第三节 环境保护与绿色化学完美版课件ppt
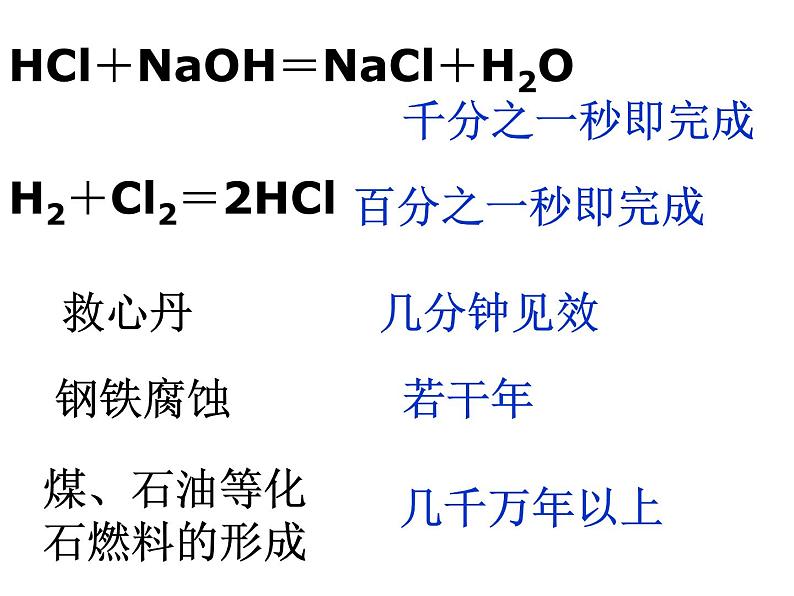
展开HCl+NaOH=NaCl+H2O
H2+Cl2=2HCl
煤、石油等化石燃料的形成
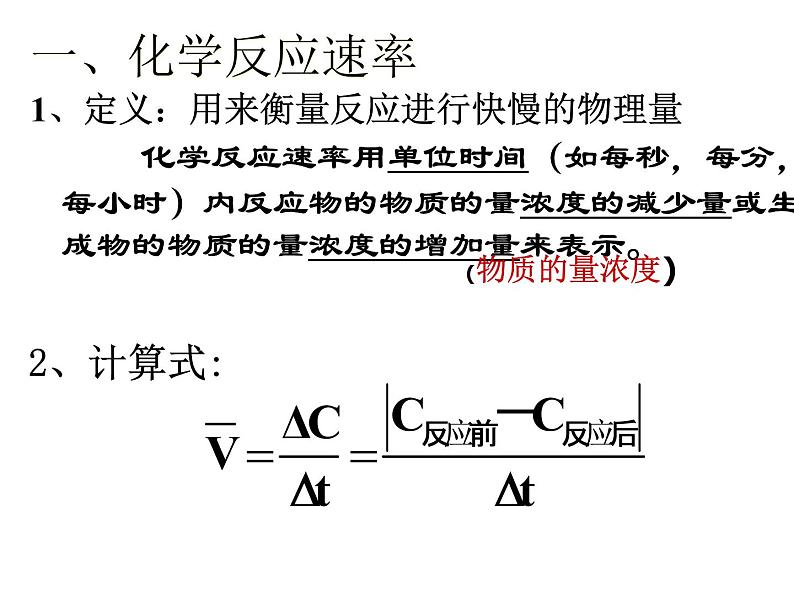
1、定义:用来衡量反应进行快慢的物理量
化学反应速率用单位时间(如每秒,每分,每小时)内反应物的物质的量浓度的减少量或生成物的物质的量浓度的增加量来表示。
= 0.3ml/(L·s)
问题1: v(N2)= v(H2)=
问题2:此反应化学反应速率用不同物质表示为什么数值不同?数值上有何规律?
3、化学反应速率的特点—
①同一反应,可用不同物质在单位时间 内浓度的变化来表示,但必须指明是 用哪种反应物或哪种生成物来表示。②用不同物质在单位时间内浓度变化表 示时,数值不同,但意义相同。速率比等于方程式中的系数比③均取正值,且是某一段时间内的平均速率。④不能用固体或纯液体的浓度变化来表示速率⑤浓度指物质的量浓度,单ml/(L·s)ml/(L·min)
2、向一个容积为1L的密闭容器中放入2mLSO2和1mLO2,在一定条件下反应,2S末,测得容器内有0.8mLSO2,求2S内SO2,O2,SO3的反应速率和反应速率比.
在一定条件下,mA+nB=pC的反应中,各物质的化学反应速率为V(A)=aml·L-1·s-1, V(B)=a/2ml·L-1·s-1, V(C)=aml·L-1·s-1, 则该反应的化学方程式是 。
则该反应速率的快慢顺序为:
反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)ν(A)=0.3ml/(L·s )
(2) ν(B)=0.6ml/(L·s)
(3) ν(C)=0.4ml/(L·s)
(4) ν(D)=0.45ml/(L·s)
(1)>(4)>(2)=(3)
⑥反思:比较反应的快慢,应取同一参照物
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1ml/L 盐酸反应时,速率最快的是 A 镁 B 铝 C 钠 D 铁
二、影响化学反应速率的因素
§(一)化学反应速率是由反应物的性质决定的; 内因是主要因素
溶液中产生气泡速率很快
升高温度,反应速率增大
降低温度,反应速率减小
规律:当其它条件不变时,升高温度,化学反应速率增大。降低温度,化学反应速率减小。实验测得,温度每升高10度,化学反应速率通常增大原来的2~4倍。注意:温度对反应速率的影响不受反应物状态的限制。对于可逆反应,改变温度正逆反应速率都变。吸热一方变化大
(1)温度对化学反应速率的影响
MnO2能加快反应速率
FeCl3能加快反应速率
规律:催化剂能改变化学反应的速率。①有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。②催化剂中毒:催化剂的催化性能往往因接触少量的杂质而明显下降甚至遭破坏,这种现象叫催化剂中毒。③催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。④催化剂对于可逆反应能同等程度改变正逆反应速率
(2)催化剂对化学反应速率的影响
规律:①当其它条件不变时,增大反应物的浓度,化学反应速率增大。减小反应物的浓度,化学反应速率减慢。②改变固体或纯液体用量对速率无影响③对于可逆反应增大反应物或生物的浓度,化学方应速率都增大
(3)浓度对化学反应速率的影响
规律:当其它条件不变时,增大固体反应物的表面积,化学反应速率增大。减小固体反应物的表面积,化学反应速率减慢。
(4)固体反应物的表面积对化学反应速率的 影响
(5) 压强的影响: 对于有气体参加的化学反应,增大压强一般可以减小气体的体积,从而使反应物的浓度增大,因此,也可以增大反应速率。
(三)、有关化学反应速率的计算
例1、反应N2+3H2=2NH3在2L的密闭容器中发生反应,5min内NH3的质量增加了1.7g 求ν(NH3)、 ν(N2)、 ν(H2)。
各物质的速率之比等于方程式计量数之比
据系数比求其他物质的速率
练习5、在2L的密闭容器中,发生下列反应: 3A(g)+ B(g)=2C(g)+D(g)。若最初加入的A 和B 都是4ml,在前10s A 的平均反应速率为0.12ml/(L·s),则10s时,容器中B的物质的量为 。
6、某温度时在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析:1、反应开始2min内的X、Y、Z的化学反应速率2、该反应的化学方程式为:___________。
7、把镁条投入到盛有盐酸的敞口容器中,产生氢气的速率变化如图,分析其原因:
8、为了研究碳酸钙与稀盐酸反应的反应速率,一位同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制如图曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的是__________时间段,收集到气体最多的是_________时间段。
(2)试分析三个时间段里,反应速率不同的可能原因(该反应是放热反应)。
(3)在t4后,为什么收集到的气体的体积不再增加?
⑵开始时C(H+)大,该反应的反应速率大; t1—t2由于反应放热温度升高,所以速率迅速增大;最后是因为C(H+)减小了,反应速率减慢.
9、练习:在25℃时,向100mL含HCl 14.6g的盐酸中,放入5.6g铁粉,反应进行到2s时收集到氢气1.12L(标况),之后反应又进行了4s,铁粉全溶解。若不考虑体积变化,则:(1)前2s内用FeCl2表示的平均反应速率为 ;(2)后4s内用HCl表示的平均反应速率为 ;(3)前2s与后4s比较,反应速率 较快,其原因可能 。
前2s时段盐酸浓度比后4s时段大
1、化学反应速率及其表示方法:
可用不同反应物或生成物来表示
一般不用固体和纯液体来表示浓度
2、有关化学反应速率的计算
3、外界条件对化学反应速率的影响
主要外因:浓度 温度 催化剂 ;还有压强 固体的表面积 反应物的状态等
第三节 化学反应的 速率和限度 第二课时
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
§ 氯水是氯气的水溶液,氯气能与水反应,而且这是一个可逆反应。请大家回忆氯水中含有哪些微粒。
氯水的成份: 分子:Cl2 、HClO 、H2O 离子:H+ 、 Cl- 、ClO- 等
(复习)什么叫做可逆反应?
在同一条件下,既向正反应方向进行,同时又向逆反应方向进行的反应.
典型的可逆反应有: Cl2 + H2O HClO + HCl
启示:化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
课堂练习1: 下列不属于可逆反应的是( ) A.氯气与水反应生成盐酸与次氯酸 B.N2与H2在一定条件下可以生成NH3,同 时NH3又可以分解为N2和H2 C.电解水生成H2和O2,H2和O2转化成H2O D.SO2溶于水和H2SO3分解
N2 + H2 NH3
在一固定容积的密闭容器里,加1mlN2和3ml H2 (合适催化剂),能发生什么反应?
(1)开始时c(N2) 、c(H2)大, c(NH3) =0
只有正反应,v(逆)=0
N2 + H2 NH3
(2)瞬间后c(N2) 、c(H2 )变小 , c(NH3)≠0
正逆反应都进行,v(逆) ≠0,v(正)> v(逆)
(3)c(N2) 、c(H2)逐渐变小,c(NH3)逐渐增大, 三种物质的浓度达到一个特定值。
一定时间段内有什么特征?
v(正)= v(逆) ≠0
N2 + H2 NH3
由于v(正)= v(逆) ≠0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化.
从外表上看,反应好象“停止”。
可逆反应的这种特殊状态就是我们今天要研究的化学平衡状态。
(1)0~t1:v(正)>v(逆)
(2)t1: v(正)=v(逆)
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态叫做化学平衡状态。是反应所能达到的最大程度,即该反应进行的限度
前提(适用范围):可逆反应
内在本质:v(正)= v(逆) ≠0
外在标志:反应混合物中各组分 的浓度保持不变
2、化学平衡状态的特征
(3)动:动态平衡(v(正)= v(逆) ≠0)
(2)等:v(正)= v(逆) 同种物质的消耗(或分解)速率和生成速率相等
(4)定:反应混合物中各组分的浓度保持 定,各组分的含量保持不变,质量、物质的量不变。
(5)变:条件改变,原平衡被破坏,在新 的条件下建立新的平衡。
(1)逆:只对于可逆反应
此条件下进行到什么时候达到了这个反应的限度?此时的反应是否停止了?此时为何3种物质的浓度保持不变?
某温度和压强下的密闭容器中,2SO2+O2 2SO3
练习1、可逆反应达到平衡的重要特征( )A.反应停止了B.正、逆反应速率都为零C.反应物和生成物的浓度相等D.正、逆反应的速率相等
2、对于可逆反应M+N Q达到平衡状态时,下列说法正确的是( )
A. M、N、Q三种物质的浓度一定相等B. M、N全部变成了QC. M、N、Q的浓度都保持不变D. 反应已经停止
3、下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是 ( )A.1个N≡N键断裂的同时,有3个H-H键形成B.1个N≡N键断裂的同时,有3个H-H键断裂C.1个N≡N键断裂的同时,有6个N-H键断裂D.1个N≡N键断裂的同时,有6个N-H键形成
5、在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是( )A. A的生成速率与C分解的速率相等 B. 单位时间内生成nmlA,同时生3nmlBC. A、B、C的浓度不再变化 D. A、B、C的分子数比为1:3:2
4、14CO2 + C CO,达到化学平衡后,平衡混合物中含14C的粒子有 。
14CO2、14C、14CO
3、化学平衡状态的判定
对于可逆反应m A(g) n B(g) + p C(g) 在一定条件下达到平衡状态有以下几个标志
(1)A的生成速率和分解速率相等
(2)单位时间生成n ml B和p ml C的同时,生成m ml A
(3)A、B、C的物质的量不再改变
(4)A、B、C的浓度不再改变
(5)A、B、C的百分含量不再改变
间接标志:总的物质的量、压强、密度、颜色
1、N2+3H2 2NH3反应达到平衡时,下列说法正确的是( ) A、N2和H2不再化合了 B、N2、H2、NH3的浓度相等 C、平衡建立前体系的总质量在不断变化而平衡建立后体系的总质量就不再变了 D、N2、H2、NH3的浓度保持不变
2、在一定温度下,可逆反应:A(g)+3B(g) 2C(g)达到平衡的标志是( )A.A生成的速率与C分解的速率相等B.A、B、C的浓度不再变化C.单位时间生成n mlA同时消耗3n mlBD.A、B、C的分子数之比为1:3:2
3.在一定的温度下,可逆反应:A(g)+ 3B(g)=== 2C(g)达到平衡的标志是 A.C的生成速率与C的分解速率相等。 B.单位时间生成n mlA,同时生成3n mlB。 C.A、B、C的物质的量浓度保持不变。 D.A、B、C的分子数之比为1 :3 :2 。 E.容器中气体的密度保持不变。 F.混合气体的平均摩尔质量保持不变。 G.容器中气体的总压强保持不变。
4、下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( ) 反应容器内压强不随时间变化P和S的生成速率相等C. 反应容器内P、Q、R、S四者共存 D.反应容器内总物质的量不随时间而变化
6、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是 ( )A.混合气体的压强 B.混合气体的密度C.B的物质的量浓度 D.气体的总物质的量
7、 在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ( )①C的生成 速率与C的分解速率相等 ②单位时间内生成amlA,同时生成3amlB ③A、B、C的浓度不再变化④A、B、C的分压强不再变化⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化⑦单位时间内消耗amlA,同时生成 3amlB⑧A、B、C、D的分子数之比为1:3:2:2 A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
例一在密闭容器中充入4ml HI,在一定温度下,反应 2HI (g) H2 (g)+I2 (g)达到平衡时,有30%的HI分解,则平衡时混合气体中氢气的物质的量为多少, 混合气体总物质的量为多少?
4、化学平衡计算的一般步骤: “三步曲”
1.写出有关平衡的化学方程式
2.找出各物质的 起始量 转化量 平衡量
反应物的转化率=转化量 /起始量×100﹪
在合成氨工业中,由a ml氮气, b ml氢气混合反应达到平衡,有 c ml 氨气生成,则氨气在反应混合物中所占的体积分数为
c / (a+b-c) × 100%
第三节 化学反应的 速率和限度 第三课时
定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。
平衡1 不平衡 平衡2
§ 影响化学平衡的条件三、化学平衡的移动
V正 > V逆 平衡向正反应方向移动
V正 = V逆 平衡不移动
V正 < V逆 平衡向逆反应方向移动
探究实验1 FeCl3 + 3 KSCN Fe(SCN)3 + 3KCl
(黄色) (无色) (红色) (无色)
向第一支试管里加入几滴 FeCl3 溶液,颜色加深。向第二支试管里加入几滴 KSCN 溶液,颜色加深。
(1)、浓度对化学平衡的影响
1、浓度对化学平衡的影响
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;
在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。
增大反应物的浓度对化学平衡的影响
1、 FeCl2溶液呈浅绿色,其中存在着下列平衡:Fe2++2H2O Fe(OH)2+2H+ 往该溶液中滴加盐酸,发生的变化( ) (A) 平衡向逆反应方向移动 (B) 平衡向正反应方向移动 (C) 溶液由浅绿色变成黄色 (D) Fe2+物质的量增大
(2)、温度对化学平衡的影响
结论:其它条件不变的情况下,温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。
(3)催化剂对化学平衡无影响
催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。
催化剂能缩短平衡到达的时间,但不能使平衡移动
2、 压强对化学平衡的影响
4、 压强对化学平衡的影响
[观察实验]:2NO2 N2O4
[思考]:加压前后颜色有什么变化?为什么?
1、在其它条件不变的情况下, 增大压强,平衡向着气体体积缩小的方向移动。 2、对于反应前后气体不变的反应平衡不移动 3、改变压强必须引起气体浓度的变化,使正逆速率不等
减小压强 增大压强
化学平衡的移动原理 勒夏特列原理
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动——勒夏特列原理
减弱这种改变(只是减弱,不是改变)
升高温度、增加反应物、增大压强时,化学平衡分别向吸热反应、反应物减少、体积缩小的方向移动。
合成氨反应3H2+N2 2NH3(放热反应),原平衡体系的温度为50℃,现将体系置于100℃的环境中,问:(1)平衡向何方向移动?(2)达平衡后体系温度为多少?
如何提高煤的燃烧效率?
1、煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?2、空气用量对煤的充分燃烧有什么影响?为什么?3、应选择什么样的炉(灶)膛材料?理由是什么?4、如何充分利用煤燃烧后的废气中的热量?
我们目前使用得最多的燃料是煤、石油、天然气等,它们都是由古代动植物遗体埋在地层下,并在地壳中经过一系列非常复杂的变化而逐渐形成的。因此,它们被称为化石燃料。这些燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生能源,用一些就会少一些,最终会枯竭。因此,如何来控制燃烧反应,使燃料充分燃烧,这对于节约能源非常重要。如果我们能把煤等燃料的燃烧利用率提高1倍,就相当于将这些燃料的使用时间延长1倍。当今世界各国能源研究的前沿课题之一,就是如何提高燃烧效率,节约能源。
总起来讲,使燃料充分燃烧通常需要考虑两点:一是燃烧时要有足够多的空气;二是燃料与空气要有足够大的接触面。燃料燃烧时,如果空气不足,燃烧就不完全,不仅使燃料燃烧产生的热量减少,浪费资源,而且还会产生大量的CO等物质。这些CO及燃烧不完全的颗粒等随烟气排出后,会污染空气,危害人体健康。还应指出,虽然燃烧需要足量空气,但空气的通入量也要控制适当,否则,过量的空气会带走部分热量,同样会造成浪费。由于大块的固体燃料与空气的接触面有限,燃烧往往不够充分。因此,工业上常需要将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面,提高燃烧效率。例如,我国已开发出新型煤粉燃烧器,煤的燃烧效率可达95%以上。
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度说课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度说课ppt课件,共32页。PPT课件主要包含了哪个反应更快呢,定性描述,课后作业,同学们再见等内容,欢迎下载使用。
必修2第二章 化学反应与能量第三节 化学反应的速率和限度教学演示ppt课件: 这是一份必修2第二章 化学反应与能量第三节 化学反应的速率和限度教学演示ppt课件,共27页。PPT课件主要包含了学习目标,①冒气泡快慢,⑤温度变化等等内容,欢迎下载使用。
人教版 (新课标)第三节 化学反应的速率和限度授课课件ppt: 这是一份人教版 (新课标)第三节 化学反应的速率和限度授课课件ppt,共28页。PPT课件主要包含了化学反应速率,练习巩固,vNH3,vNO,科学探究实验2-5,较慢产生气泡,冷水中,较快产生气泡,快速产生气泡,热水中等内容,欢迎下载使用。













