





化学选修4 化学反应原理第一节 化学反应与能量变化课文配套ppt课件
展开1.能说出热化学方程式的含义并能正确书写热化学方程式。2.通过中和反应反应热的测定,初步了解测定化学反应反应热的实验方法。3.能正确分析测定反应热时误差产生的原因,并能采取适当措施减小误差。
3.书写原则(1)热化学方程式中的化学计量数只表示物质的量,不表示 分子个数,可以用整数也可以用分数。(2)必须注明物质的聚集状态、ΔH的“+、-”和单位。(3)对于相同反应,ΔH的数值必须与化学计量数对应。思考感悟同一个化学反应,是否只有一种形式的热化学方程式?提示:热化学方程式表示参加反应物质的物质的量和反应热的关系,而ΔH的值与参加反应物质的物质的量有关,故热化学方程式中化学计量数不同时,ΔH也不同,一个化学反应,可有多种形式的热化学方程式。
二、中和热的测定【实验目的】测定强酸与强碱反应的反应热,体验化学反应的热效应。【实验用品】仪器:大烧杯(500 mL)、小烧杯(100 mL)、环形玻璃搅拌棒、量筒(50 mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔);药品:盐酸(0.50 ml·L-1)、氢氧化钠溶液(0.55 ml·L-1)。
【实验原理】实验时,先测出盐酸和氢氧化钠溶液的起始温度,求其平均温度t1,两溶液混合充分反应后,读取混合液温度t2。为了使计算简便,可以近似地认为:(1)50 mL0.50 ml·L-1盐酸和50 mL0.55 ml·L-1氢氧化钠溶液的密度都是1 g·cm-3,则:盐酸质量m1=50 g,氢氧化钠溶液质量m2=50 g。近似认为混合溶液的比热容c=4.18 J·(g·℃)-1,所以中和反应放出的热量是:Q=(m1+m2)×c×(t2-t1)=0.418(t2-t1) kJ。
一、热化学方程式的书写及注意事项1.书写“三”步骤
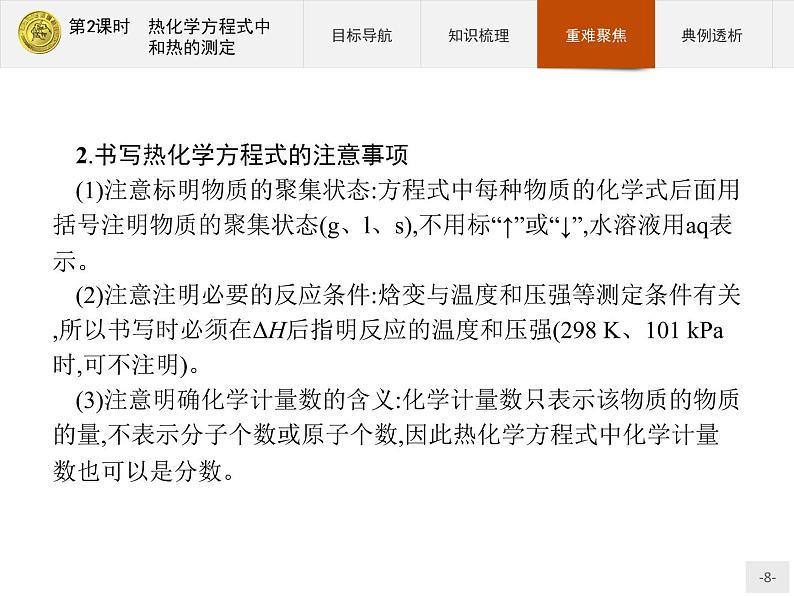
2.书写热化学方程式的注意事项(1)注意标明物质的聚集状态:方程式中每种物质的化学式后面用括号注明物质的聚集状态(g、l、s),不用标“↑”或“↓”,水溶液用aq表示。(2)注意注明必要的反应条件:焓变与温度和压强等测定条件有关,所以书写时必须在ΔH后指明反应的温度和压强(298 K、101 kPa时,可不注明)。(3)注意明确化学计量数的含义:化学计量数只表示该物质的物质的量,不表示分子个数或原子个数,因此热化学方程式中化学计量数也可以是分数。
(4)注意ΔH的单位及符号:ΔH的单位是J·ml-1或kJ·ml-1,ΔH只能写在化学方程式的右边,表示正向反应的焓变。ΔH<0表示为放热反应;ΔH>0则表示为吸热反应。(5)注意同一反应中化学计量数与ΔH数值的对应关系:化学方程式中各物质的化学计量数加倍,则ΔH的数值也加倍;若反应逆向进行,则ΔH改变符号,但绝对值不变。特别提示热化学方程式书写中的常见错误:物质聚集状态的标注错误、ΔH的正负及单位书写错误、热量数值与化学方程式中化学计量数不对应等。
二、中和热的测定1.实验装置 如图所示的简易装置可用来测定中和反应的反应热:在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平,两杯口相平,可使盖板把杯口尽量盖严,从而减少热量损失。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),达到保温隔热、减少实验过程中热量损失的目的。大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。
注意:(1)环形玻璃搅拌棒的作用:匀速搅拌,使溶液混合均匀。实验中不能用环形铜丝搅拌棒代替环形玻璃搅拌棒,因为铜丝易导热,使热量损失较大。(2)泡沫塑料板(或碎纸条、碎泡沫塑料)的作用:保温隔热、减少实验过程中热量损失。(3)不能用同一个量筒测量盐酸和NaOH溶液的体积。因为量筒内的酸会与碱发生反应而使热量散失。(4)酸、碱混合时,要把烧杯中的NaOH溶液快速倒入量热计中而不能缓缓倒入,若动作迟缓,将会使热量损失而使误差增大。
2.实验产生误差的原因(1)量取溶液的体积有误差(测量结果是按50 mL的酸、碱进行计算,若实际量取时,多于50 mL或少于50 mL都会造成误差)。(2)温度计的读数有误。(3)实验过程中有液体洒在外面。(4)混合酸、碱溶液时,动作缓慢,导致实验误差。(5)隔热操作不到位,致使实验过程中热量损失而导致误差。(6)测酸后的温度计未用水清洗便立即去测碱的温度,致使热量损失而引起误差。3.实验结论所测得的三次中和反应的反应热相同。
4.实验分析溶液中所发生的反应均为H++OH- H2O。由于三次实验中所用溶液的体积相同,溶液中H+和OH-的浓度相同,因此三次反应的反应热也是相同的。
热化学方程式的正误判断【例题1】 由氢气和氧气反应生成1 ml水蒸气放出241.8 kJ的热量,1 g水蒸气转化为液态水放出2.45 kJ的热量,则下列热化学方程式书写正确的是( )
解析:放热反应ΔH为“-”,C、D错误;1 ml水蒸气转化为相同条件下的1 ml液态水时要放出44.1 kJ的热量,可求出ΔH为-285.9 kJ·ml-1,B错误,故选A项。答案:A
点拨判断热化学方程式正误的“三看”“一看”ΔH的符号是否正确(根据反应是放热还是吸热);“二看”物质的聚集状态是否正确(根据题中表述);“三看”ΔH的数值是否正确(根据反应热与化学计量数的对应关系)。
热化学方程式的应用【例题2】 在一定条件下,氢气和丙烷燃烧的热化学方程式为:2H2(g)+O2(g)2.H2O(l)ΔH=-571.6 kJ·ml-1C3H8(g)+5O2(g)3.CO2(g)+4H2O(l)ΔH=-2 220 kJ·ml-15 ml 氢气和丙烷的混合气完全燃烧时放热3 847 kJ,则氢气和丙烷的体积比为( )A.1∶3B.3∶1C.1∶4D.1∶1
与中和热有关的实验探究【例题3】 50 mL 0.50 ml·L-1盐酸与50 mL 0.55 ml·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是 。 (2)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。 (3)实验中改用60 mL 0.50 ml·L-1盐酸与50 mL 0.55 ml·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。 (4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”“偏小”或“无影响”)。
解析:(1)碎泡沫塑料的作用为减少实验过程中的热量损失。(2)不盖硬纸板会损失部分热量,故所测结果偏小。(3)由中和热概念可知,中和热是以生成1 ml水为标准的,而与酸碱的用量无关。(4)由于弱酸弱碱的中和反应放出热量的同时,还有弱酸弱碱的电离吸热,所以用氨水代替NaOH溶液反应测得的中和热数值偏小。答案:(1)减少实验过程中的热量损失(2)偏小(3)不相等 相等 因为中和热是指在稀溶液中酸与碱发生中和反应生成1 ml H2O所放出的热量,与酸和碱的用量无关(4)偏小
2020-2021学年第一章 化学反应的热效应第一节 反应热教学ppt课件: 这是一份2020-2021学年第一章 化学反应的热效应第一节 反应热教学ppt课件,文件包含人教版化学选修一112《热化学方程式燃烧热》课件pptx、人教版化学选修一112《热化学方程式燃烧热》教学设计docx等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。
高中第二节 燃烧热 能源教学演示课件ppt: 这是一份高中第二节 燃烧热 能源教学演示课件ppt,共15页。PPT课件主要包含了一实验仪器和药品,实验步骤,实验误差分析,学以致用等内容,欢迎下载使用。
高中人教版 (新课标)第三节 化学反应热的计算示范课课件ppt: 这是一份高中人教版 (新课标)第三节 化学反应热的计算示范课课件ppt,共13页。PPT课件主要包含了实验步骤,讨论下列问题等内容,欢迎下载使用。













