高中化学人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第二节 分子晶体与原子晶体授课ppt课件
展开1.能记住分子晶体、原子晶体的概念及结构特点。2.能说出晶体类型与性质之间的关系。3.能说出氢键对物质物理性质的影响。
一、分子晶体1.结构特点(1)构成微粒及微粒间作用力。
(2)微粒堆积方式。
2.分子晶体与物质的类别
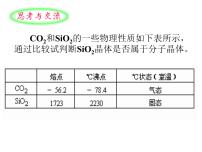
3.典型的分子晶体(1)干冰。①每个晶胞中有4个CO2分子,12个原子。②每个CO2分子周围等距离紧邻的CO2分子有12个。(2)冰。①水分子之间的作用力有范德华力,但主要作用力是氢键。②由于氢键的存在迫使在四面体中心的每个水分子与四面体顶点的4个相邻的水分子相互吸引。
思考感悟1所有分子晶体中是否均存在化学键,为什么?提示:绝大多数分子晶体的分子内部都存在化学键,如N2、H2O、SO2等分子内部都有共价键,而稀有气体为单原子分子,分子内部无化学键,分子之间以范德华力结合,所以并非分子晶体的分子内部都存在化学键。
二、原子晶体1.结构特点
2.原子晶体与物质的类别
3.典型的原子晶体(1)金刚石。①在晶体中每个碳原子以4个共价键对称地与相邻的4个碳原子相结合,形成正四面体结构。②晶体中C—C—C夹角为109°28',碳原子采取sp3杂化。③最小环上有6个碳原子。④晶体中碳原子个数与C—C键个数之比为 (2)二氧化硅。①在晶体中每个硅原子和4个氧原子形成4个共价键;每个氧原子与2个硅原子相结合。SiO2晶体中硅原子与氧原子按1∶2的比例组成。②最小环上有12个原子。
思考感悟2含有共价键的晶体都是原子晶体吗?SiO2是二氧化硅的分子式吗?提示:原子晶体中都有共价键,但含有共价键的不一定是原子晶体。如CO2、H2O等分子晶体中也含有共价键。二氧化硅为原子晶体,晶体中不存在单个分子,其化学式SiO2表示Si与O的最简个数比为1∶2,而不是分子式。
一、原子晶体与分子晶体的比较
特别提醒(1)由原子构成的晶体不一定是原子晶体,如稀有气体组成的晶体。(2)原子晶体中只含有共价键,不存在范德华力。(3)原子晶体中没有单个的小分子,其化学式仅代表原子的个数比。(4)分子晶体中分子内部可能含有共价键,分子间一定没有共价键。
二、分子晶体、原子晶体熔、沸点比较1.不同类型的晶体熔、沸点:原子晶体>分子晶体。2.同一类型的晶体(1)分子晶体。①分子间作用力越大,物质的熔、沸点越高;具有氢键的分子晶体,熔、沸点相对较高。如熔、沸点:H2O>H2Te>H2Se>H2S。②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。如熔、沸点:SnH4>GeH4>SiH4>CH4。③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,其熔、沸点越高。如熔、沸点:CO>N2,CH3OH>CH3CH3。
④同分异构体,支链越多,沸点越低。
(2)原子晶体。晶体的熔、沸点高低取决于共价键的键长和键能。键长越短,键能越大,共价键越稳定,物质的熔、沸点越高。如熔点:金刚石>碳化硅>晶体硅。
分子晶体【例题1】 SiCl4的分子结构与CCl4相似,对其进行下列推测,不正确的是( )A.SiCl4晶体是分子晶体B.常温、常压下,SiCl4是气体C.SiCl4的分子是由极性键形成的非极性分子D.SiCl4的熔点高于CCl4答案:B解析:由于SiCl4具有分子结构,所以属于分子晶体。影响分子晶体熔、沸点的因素是分子间的作用力,在这两种分子中都只有范德华力,SiCl4的相对分子质量大于CCl4的相对分子质量,所以SiCl4的分子间作用力比CCl4大,熔、沸点比CCl4高。CCl4的分子是正四面体结构,SiCl4与它结构相似,因此也是正四面体结构,是含极性键的非极性分子。
点拨影响分子晶体物理性质的主要因素是存在于晶体中的分子间作用力(包括范德华力和氢键)。由于分子间作用力比化学键的键能小得多,因此分子晶体的熔、沸点较低,硬度较小。
原子晶体的性质【例题2】 晶体硅(Si)和金刚砂(SiC)都是与金刚石相似的原子晶体,请根据下表中的数据,分析其熔点高低、硬度大小与其结构之间的关系。
答案:键长越短,键能越大,熔点越高,硬度越大;反之,键长越长,键能越小,熔点越低,硬度越小。
解析:在原子晶体里,所有原子都以共价键相互结合,整块晶体是一个三维的共价键网状结构。所以,影响原子晶体的熔点、硬度的主要因素就是共价键的键能,键能越大,原子晶体的熔点越高,硬度越大,而共价键的键能又与键长相关,一般来说,键长越短,键能越大;键长越长,键能越小。点拨原子晶体物理性质的差异主要是由共价键键能的不同造成的,键能越大,熔、沸点越高,硬度越大。而键能又与键长有关,键长可由成键原子半径的相对大小得出。一般来说,成键原子的半径之和越大,键长越长,键能越小。
分子晶体与原子晶体比较【例题3】 下列说法正确的是( )A.原子晶体中只存在非极性共价键B.因为HCl的相对分子质量大于HF,所以HCl的熔点高于HFC.干冰升华时,分子内共价键不会发生断裂D.金属元素和非金属元素形成的化合物一定是离子化合物答案:C解析:原子晶体中可能存在极性共价键,如SiO2、SiC等,A项不正确;HF晶体中存在氢键,熔点高于HCl晶体,B项不正确;干冰升华是物理变化,分子间作用力被破坏,但分子内共价键不断裂,C项正确;金属元素和非金属元素形成的化合物不一定是离子化合物,也可能是共价化合物,如AlCl3等,D项不正确。
人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性示范课ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性示范课ppt课件,共24页。PPT课件主要包含了酸碱中和滴定,学习目标,滴定管的构造,1mL,教师演示,误差分析,读数偏大,读数偏小等内容,欢迎下载使用。
高中化学人教版 (新课标)选修5 有机化学基础第二节 醛教课内容课件ppt: 这是一份高中化学人教版 (新课标)选修5 有机化学基础第二节 醛教课内容课件ppt,共24页。PPT课件主要包含了常见的醛,2醛基的检验,知识点1,知识点2,知识点3等内容,欢迎下载使用。
高中化学第二节 金属的腐蚀和防护授课ppt课件: 这是一份高中化学第二节 金属的腐蚀和防护授课ppt课件,共24页。