



化学选修3 物质结构与性质第三节 分子的性质说课ppt课件
展开1.能记住物质溶解性及其影响因素。2.能说出分子手性与物质性质之间的关系。3.会运用无机含氧酸的酸性判断方法。
一、溶解性1.“相似相溶”规律非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。2.影响物质溶解性的因素(1)外界因素主要有温度、压强等。(2)从分子结构的角度有相似相溶规律。(3)如果溶质与溶剂之间能形成氢键,则溶解度增大,且氢键作用力越大,溶解度越大。
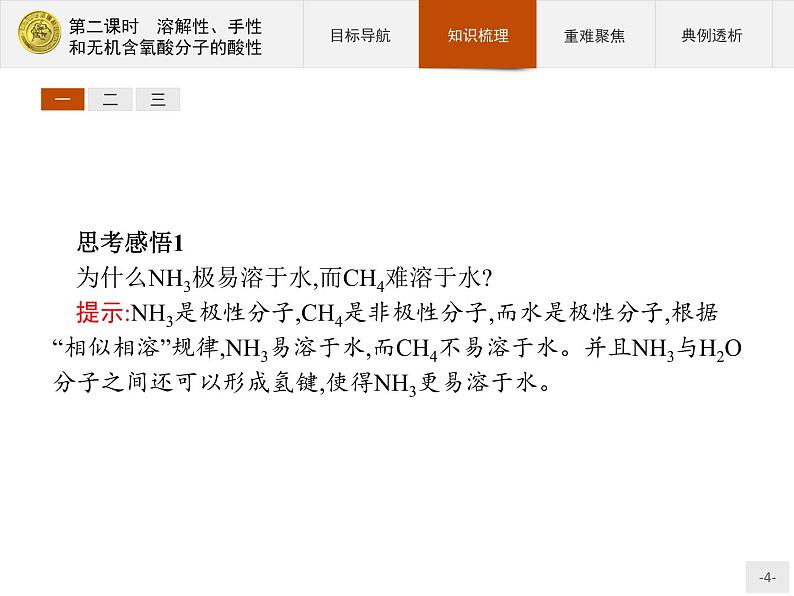
思考感悟1为什么NH3极易溶于水,而CH4难溶于水?提示:NH3是极性分子,CH4是非极性分子,而水是极性分子,根据“相似相溶”规律,NH3易溶于水,而CH4不易溶于水。并且NH3与H2O分子之间还可以形成氢键,使得NH3更易溶于水。
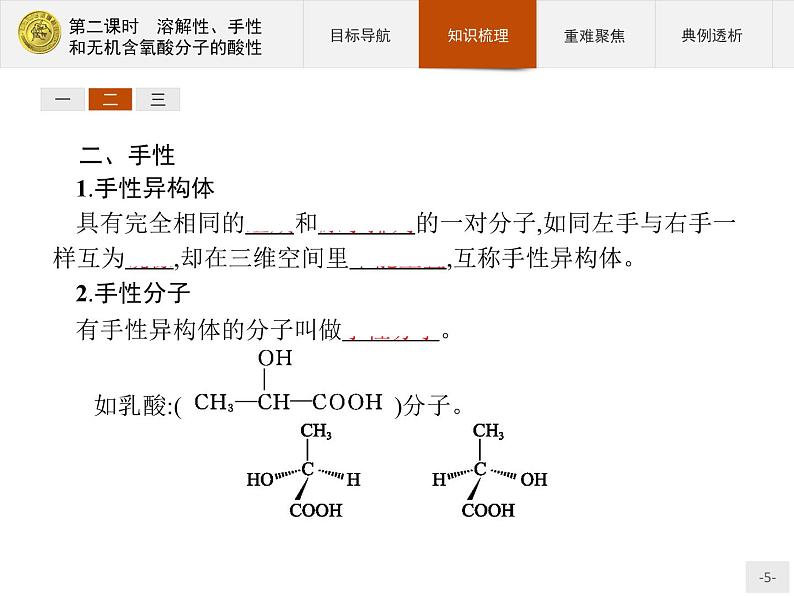
二、手性1.手性异构体具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。2.手性分子有手性异构体的分子叫做手性分子。
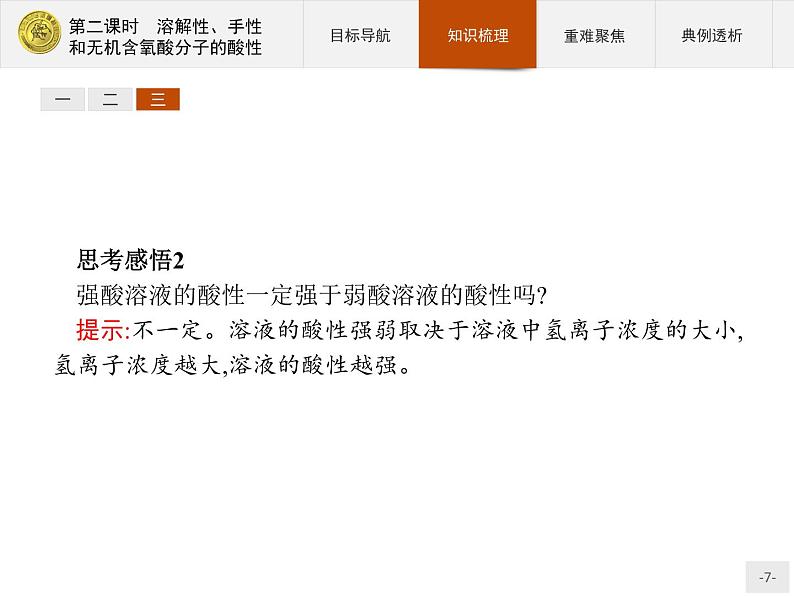
三、无机含氧酸分子的酸性1.酸性强弱对于同一种元素的含氧酸,该元素的化合价越高,其含氧酸的酸性越强。2.原因(1)含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越高,导致R—O—H 中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强。(2)H2SO3可写成(HO)2SO,n=1;H2SO4可写成(HO)2SO2,n=2。所以,H2SO3酸性弱于H2SO4。(3)HClO、HClO2、HClO3、HClO4的酸性由弱到强的顺序为HClO
一、物质的溶解性1.“相似相溶”规律非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。如蔗糖和氨易溶于水,难溶于CCl4,因为蔗糖、氨、水都是极性分子;而萘和碘易溶于CCl4,难溶于水,因为萘和碘、CCl4都是非极性分子。离子化合物是强极性物质,很多易溶于水。2.氢键对物质溶解性的影响若溶剂与溶质之间存在氢键,则溶解性好;若溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水分子间形成了氢键的原因。
3.分子结构的相似性“相似相溶”还适用于分子结构的相似性。如乙醇分子中的—OH与水分子中的—OH相近,因而乙醇能与水互溶。当然,乙醇分子由于—OH的极性较强,易与H2O形成氢键也是其互溶的原因。而戊醇CH3CH2CH2CH2CH2OH中的烃基较大,烃基是非极性基团,是疏水亲油基团,戊醇在水中的溶解度明显减小。烃基越大的醇在水中的溶解度就越小。羧酸也是如此。4.化学反应对物质溶解性的影响如果溶质与溶剂能发生化学反应,也会增大溶质的溶解度。如SO2与水发生反应生成H2SO3,而H2SO3可溶于水,因此,SO2的溶解度较大。
二、手性1.手性异构体和手性分子如果一对分子,它们的组成和原子的排列方式完全相同,但如同左手和右手一样互为镜像,在三维空间里不能重叠,这对分子互称为手性异构体,又叫对映异构体、光学异构体。有手性异构体的分子称为手性分子。如图所示的两个分子,化学组成完全相同,但是无论如何旋转都不能使二者重叠,它们具有不同的三维结构。显然,结构不同的分子,性质也不同。构成生命体的有机分子绝大多数是手性分子,许多主要的生物活性是通过严格的手性匹配产生分子识别而实现的。
2.手性碳原子连接四个互不相同的原子或原子团的碳原子称为手性碳原子。用*C来标记。具有手性的有机物,是因为其分子中含有手性碳原子造成的。如:R1、R2、R3、R4是互不相同的原子或原子团。判断一种有机物是否具有手性异构体,就看其分子含有的碳原子是否连有四个互不相同的原子或原子团。3.手性分子的用途(1)常见手性分子:构成生命体的绝大多数分子为手性分子。两个手性分子的性质不同,且手性有机物分子中必含手性碳原子。(2)手性分子的应用:生产手性药物、手性催化剂(手性催化剂只催化或主要催化一种手性分子的合成)。
三、无机含氧酸分子的酸性1.无机含氧酸分子的结构无机含氧酸分子之所以能显示酸性,是因为其分子中含有—OH,而—OH上的H在水分子的作用下能够转化成H+而显示一定的酸性。如HNO3、H2SO4、H3PO4的结构式分别为:
2.无机含氧酸分子的酸性(1)经验规律:无机含氧酸的酸性随着分子中连接在中心原子上的非羟基氧原子数目的增多而增强,即(HO)mROn中n值越大,酸性越强,n值与酸性强弱的一般关系是:
(2)解释:n值越大,则R的正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下就越容易电离出H+,酸性越强。
3.无机含氧酸分子的酸性比较(1)对于同一种元素的无机含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。例如酸性:HClO4>HClO3>HClO2>HClO。即(HO)mROn中n越大,该酸的酸性越强。(2)相同化合价的不同种元素,中心原子R的半径越小,酸性越强。例如原子半径Cl
溶解性【例题1】 PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大。请回答下列问题:(1)PtCl2(NH3)2是平面四边形结构,还是四面体结构? 。 (2)请在以下横线上画出这两种固体分子的几何构型图:淡黄色固体 , 黄绿色固体 。 (3)淡黄色固体物质由 组成,黄绿色固体物质由 组成(填“极性分子”或“非极性分子”)。 (4)黄绿色固体在水中溶解度比淡黄色固体大,原因是 。
答案:(1)平面四边形 (3)非极性分子 极性分子(4)黄绿色固体是由极性分子构成的,而淡黄色固体是由非极性分子构成的,根据“相似相溶”原理可知前者在水中的溶解度大于后者
解析:(1)根据PtCl2(NH3)2可以形成两种固体,即其有两种同分异构体,可知其结构应为平面四边形结构,若为四面体结构则无同分异构体。(2)(3)PtCl2(NH3)2的两种同分异构体的结构为 由于淡黄色固体在水中的溶解度较小,因此其分子无极性,其结构为①,则黄绿色固体为极性分子,其结构为②。(4)根据“相似相溶”原理可知,黄绿色固体是由极性分子构成的,故其在水中的溶解度要大于由非极性分子构成的淡黄色固体。
点拨先根据“相似相溶”原理,判断出两种固体的极性,再由分子的极性判断出其分子的构型。
手性碳原子的判断【例题2】 下列物质分子中不具有手性碳原子的是( )A.乳酸:CH3—CH(OH)—COOHB.氨基乙酸:H2N—CH2—COOHC.丙醛糖:CH2OH—CH(OH)—CHOD.α-氨基丙酸:CH3—CH(NH2)—COOH答案:B解析:有机分子中连接四个不同原子或原子团的碳原子称为手性碳原子。A、C、D选项分子处于中间位置的碳原子均连有一个氢原子和三个不同的其他原子团,具有手性,不符合题意;B项分子中间的碳原子连有两个氢,不具有手性。
无机含氧酸分子的酸性【例题3】 20世纪60年代,美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基氧原子数。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(m-n)的关系如下表:
试简要回答下列问题:(1)按此规则判断,H3AsO4、H2CrO4、HMnO4酸性由弱到强的顺序为 。 (2)H3PO3和H3AsO3的组成相似,但酸性强弱相差很大。已知H3PO3为中强酸,H3AsO3为弱酸,试推断H3PO3和H3AsO3的分子结构: 。 (3)按此规则判断碳酸应属于 酸,与通常认为的碳酸的酸性强度是否一致? ,其可能的原因是 。
答案:(1)H3AsO4
酸性:H3AsO4
(3)H2CO3中非羟基氧原子数为1,应为中强酸,与通常认为碳酸是弱酸不一致。其可能原因是溶于水的那部分CO2并不能完全转化为H2CO3。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质背景图ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质背景图ppt课件,共16页。PPT课件主要包含了目标一溶解性,溶解性,压强等,③从分子结构角度,分子的极性,“相似相溶”,分子的结构相似,②化学反应,非极性溶剂,极性溶剂等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质教案配套ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质教案配套ppt课件,共10页。PPT课件主要包含了学习目标,二手性分子,手性异构体,CHBrClF分子,看图整理,手性分子,有手性异构体的分子,手性碳原子,乳酸分子两种异构体,手性分子的判断方法等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质授课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质授课ppt课件,文件包含人教版高中化学选择性必修2第2章第3节基础课时9氢键溶解性分子的手性课件ppt、人教版高中化学选择性必修2第2章第3节基础课时9氢键溶解性分子的手性学案doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。













