



人教版 (新课标)选修6 实验化学实验1-1 蓝瓶子实验优秀课件ppt
展开1.形成严谨求实的科学态度,具有批判精神和创新意识。2.认识反应条件的控制在化学研究中的作用和意义,初步掌握控制反应条件的一些方法。
一、实验成功的关键对每一个具体的化学实验而言,控制好实验条件极为重要。控制一些条件不变,研究某一因素对反应影响的实验方法已经成为最常用的一种科学方法。控制实验的条件可以从以下几个方面来考虑:控制实验的外界条件,如温度、压强、浓度等;控制实验的操作方法,如操作的顺序、操作的要点。
二、蓝瓶子实验1.影响化学反应速率的因素(1)内因:物质的性质,这是化学反应速率的决定性因素,因此,不同的化学反应具有不同的反应速率。(2)外因:浓度、温度、压强、催化剂等外界条件。由于受这些外界条件的影响,同一个化学反应在不同的外界条件下可能会有不同的化学反应速率。2.蓝瓶子实验原理
在碱性溶液中,蓝色亚甲基蓝很容易被葡萄糖还原为无色亚甲基白。振荡此溶液时,溶液与空气的接触面积增大,溶液中氧气的溶解量就增多,氧气把亚甲基白氧化为亚甲基蓝,溶液又呈蓝色。当瓶子静置时,有一部分溶解的氧气逸出,溶液里葡萄糖所起的还原作用渐渐起主导作用,其颜色将由蓝色变为无色。颜色可以重复变化,直到所有的葡萄糖都被氧化完毕或溶液内的氧气耗尽为止。本实验颜色变化是反应体系交替发生还原与氧化反应的结果。由蓝色出现至变成无色所需要的时间是振荡周期。振荡周期的长短受反应条件如溶液的酸碱度、反应物浓度和温度等因素的显著影响。
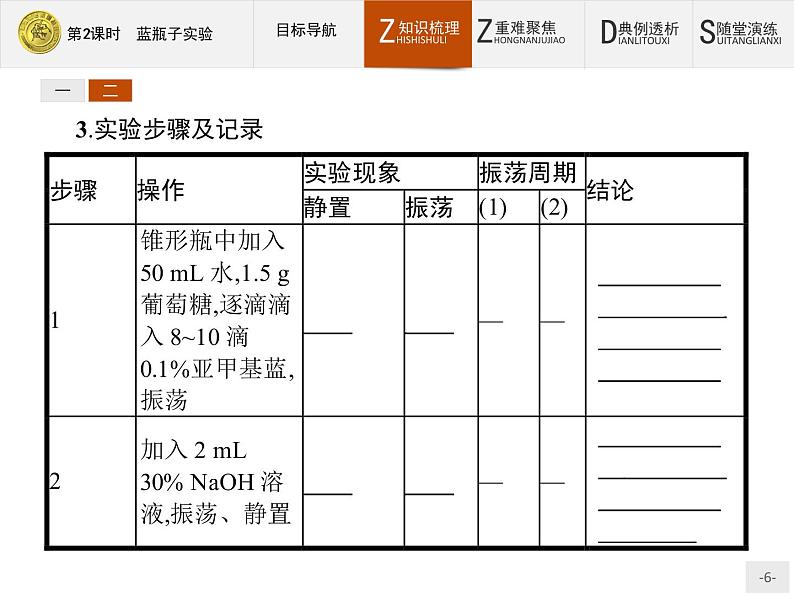
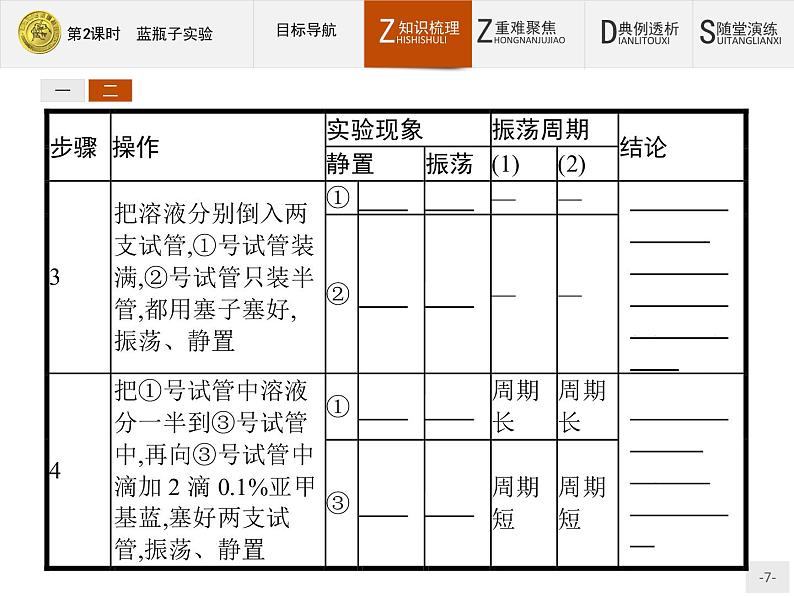
一、蓝瓶子实验注意事项1.本实验主要探究了浓度、温度以及溶液的碱性对葡萄糖还原亚甲基蓝反应的影响。要严格按照实验步骤中的操作要求进行实验,尤其是实验中使用的溶液一定要严格按照实验用品中的要求进行配制。因为亚甲基蓝浓度过高,将会使反应溶液的颜色呈深蓝色,并且振荡后还原时间增长不易褪色。葡萄糖浓度过高可以加快亚甲基蓝的还原反应,使褪色速率加大,但是也使亚甲基白不易返回蓝色。NaOH溶液的浓度最好控制在30%左右,过稀,反应速率太小;过浓,腐蚀性太强,有潜在的安全问题。2.步骤2中,加入NaOH溶液后,振荡变为蓝色,静置变为无色所需时间略长,所以需要耐心等待一会儿。在步骤3中,要求①号试管中装满液体,使上部没有空气。
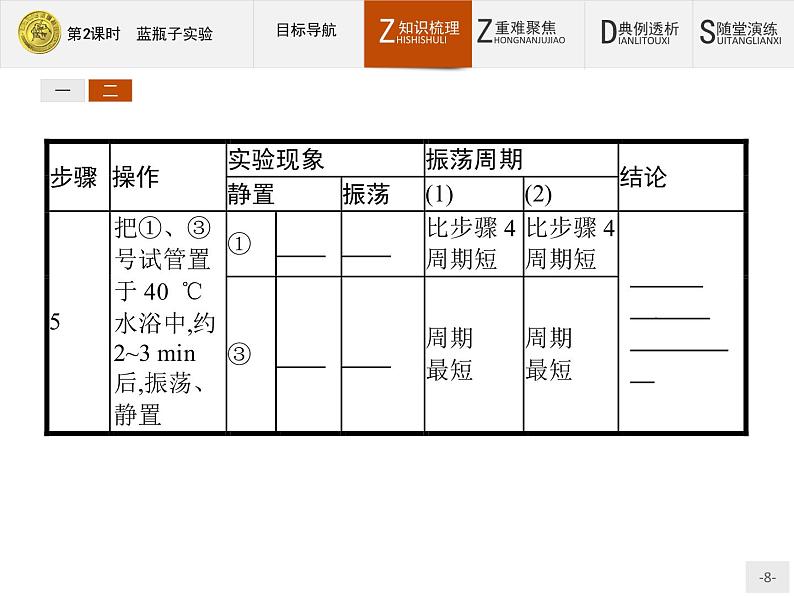
3.振荡锥形瓶中液体的方法要正确:用拇指、食指和中指拿住锥形瓶口,用手腕轻轻画圈摇动锥形瓶中的液体。4.实验的环境温度不能过低,否则实验现象可能和预期的不同。在含有亚甲基蓝和葡萄糖的锥形瓶中,加入30%的NaOH溶液后,振荡静置,若环境温度较低时,蓝色需较长时间才能褪去,即第一次的振荡周期较长,可以用温水配制葡萄糖溶液,但水温不宜超过30 ℃。由于温度升高,反应速率加大,所以在40 ℃的水浴中溶液的褪色速率加大,振荡周期变短,这时操作计时器动作要快速准确。另外水浴加热时温度计应放在水浴的中间位置,控制温度在40 ℃左右。水浴的温度不宜太高,否则振荡的周期过短,不利于记录实验现象。5.振荡过程中由于蓝色并不是立刻全部褪去,所以必须振荡至蓝色完全褪去。认真记录实验现象,对于振荡周期的记录要仔细。
二、实验小结这是一个利用对比实验的方法来探究亚甲基蓝被还原的条件的实验。通过观察溶液颜色的变化来判断改变外界条件对反应速率的影响情况。实验中的步骤1和步骤2的目的是要对比探究溶液酸碱性对该反应的影响。亚甲基蓝与葡萄糖溶液混合,由于亚甲基蓝在碱性条件下易被还原,所以开始溶液的蓝色不易褪去。当加入了2 mL 30% NaOH溶液后,振荡、静置,亚甲基蓝被还原为无色亚甲基白;再次振荡锥形瓶,亚甲基白与氧气接触而被氧化,又生成蓝色的亚甲基蓝。如此重复操作,溶液交替出现蓝色和无色。
步骤3和步骤4中,通过改变反应物氧气或亚甲基蓝的浓度来研究转化速率大小。①号试管中液体上部没有空气,所以振荡后溶液不会变为蓝色。③号试管中由于又滴加了两滴亚甲基蓝,使得溶液中亚甲基蓝的浓度增大,所以振荡后溶液的蓝色比①号试管要深,且振荡周期要短。步骤5中,研究温度对该转化反应的影响,温度升高,反应加快,所以振荡周期变短。
知识点1 蓝瓶子实验【例题1】 蓝瓶子实验操作步骤如下:
①如图所示,在250 mL锥形瓶中,依次加入2 g NaOH、100 mL H2O和3 g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈现蓝色;②塞紧橡皮塞(活塞a、b关闭),将溶液静置,溶液变为无色;③再打开瓶塞,振荡,溶液又变为蓝色;④再塞紧橡皮塞,将溶液静置,溶液又变为无色。以上③④可重复多次。
试回答下列问题:(1)某学生将起初配得的蓝色溶液分装在A、B两支试管中(如上图,A试管充满溶液,B中有少量溶液),塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,能显蓝色的是 (填“A”或“B”); (2)若塞紧锥形瓶塞并打开活塞a、b,通入足量氢气后,再关闭活塞a、b并振荡,溶液能否由无色变为蓝色 (填“能”或“不能”);若塞紧锥形瓶塞并打开a、b,通入足量氧气,溶液能否由无色变为蓝色 (填“能”或“不能”); (3)上述转化过程中,葡萄糖的作用是 ,亚甲基蓝的作用是 ; (4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为维生素C具有 ;
(5)该实验中③④操作能否无限次重复进行 (填“能”或“不能”),理由是 。 解析:亚甲基蓝 亚甲基白。显然(1)由于A试管中充满溶液,无氧化剂O2,故不能变为蓝色。(2)由于充入的是H2,也无氧化剂O2,不能变为蓝色;充入O2后则亚甲基白能被氧化而变为蓝色。(3)通过上述分析可知葡萄糖能还原亚甲基蓝,故作还原剂,亚甲基蓝同时还作指示剂。(4)由于维生素C可代替葡萄糖,故具有还原性。(5)实验不能无限次进行,因葡萄糖最终被耗尽。答案:(1)B(2)不能 能(3)还原剂 氧化剂(或兼作指示剂)(4)较强的还原性(5)不能 在重复多次后葡萄糖被完全消耗
点拨蓝瓶子实验的实质是利用了氧化还原反应的原理使有色物质的颜色发生改变。
知识点2 反应条件的控制【例题2】 用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀硫酸和 。 (2)除去蒸馏水中溶解的O2常采用 的方法。 (3)生成白色Fe(OH)2沉淀的操作是:用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备。(1)在试管Ⅰ里加入的试剂是 。 (2)在试管Ⅱ里加入的试剂是 。 (3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。 (4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
解析:方法一中,(1)由于Fe2+具有较强的还原性,易被氧化为Fe3+,故在配好的溶液中常加一枚铁钉或适量铁屑以防止其被氧化;(2)由于气体的溶解度随温度升高而迅速减小,故可用加热的方法除去蒸馏水中溶解的O2;(3)空气中含有大量的O2,为防止生成的Fe(OH)2沉淀与空气接触,需将吸取NaOH溶液的滴管放到液面以下后再挤出。方法二中,(1)由所给试剂及装置特点知,试管Ⅰ为封闭系统,应为产生H2并赶尽溶液中的空气及液面上方空气的装置,故试管Ⅰ中加入的试剂为铁屑和稀硫酸;(2)试管Ⅱ中加入的试剂为NaOH;(3)为确保实验在无氧状态下进行,必须把系统中的O2排除干净,故接下来的操作应为检验试管Ⅱ出口处排出的氢气纯度,当产生氢气较纯时再夹紧止水夹;(4)由于试管Ⅰ中产生的H2充满了Ⅰ、Ⅱ两支试管,外界空气不易进入,即Fe(OH)2是在H2形成的气氛中产生的,故Fe(OH)2白色沉淀可保持较长的时间。
答案:方法一:(1)铁屑(2)煮沸(3)避免生成的Fe(OH)2沉淀接触O2方法二:(1)稀硫酸、铁屑(2)NaOH溶液(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
点拨实验室制备氢氧化亚铁时,由于Fe2+的还原性强,所以整个实验过程应避免试剂中的少量氧气或空气中的氧气将Fe2+氧化。其方法是:①亚铁盐需新制(用足量铁与稀硫酸反应或还原氯化铁溶液);②将所用氢氧化钠溶液煮沸以赶尽溶于其中的空气(O2);③使用长滴管吸入氢氧化钠溶液后将滴管伸至硫酸亚铁或氯化亚铁溶液的液面以下,慢慢挤压乳胶头使氢氧化钠与硫酸亚铁或氯化亚铁接触;④可以利用液封来隔绝空气,可选用的试剂应与水互不相溶、密度比水小,不易与空气发生作用,如苯、甲苯、植物油等有机试剂均可,其中植物油是无毒无害的液体,所以最佳试剂是植物油。
1 2 3 4
1演示铁在纯氧中燃烧实验时,将铁丝绕成螺旋状,其主要目的是( )A.提高铁丝利用率B.提高反应温度C.增大反应物的接触面积D.使瓶底氧气充分利用解析:做铁在纯氧中燃烧实验时,将铁丝绕成螺旋状,主要目的是增大反应物的接触面积,加大反应速率。答案:C
2下列蓝瓶子实验,振荡周期最短的是( )
解析:温度高,反应快,振荡周期短,C、D两项被排除;亚甲基蓝浓度越高,振荡周期越短,所以选B项。答案:B
3同等条件下,在不同的糖溶液中加入亚甲基蓝试剂,“振荡→静置”,实验结果记录如下:
请回答下列问题:(1)实验得出的结论 。 (2)以葡萄糖为例说明亚甲基蓝的变色原理是 。
答案:(1)可溶性淀粉和蔗糖为非还原型糖,使用不同的还原型糖,亚甲基蓝的振荡周期不同(2)亚甲基蓝(蓝色、氧化态)亚甲基白(无色、还原态)
4“蓝瓶子”实验中的亚甲基蓝溶液是一种氧化还原指示剂。试回答:(1)实验反应振荡的周期与 等因素有关。 (2)实验中需要记录的“量”主要是 ,实验采用的研究方法是 。 (3)实验得出的结论是 。 解析:将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,由于亚甲基蓝被葡萄糖还原转化为亚甲基白,溶液褪色;振荡后,溶液上方的氧气进入溶液,亚甲基白又转化为亚甲基蓝,溶液又呈蓝色。在振荡与静置之间,溶液中溶解的氧气的量发生变化,溶液的颜色也随之变化,直到溶液中的葡萄糖或瓶中的氧气被耗尽。
高中化学人教版 (2019)选择性必修3第一节 有机化合物的结构特点评优课课件ppt: 这是一份高中化学人教版 (2019)选择性必修3<a href="/hx/tb_c4002459_t3/?tag_id=26" target="_blank">第一节 有机化合物的结构特点评优课课件ppt</a>,共26页。PPT课件主要包含了1球棍模型,2空间填充模型,两“模”,1分子式,C3H8,3电子式,4结构式,C2H4,CH2,5结构简式等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应示范课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应示范课课件ppt,共12页。PPT课件主要包含了学习目标,实验探究,实验装置,思考讨论,问题研究,课堂探究,交流讨论,ΔH1+ΔH2,课堂巩固,课堂练习等内容,欢迎下载使用。
化学第1节 化学反应的热效应完美版ppt课件: 这是一份化学第1节 化学反应的热效应完美版ppt课件,文件包含新教材精创112化学反应的焓变课件-鲁科版高中化学选择性必修1共21张PPTpptx、新教材精创112化学反应的焓变学案-鲁科版高中化学选择性必修1docx、新教材精创112化学反应的焓变教学设计-鲁科版高中化学选择性必修1docx、新教材精创112化学反应的焓变练习原卷版docx、新教材精创112化学反应的焓变练习解析版docx等5份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













