
福建省莆田第一中学2021届高三上学期期中考试 化学(含答案)
展开莆田一中2020-2021学年度上学期第一学段考试试卷
高三 化学(必修1,2;选修3)
命题人: 审核人: (满分100分 考试时间90分钟)
可能用到的相对原子质量: O 16 K 39 Cl 35.5 Fe 56 N 14
一、单项选择题(本部分共15题,每题3分,共45分)
1.下列图示的混合物不属于胶体的是
A.氯化钠注射液 | B.云雾 | C.稀豆浆 | D.烟水晶 |
2.下列典籍记载的文字中,涉及置换反应的是
A.以曾青(主要成分为硫酸铜)涂铁,铁赤色如铜(出自《抱朴子》)
B.凡石灰(主要成分为碳酸钙),经火焚炼为用(出自《天工开物》)
C.以毛袋漉去曲滓(酒糟),又以绢滤曲汁于瓮中(出自《齐民要术》)
D.铅山县有苦泉(含硫酸铜),挹其水熬之,则成胆矾(出自《梦溪笔谈》)
3. 化学与生产生活密切相关,下列说法不正确的是
A.铁粉有还原性可作吸氧剂
B.生石灰能与水反应可作干燥剂
C.福尔马林能杀菌防腐可作食品保鲜剂
D.明矾能水解形成胶体可作净水剂
4. 117号元素Ts的原子最外层电子数是7,下列说法不正确的是
A.Ts是第七周期第ⅦA族元素 B.还原性:I−<Ts−
C.原子半径:I<Ts D.中子数为176的TS的核素符号:
5.下列解释工业生产或应用的化学用语中,不正确的是
A.氯碱工业中制备氯气:2NaCl(熔融) 2Na + Cl2↑
B.工业制硫酸的主要反应之一:2SO2 + O2 2SO3
C.氨氧化法制硝酸的主要反应之一:4NH3 + 5O2 4NO + 6H2O
D.利用铝热反应焊接铁轨:2Al + Fe2O3 Al2O3 + 2Fe
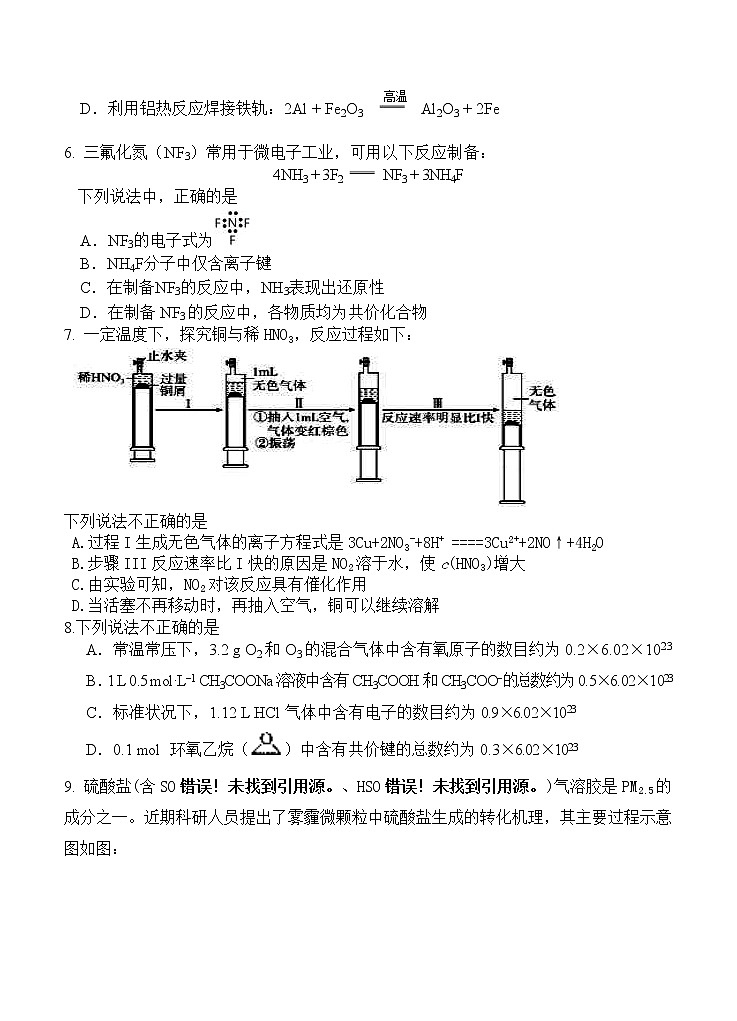
6. 三氟化氮(NF3)常用于微电子工业,可用以下反应制备:
4NH3 + 3F2 NF3 + 3NH4F
下列说法中,正确的是
A.NF3的电子式为
B.NH4F分子中仅含离子键
C.在制备NF3的反应中,NH3表现出还原性
D.在制备NF3的反应中,各物质均为共价化合物
7. 一定温度下,探究铜与稀HNO3,反应过程如下:
下列说法不正确的是
A.过程I生成无色气体的离子方程式是3Cu+2NO3-+8H+ ====3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,再抽入空气,铜可以继续溶解
8.下列说法不正确的是
A.常温常压下,3.2 g O2和O3的混合气体中含有氧原子的数目约为0.2×6.02×1023
B.1 L 0.5 mol·L−1 CH3COONa溶液中含有CH3COOH和CH3COO−的总数约为0.5×6.02×1023
C.标准状况下,1.12 L HCl气体中含有电子的数目约为0.9×6.02×1023
D.0.1 mol 环氧乙烷()中含有共价键的总数约为0.3×6.02×1023
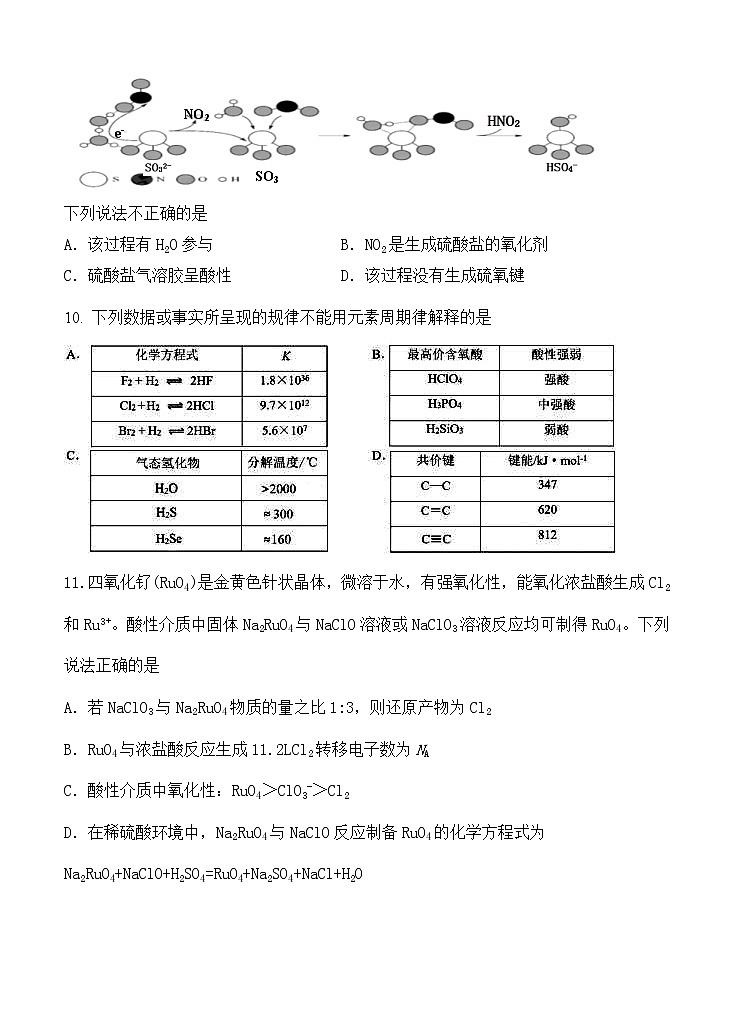
9. 硫酸盐(含SO错误!未找到引用源。、HSO错误!未找到引用源。)气溶胶是PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
下列说法不正确的是
A.该过程有H2O参与 B.NO2是生成硫酸盐的氧化剂
C.硫酸盐气溶胶呈酸性 D.该过程没有生成硫氧键
10. 下列数据或事实所呈现的规律不能用元素周期律解释的是
11.四氧化钌(RuO4)是金黄色针状晶体,微溶于水,有强氧化性,能氧化浓盐酸生成Cl2和Ru3+。酸性介质中固体Na2RuO4与NaClO溶液或NaClO3溶液反应均可制得RuO4。下列说法正确的是
A.若NaClO3与Na2RuO4物质的量之比1:3,则还原产物为Cl2
B.RuO4与浓盐酸反应生成11.2LCl2转移电子数为NA
C.酸性介质中氧化性:RuO4>ClO3->Cl2
D.在稀硫酸环境中,Na2RuO4与NaClO反应制备RuO4的化学方程式为Na2RuO4+NaClO+H2SO4=RuO4+Na2SO4+NaCl+H2O
12. 结构式为Q2+的化合物是治疗缺铁性贫血药物的一种。其中X、Y、Z为原子序数依次增大的短周期主族元素且均为非金属元素,Z是地壳中含量最多的元素。下列叙述正确的是.
A.简单氢化物的稳定性:Y>Z
B.该化合物中X、Y、Z均满足8电子稳定结构
C.Z与其他三种元素均可形成不少于2种的二元化合物
D.Q在工业上常用热分解法冶炼
13. 研究金属钠的性质,实验如下:
实验装置 | 实验方案 | |
液体a | 现象 | |
蒸馏水 | Ⅰ.钠浮在水面,剧烈反应,有少量白雾 | |
0.1 mol·L-1盐酸 | Ⅱ.钠浮在液面,反应比Ⅰ剧烈,有白雾产生 | |
浓盐酸 | Ⅲ.钠浮在液面,反应比Ⅰ缓慢,产生大量白雾,烧杯底部有白色固体 | |
下列说法不正确的是
A.Ⅱ中反应的离子方程式为2Na+2H+===2Na++H2↑
B.对比Ⅰ、Ⅱ、Ⅲ可知,随着c(H+)增大,反应的剧烈程度增大
C.实验Ⅰ、Ⅱ、Ⅲ均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测Ⅲ中浓盐酸的c(Cl-)以及生成的NaCl固体对反应剧烈程度有影响
14. 固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4、NaNO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
根据上述实验,下列说法正确的是
A.固体X中一定含有Fe2O3
B.沉淀E可能含有BaSO3
C.气体A、C一定均为纯净物
D.固体X可能出现含有K2SO3、K2CO3而不含Na2SO4的情况
15.“侯氏制碱法”的流程如下所示,下列说法错误的是
A.应先向饱和食盐水中通入NH3,再通入CO2
B.NaHCO3溶解度最小,可以从反应混合物中析出
C.母液中的溶质只有NH4Cl,可直接作氮肥
D.煅烧制纯碱时生成的CO2可重复利用
二、填空题(本题5大题,共55分)
16(5分)某0.2L无土栽培用的营养液中含有KCl、错误!未找到引用源。、错误!未找到引用源。三种溶质,测得该营养液中部分离子的浓度柱状图如图甲所示。
(1)该营养液中错误!未找到引用源。的物质的量浓度为______错误!未找到引用源。,含KCl的质量为____。
(2)该营养液中错误!未找到引用源。的物质的量为_____________。
(3)若错误!未找到引用源。不参与其他任何反应,将该营养液加水稀释,稀释过程中错误!未找到引用源。的浓度(c)随溶液体积(V)变化的曲线如图乙所示,则错误!未找到引用源。_______,错误!未找到引用源。__________。
17.(12分)
A、B、C、D是中学化学中的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如右图所示(反应中的其他产物已略去)。请填空:
(1)若B是常见的两性氢氧化物
①若D是强酸,则能确定A中肯定含的离子的化学式是________。
②若D是强碱,则反应②的离子方程式是___________________________。
(2)若A为淡黄色固体单质,D为空气中的主要成分,则请写出A与C的浓溶液发生反应的化学方程式 。
(3)若A、B、C的的焰色反应都呈黄色,D是一种无色无味的气态酸性氧化物,则反应③的离子方程式是 。
(4)若D是生产、生活中用量最大、用途最广的金属单质
①若单质A可用于自来水消毒,则请写出工业制取A的化学方程式 。
②若A是某强酸的稀溶液,则A的化学式可能是_________。
- (13分)
三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________。滤渣1的主要成分为____________(填化学式)。
(2)酸浸时双氧水的作用___________。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2污染环境,该反应的离子方程式为__________。
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+MNiOOH+MH。则放电时正极的电极反应式为__________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
19. (13分)CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s) + 3HCl(aq) ⇌ H3CuCl4(aq)。
(1)实验室用右图所示装置制取CuCl,反应原理为:
2Cu2+ + SO2 + 8Cl− + 2H2O == 2CuCl43− + SO42− + 4H+
CuCl43−(aq) ⇌ CuCl(s) + 3Cl−(aq)
① 装置C的作用是 。
② 装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。
操作ⅱ的主要目的是 ;操作ⅳ中宜选用的试剂有 。
③ 实验室保存新制CuCl晶体的方法是 。
④ 欲提纯某混有铜粉的CuCl晶体,请简述实验方案 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
已知:i. CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
① D、F洗气瓶中宜盛放的试剂分别是 、 。
② 写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
20. (12分)
N、P、错误!未找到引用源。均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
(1)下列某一个状态的N在跃迁时,用光谱仪可捕捉到发射光谱的是_________(填字母代号,下同),未成对电子最多的是_________。
a.错误!未找到引用源。 b.错误!未找到引用源。 c. 1s12s22p4 d.错误!未找到引用源。
(2)错误!未找到引用源。、P与S是同周期中相邻的元素,错误!未找到引用源。、P、S的电负性由大到小的顺序是_________,第一电离能由大到小的顺序是___________。
(3)吡啶为含N有机物,这类物质是合成医药、农药的重要原料。下列吡啶类化合物A与错误!未找到引用源。(即错误!未找到引用源。)反应生成有机化合物B,B具有优异的催化性能。
吡啶类化合物A中N原子的杂化类型是__________,化合物A易溶于水,原因是_____________________。含错误!未找到引用源。有机物B的分子结构中含__________(填字母代号)。
A.离子键 B.配位键 C.错误!未找到引用源。键 D.错误!未找到引用源。键 E.氢键
(4)N与金属可形成氮化物,如错误!未找到引用源。的晶体结构如图1所示,某种氮化铁的结构如图2所示。
①错误!未找到引用源。晶体结构单元中,含有的错误!未找到引用源。、N原子个数均是_______________;
②若该氮化铁的晶胞边长为错误!未找到引用源。,阿伏加德罗常数的值为错误!未找到引用源。,则该氮化铁的晶体密度可表示为________________错误!未找到引用源。。
参考答案
一、单项选择题(本部分共15题,每题3分,共45分)
题序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | A | A | C | D | A | C | B |
8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
D | D | D | D | C | B | D | C |
16.(5分)
4.0 (1分) 14.9g(1分) 1.6mol (1分) 0.2 (1分) 1.0 (1分)
17.(12分)
(1)①AlO2- (2分) ②Al(OH)3+OH— =AlO2— +2H2O(2分)
(2)S+2H2SO4(浓)△3SO2↑+2H2O(2分)
(3)OH—+HCO3—=CO32—+H2O(2分)
(4)①2NaCl+2H2O电解2NaOH+H2↑+Cl2↑(2分)
②HNO3(2分)
18.(13分)
(1). 增大固体与液体的接触面积,使酸浸速率更快,酸浸更充分(1分) MnO2 (1分)
(2). 将亚铁离子氧化为铁离子 (1分) Co2O3+6H++2Cl-= 2Co2++ Cl2↑+3H2O (2分)
(3). 分液漏斗、烧杯(2分) NiOOH+e-+H2O= Ni(OH)2 +OH-(2分)
(4).2 Co2++HCO3-+3NH3.H2O=Co2(OH)2CO3↓+3NH4++H2O (2分) 2Co2(OH)2CO3+O22Co2O3+2CO2+2H2O(2分)
19.(13分)
(1)① 吸收SO2尾气 (1分)
② 促进CuCl固体析出、防止CuCl被氧化 (2分)
水、稀盐酸、乙醇 (2分)
③ 避光、密封 (2分)
④ 将固体溶于浓盐酸后过滤,取滤液加入大量水,过滤,洗涤,干燥 (2分)
(2)① NaOH溶液(或“KOH溶液”“Ba(OH)2溶液”等其他合理答案) (1 分)
CuCl的盐酸溶液 (1 分)
② 2S2O42−+3O2+4OH− == 4SO42−+2H2O (2分)
20.(12分)
(1)c(1分) d(1分)
(2)错误!未找到引用源。(1分) 错误!未找到引用源。(1分)
(3)错误!未找到引用源。 (1分)化合物A与水分子间存在氢键(1分) BCD(2分)
(4)6(2分) 错误!未找到引用源。(2分)








