






人教版 (2019)选择性必修1第二节 电解池课文配套ppt课件
展开
这是一份人教版 (2019)选择性必修1第二节 电解池课文配套ppt课件,共60页。PPT课件主要包含了红色物质,析出金属铜,产生了氯气,OH-,氧化还原,化学能,2电解电解质型,课堂回眸等内容,欢迎下载使用。
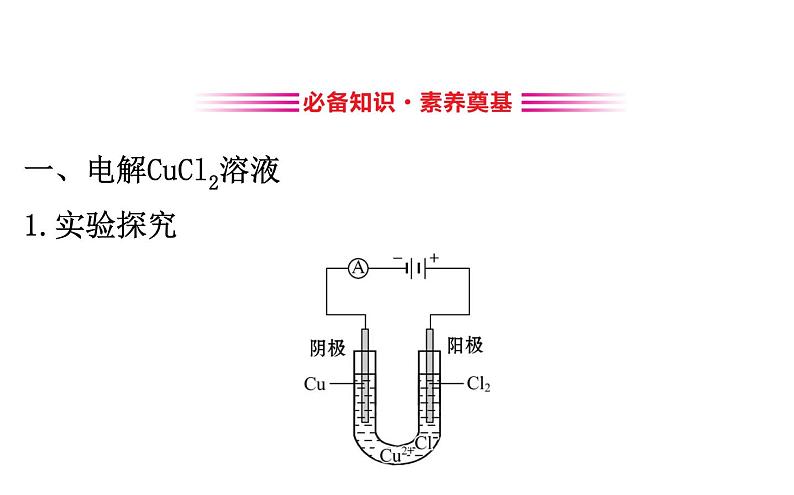
一、电解CuCl2溶液1.实验探究
2.原理探究(1)氯化铜溶液中的电离过程有①_________________,②______________;溶液中存在的离子有_________________,通电前,这些离子在溶液中作自由运动。
CuCl2====Cu2++2Cl-
H2O H++OH-
Cu2+、Cl-、H+、
(2)通电时,在电场的作用下,溶液中的离子作定向运动,即________趋向阳极,________趋向阴极。(3)阳极电极反应式是_________________,阴极电极反应式是______________,总反应式是______________________。(4)结论:电解质溶液的导电过程,就是电解质溶液的_____过程。
2Cl--2e-====Cl2↑
Cu2++2e-====Cu
Cu2++2Cl- Cu+Cl2↑
【巧判断】(1)电解质溶液的导电过程就是电解质溶液被电解的过程。( )提示:√。电解质被电解出的离子的定向移动的过程就是电解质溶液的导电过程。
(2)直流电源跟电解池连接后,电子从电源负极流向电解池阳极。( )提示:×。电子从电源负极流向电解池阴极。(3)电解CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色。( )提示:×。阴极析出单质铜,阳极析出氯气。
二、电解原理1.电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起_________反应的过程。2.电解池(1)定义:电解池是把_____转化为_______的装置。
(2)电解池的构成条件:①有外接直流电源。②有与电源相连的两个电极。其中与_____正极相连的叫_____,与电源负极相连的叫_____。③电解质溶液或熔融电解质。④形成闭合回路。
(3)电极名称及电极反应式(以惰性电极电解CuCl2溶液为例)
(4)电子和离子移动方向电子:从电源负极流向电解池的阴极,从电解池的阳极流向电源的正极。离子:阳离子移向电解池的阴极;阴离子移向电解池的阳极。
【巧判断】(1)电解池能将化学能转化为电能。( )提示:×。电解池能将电能转化为化学能。(2)电解质溶液导电属于化学变化。( )提示:√。电解质溶液导电过程是电解质被电解的过程。
(3)电解池的阳极与电源的负极相连。( )提示:×。电解池的阳极与电源的正极相连。(4)放电是失去电子发生还原反应的过程。( )提示:×。放电是指离子到达电极时,失去或获得电子,发生氧化反应或还原反应的过程。
【微思考】在电解池中,断开电路和闭合电路时,离子的移动方向是什么?提示:断开电路时,离子趋向杂乱无章的运动;闭合电路时,电解池工作,阴离子趋向阳极,阳离子趋向阴极。
知识点一 电解池中电极及电解产物的判断 【重点释疑】1.电解池的工作原理接通外界电源后,电子从电源的负极沿导线流入电解池的阴极,经过阴、阳离子的定向运动形成内电路,再从电解池的阳极流出,并沿导线流回电源的正极,如图所示。
2.电解池的阴、阳极的判断方法
3.电解时电极产物的判断
【易错提醒】(1)水溶液中,K+、Na+、Mg2+、Al3+等离子不可能在阴极放电,即使用电解相应水溶液的方法也不可能得到K、Na、Mg、Al等活泼金属。
(2)电解池的阴极不管是惰性电极(Pt、石墨)还是活性电极,都是电解质溶液(或熔融电解质)中的阳离子放电,电极本身不可能溶解。(3)若阴极为H+放电,则阴极区c(OH-)增大;若阳极为OH-放电,则阳极区c(H+)增大;若阴极为H+放电,同时阳极为OH-放电,相当于电解水,电解质溶液浓度增大(饱和溶液例外)。
【思考·讨论】(1)在电解CuCl2溶液的过程中,闭合回路是如何形成的?
提示:电解CuCl2溶液时,电子从电源负极流出,流向电解池的阴极,阴极附近的Cu2+在阴极得电子被还原为铜,溶液中的阴阳离子定向移动,阳极附近的Cl-在阳极失电子被氧化为氯原子,氯原子两两结合形成氯气分子,失去的电子从阳极流回电源的正极,从而形成了闭合电路。
(2)在氯化铜溶液中除了Cu2+ 和Cl-之外还有H+和OH-,这两种离子为什么没有得到或失去电子?
提示:电解时,溶液中离子的放电先后顺序与离子的氧化性或还原性有关,氧化性强的阳离子先得电子被还原,还原性强的阴离子先失电子被氧化。Cu2+比H+更容易得电子,而Cl-比OH-更容易失电子,可从氧化性强弱的角度比较得电子的顺序,从还原性强弱的角度比较失电子的顺序。
【案例示范】【典例】(2020·龙岩高二检测)如图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2B.两极产生的气体均有刺激性气味C.通电一段时间后,稀Na2SO4溶液酸性增强D.a电极附近呈无色,b电极附近呈红色
【思维建模】解答有关氧化还原反应概念问题的思维流程如下:
【解析】选A。a为阴极,电解时a电极上得电子发生还原反应生成氢气同时生成氢氧根离子,电极反应式为2H2O+2e-====H2↑+2OH-,所以有氢气生成,A正确;阴极生成氢气、阳极生成氧气,所以生成的气体都是无色无味的,B错误;阴极上生成氢气、阳极生成氧气,所以实质上是电解水,硫酸钠的物质的量不变,溶液体积减小,
则硫酸钠物质的量浓度增大,溶液仍然呈中性,溶液酸性不变,C错误;a电极附近生成氢氧根离子导致溶液呈碱性,b电极附近生成氢离子导致溶液呈酸性,所以a电极附近溶液变红色,b电极附近溶液呈无色,D错误。
【母题追问】(1)a极附近溶液pH如何变化?如何书写电极反应方程式?提示:增大 2H2O+2e-====H2↑+2OH-。(2)b极上产生什么气体?如何书写电极反应方程式?提示:O2 4H2O-4e-====O2↑+4H+。
【规律方法】判断电极产物注意事项(1)先看阳极材料,若为活性电极,则阳极材料被溶解;若为惰性电极,则根据阴离子的放电顺序判断谁先放电,且注意溶液中OH-的存在。
(2)不论阴极是什么材料,都按照阳离子放电顺序判断谁先放电,并注意溶液中H+的存在。(3)注意电解物质的状态,是电解质溶液还是熔融电解质。
【迁移·应用】(2020·福建师大附中高二检测)如图为用惰性电极电解CuCl2溶液的实验装置,则下列说法正确的是( )A.a电极为负极B.溶液中的Cu2+向a极移动C.电解一段时间后溶液的颜色会变浅D.电极b上发生的电极反应式为2Cl--2e-====Cl2
【解析】选C。a电极与电源的正极相连,它是电解池的阳极,A错误;溶液中的Cu2+向阴极b极移动,B错误;溶液的颜色主要取决于溶液中Cu2+的浓度,电解一段时间后,溶液中的Cu2+在阴极因不断放电而使其浓度不断减小,所以溶液的颜色不断变浅,C正确;电极b为阴极,发生的电极反应式为Cu2++2e-====Cu,D错误。
【补偿训练】1.(2020·张家口高二检测)如图所示,装置连接好后,电流计指针发生了偏转,下列说法中正确的是( )A.锌是负极B.两个铜片上均发生氧化反应C.石墨作阴极D.两个番茄及相关电极均构成了原电池
【解析】选A。A、装置中依据活泼性差别判断,锌为原电池负极,选项A正确;B、原电池中铜电极发生还原反应,右装置是电解池,铜电极上发生还原反应,选项B错误;C、石墨和原电池正极相连作电解池的阳极,选项C错误;D、左装置是原电池,右装置是电解池,选项D错误。
2.(2020·合肥高二检测)如图所示,x、y分别是直流电源的两极,通电后发现a极板处有无色、无味的气体放出,b极板质量增加,符合这一情况的是( )
【解析】选C。该装置是电解池,通电后发现b极板质量增加, a极板处有无色无味的气体放出,说明b电极是阴极、a电极是阳极,阳极上氢氧根离子放电生成氧气,则阳极应该是惰性电极;阴极上析出金属,在金属活动性顺序中该金属应该位于氢元素之后,x是正极、y是负极。A.x是正极,Zn是阳极、石墨是阴极,阳极上锌放电生成
锌离子、阴极上铜离子放电生成Cu,所以不符合条件;B.x是正极、y是负极,阴极上氢离子得电子生成氢气,没有固体生成,不符合条件;C.x是正极,阳极上氢氧根离子失电子生成氧气,阴极上银离子得电子生成银单质,质量增加,与题意相符;D.x是正极,与题干不相符。
【素养提升】 硼酸溶于水、酒精、甘油、醚类及香精油中,水溶液呈弱酸性。大量用于玻璃(光学玻璃、耐酸玻璃、耐热玻璃、绝缘材料用玻璃纤维)工业,可以改善玻璃制品的耐热、透明性能,提高机械强度,缩短熔融时间。H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图。
(1)请书写M室发生的电极反应式。提示:2H2O-4e-====O2↑+4H+。M室为阳极室,发生氧化反应,电极反应式为2H2O-4e-====O2↑+4H+。
(2)比较N室中a%和b%的大小关系。提示:a%H+>Pb2+>Fe2+>Zn2+……(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。其放电顺序:活泼金属阳极>S2->I->Cl->OH->含氧酸根。
2.做到“三看”,正确书写电极反应式(1)一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定失电子(注:Fe生成Fe2+)。(2)二看介质,介质是否参与电极反应。(3)三看是否有特殊信息(如题目信息),若电解目的是制取氧化铝,则阳极产物不能是Al3+。
3.电解池中方程式书写的3个关键点(1)书写电解池中电极反应式时,一般以实际放电的离子表示,但书写总电解反应方程式时,弱电解质一定要写成化学式。
(2)电极反应的书写首先根据题干要求及信息大胆写出反应物和生成物,然后根据“阴(极)得(e-)阳(极)失(e-)”加上得失电子数目,最后根据电解质溶液酸碱性补上H+、OH-或H2O,依据电荷守恒配平。(3)要确保两极得失电子数目相等,且总反应注明条件“电解”。
4.酸、碱、盐溶液电解规律(惰性电极)用惰性电极电解下列酸、碱、盐溶液:(1)电解水型
(3)电解质和水都发生电解型
【易错提示】电解质溶液复原(1)从元素角度,“缺什么,补什么”,如电解HCl溶液时产生H2、Cl2,需通入HCl气体即可复原,但并不能加入盐酸,因为盐酸除含HCl外,还含H2O。(2)需要加入金属氧化物复原的,加入对应碳酸盐也可复原,但不能加入氢氧化物。
【思考·讨论】(1)有下列两组离子:①Cu2+、Na+、H+、Ag+;②Cl-、I-、 、OH-。电解时,移向阳极的离子是哪一组?离子放电的先后顺序是什么?移向阴极的离子是哪一组?离子放电的先后顺序是什么?提示:②;I->Cl->OH-> ;①;Ag+>Cu2+>H+>Na+。
(2)电解硫酸铜溶液,在阴极上和阳极上析出产物的物质的量之比为多少?提示:电解CuSO4溶液,阴极产物是Cu,阳极产物是O2,由于两电极通过电量相等,故生成Cu与O2的物质的量之比为2∶1。
【案例示范】【典例】(2020·内蒙古高二检测)能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如图所示装置探究化学能与电能的相互转化:
(1)甲池是____________装置,通入O2的电极上的反应式为____________________________________。 乙池中 移向________电极(填“石墨”或“Ag”)。
(2)当甲池消耗标准状况下33.6 L O2时,电解质KOH的物质的量变化____________ml,乙池若要恢复电解前的状态则需要加入____________(填所加物质的质量及化学式)。 (3)丙池中发生的电解反应的离子方程式为_____________________________________。
【思维建模】解答有关电解装置分析及电极反应书写试题的思维流程如下:
【解析】(1)由图可看出甲图为燃料电池装置,是原电池(或化学能转化为电能);通入氧气的电极为正极,其电极反应式为O2 + 4e-+2H2O====4OH-;乙图和丙图为电解池,与电池的正极相连的石墨为阳极,与电池的负极相连的Ag电极为阴极,则乙池中 移向石墨电极(阳极)。
(2)原电池正极反应式为O2+4e-+2H2O====4OH-,总反应为CH4+2O2+2OH-=== + 3H2O,当甲池消耗标准状况下33.6 L(1.5 ml) O2时,则消耗1.5 ml KOH,转移6 ml电子,则乙池生成3 ml Cu和1.5 ml O2,根据原子守恒,若要恢复电解前的状态则需要加入氧化铜:3 ml×80 g·ml-1=240 g,或碳酸铜:3 ml×124 g·ml-1=372 g。
(3)丙池中惰性电极电解氯化钠溶液,电解反应的离子方程式为2Cl-+2H2O Cl2↑ + H2↑ + 2OH-。
答案:(1)原电池(或化学能转化为电能)O2 + 4e-+2H2O====4OH- 石墨(2)1.5 240 g CuO(或372 g CuCO3)(3)2Cl-+2H2O Cl2↑ + H2↑ + 2OH-
【母题追问】(1)乙池中石墨电极、Ag电极上电极反应式如何书写?提示:石墨电极:2H2O-4e-====O2+4H+;Ag电极:Cu2++2e-====Cu。
(2)丙池中左Pt电极、右Pt电极上电极反应式如何书写?提示:左Pt电极:2Cl--2e-====Cl2;右Pt电极:2H2O+2e-====H2↑+2OH-。(3)丙池若要恢复电解前的状态则需要加什么物质?提示:HCl气体
【规律方法】“信息型”电极反应式的书写(1)仔细分析“文字”信息或“图片”信息,找出阴、阳极及电解质溶液。(2)可利用阴、阳离子在阳极、阴极的放电顺序确定电极产物,利用电荷守恒思想配平。
【迁移·应用】1.(2020·福州高二检测)某化学兴趣小组利用如图装置在铁棒表面镀上一层铜,下列有关的判断正确的是( )A.a为阳极、b为阴极 B.c为铁棒、d为铜棒C.电子流向从b→d→c→aD.溶液中Cu2+向d极移动
【解析】选D。根据上述分析,a为正极、b为负极,故A错误;根据分析c为阳极,d为阴极,因此c为铜棒、d为铁棒,故B错误;电子只能在导体内流动,不能在溶液中流动,不能出现d→c的流动过程,故C错误;电解池溶液中阳离子向阴极移动,即Cu2+向d极移动,故D正确。
2.某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在图中,下列有关分析完全正确的是( )
【解析】选B。根据题图知,该装置有外接电源,所以属于电解池,根据电子流向知,c是负极,d是正极,a是阴极,b是阳极,电解时,电解质溶液中阳离子向阴极移动,阴离子向阳极移动,则Q是阳离子,P是阴离子,故B正确。
【补偿训练】1.(2019·镇江高二检测)化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室进行实验验证。他们设计组装了如图所示装置,已知a为石墨电极,b为铁电极,c为铝电极(已除去表面氧化膜),d为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流表指针发生明显偏转。下列判断正确的是( )
A.b为负极,d为阳极B.一段时间后,a和d电极附近溶液变红C.b电极的电极反应式为2Cl--2e-====Cl2↑D.电解一段时间,当B中出现大量白色沉淀时,停止实验,再将A中溶液倒入B中混合,充分振荡,沉淀全部消失
【解析】选D。右侧装置为原电池,左侧装置为电解池。在右侧装置中,通入O2的电极为原电池的正极,其电极反应式为O2+4e-+2H2O====4OH-,所以一段时间后d电极附近溶液变红,Al为原电池的负极,Al失去电子生成Al3+,Al3+与溶液中的OH-反应生成白色Al(OH)3沉淀,电池总反应式为4Al+3O2+6H2O====4Al(OH)3,a与电池的正
极相连,故a为电解池的阳极,b与电池的负极相连,故b为电解池的阴极,电解饱和NaCl溶液时,Cl-在a极放电生成Cl2,H+在b极放电生成H2,故一段时间后b电极附近溶液变红。根据得失电子守恒,A中产生的NaOH与B中Al3+结合的OH-物质的量相等,所以电解一段时间后,将A、B混合并充分振荡,Al(OH)3能被NaOH全部溶解。
2.(2020·武汉高二检测)用石墨作电极,电解稀Na2SO4溶液的装置如图所示,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是( )
A.逸出气体的体积:A电极c(OH-),石蕊溶液变红,Na+、H+移向A电极,在A电极H+放电产生H2,A电极附近c(OH-)>c(H+),石蕊溶液变蓝,C项错误、D项正确;A电极产生的气体体积大于B电极,A项错误;两种气体均为无色无味的气体,B项错误。
【素养提升】含有氰化物的废水危害极大,能毒杀各种鱼类和水生物。c(CN-)在0.01~0.04 mg·L-1时,就有强烈的毒杀作用。用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,
(1)若用石墨和铁作电极材料,哪者为阳极?哪者为阴极?提示:石墨 铁。若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极。
(2)如何书写阳极、阴极的电极反应式?提示:Cl-+2OH--2e-====ClO-+H2O2H2O+2e-====H2↑+2OH-。阳极Cl-放电生成ClO-,氯元素的化合价升高,故在阳极发生氧化反应,由已知该溶液呈碱性。阳离子在电解池的阴极得电子发生还原反应,在碱性条件下,H2O提供阳离子(H+)。
(3)写出除去CN-的离子反应方程式。提示:2CN-+5ClO-+H2O====N2↑+2CO2↑+5Cl-+2OH-。由于溶液是碱性条件,故除去CN-发生的反应为2CN-+5ClO-+H2O====N2↑+2CO2↑+5Cl-+2OH-。
相关课件
这是一份高中人教版 (2019)第二节 电解池背景图课件ppt,共43页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 电解池教案配套课件ppt,共31页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学第二节 电解池作业课件ppt,共26页。PPT课件主要包含了∶2∶4∶1等内容,欢迎下载使用。










