





高中化学鲁科版 (2019)必修 第二册第2节 元素周期律和元素周期表示范课ppt课件
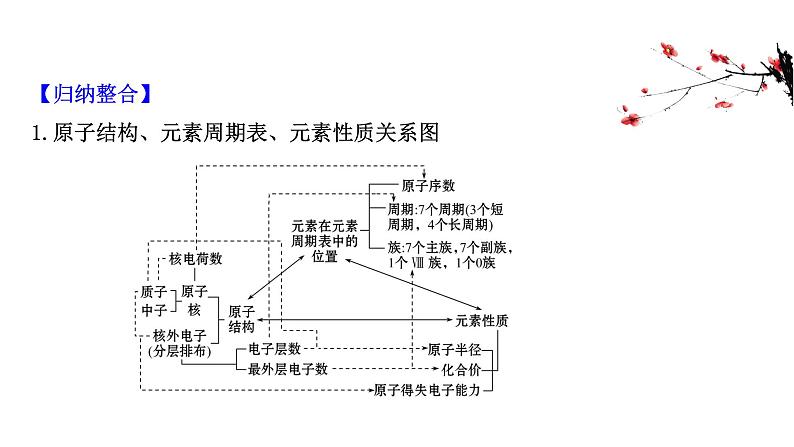
展开【归纳整合】1.原子结构、元素周期表、元素性质关系图
【典例示范】【典例】(2019·北京高考改编)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是( )A.In是第五周期ⅢA族元素B. In的中子数与电子数的差值为17C.原子半径:In>AlD.金属性:In>Rb
【解析】选D。In为49号元素,根据元素周期表中元素的排布规律,In是第五周期ⅢA族元素,故A正确 In的中子数为115-49=66,电子数为49,中子数与电子数的差值为66-49=17,故B正确;In是第五周期ⅢA族元素,Al为第三周期ⅢA族元素,依据元素周期律,原子半径:In>Al,故C正确;In和Rb同为第五周期元素,二者电子层数相同,核电荷数越大,原子的失电子能力越弱。因此金属性In
【素养训练】1.(2020·徐州高一检测)元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )A.元素原子的最外层电子数等于元素的最高化合价B.原子的最外层电子数相同的元素,一定属于同一族C.若M+和R2-的核外电子层结构相同,则原子序数:M>RD.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
【解析】选C。元素原子的最外层电子数不一定等于元素的最高化合价,如氟没有正化合价,氦没有+2价,过渡元素最外层有1或2个电子,但最高正价多数高于+1和+2价,A不正确;Be和He的最外层电子数都是2,但不属于同一族,B不正确;若M+和R2-的核外电子层结构相同,原子序数M > R,C正确;过渡元素是指副族和Ⅷ族元素,D不正确。
2.(2020·重庆高一检测)几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )A.Y的最高价氧化物对应的水化物显两性B.放电条件下,Z单质与W的常见单质直接生成ZW2C.X、Y元素的金属性:X
【解析】选C。由于X、Y、Z都属于短周期,则X一定是第1周期,而第1周期只有两种元素,X一定是He,不难判断出Y、Z分别为F、S。He为稀有气体,化学性质非常稳定,是单原子分子,A、D错误;F是最活泼的非金属元素,没有正价,B错误;硫原子的最外层电子数是6,C正确。
4.工业上用铝土矿(主要成分是Al2O3)经过除杂等操作后得到纯净的Al2O3,然后用电解熔融Al2O3的方法制取金属铝,通常在电解过程中加入冰晶石(NaAlF6)。 上述材料中共涉及两种物质、四种元素,据此回答下列问题:
(1)四种元素原子半径的大小顺序是什么?提示:r(Na)>r(Al)>r(O)>r(F)。由于Na、Al的电子层数相同,而Al的原子序数大,因此半径比Na的小,同理F的原子半径比O的小;Al和O的原子半径可以通过S原子进行比较,因为Al与S原子电子层数相同而原子序数Al比S小,所以Al的半径大于S的,而O、S的最外层电子数相同,而S的电子层数多,因此S的半径大,所以有r(Al)>r(S)>r(O)。(2)四种元素形成的简单离子的半径大小顺序是什么?提示:r(O2-)>r(F-)>r(Na+)>r(Al3+)。四种离子的电子层结构相同,因此原子序数越大,离子半径越小
(3)四种元素的最高化合价是否都等于其原子的最外层电子数?提示:否。四种元素中O没有最高正化合价,F没有正化合价,而Na、Al元素的最高正化合价等于其原子的最外层电子数。
【加固训练】 1.(2020·聊城高一检测)A元素原子最外层电子数是次外层电子数的3倍,B元素原子最外层电子数是内层电子总数的一半,则A、B元素( )A.B元素一定是锂元素B.一定是第2周期元素C.可能是第2、3周期元素D.A、B两元素不能形成化合物【解析】选C。A元素原子最外层电子数是次外层电子数的3倍,是氧元素;B元素原子最外层电子数是内层电子总数的一半,可以是磷元素,也可以是锂元素。
2.元素在周期表中的位置和原子结构密切相关。下面是原子结构和元素在周期表中的位置的相关问题,试根据所学知识进行回答。(1)已知某元素的原子结构示意图为 ,据此推测该元素在周期表中的位置?提示:电子层数=周期序数,最外层电子数=主族序数,故该元素位于第3周期ⅢA族。
鲁科版 (2019)必修 第二册第2节 化学反应与能量转化复习ppt课件: 这是一份鲁科版 (2019)必修 第二册第2节 化学反应与能量转化复习ppt课件,PPT课件主要包含了点击右图进入等内容,欢迎下载使用。
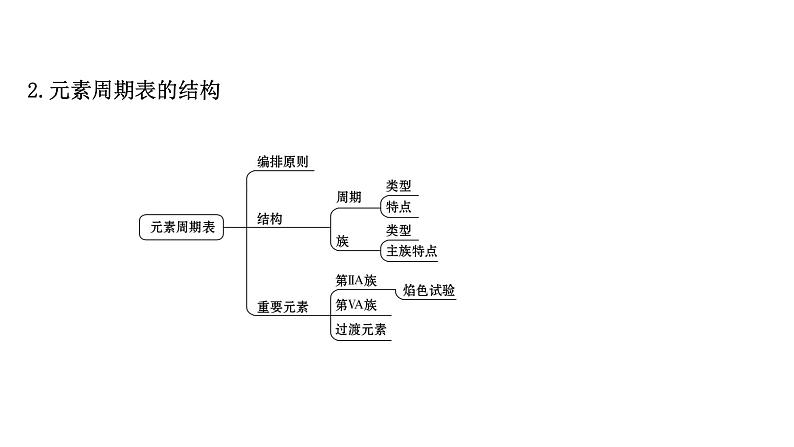
必修 第二册第3节 元素周期表的应用教学演示课件ppt: 这是一份必修 第二册第3节 元素周期表的应用教学演示课件ppt,共30页。
高中鲁科版 (2019)第2节 元素周期律和元素周期表课文配套ppt课件: 这是一份高中鲁科版 (2019)第2节 元素周期律和元素周期表课文配套ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,电子层数,铍Be,镁Mg,钙Ca,导电性,R2+,化合态,砷As,PAs等内容,欢迎下载使用。













