





高中化学鲁科版 (2019)必修 第二册第2节 元素周期律和元素周期表课堂教学课件ppt
展开1.质量数(A)=质子数(Z)+中子数(N),原子的质子数=核电荷数=核外电子数。2.原子的失电子能力与最外层电子数和电子层数有关,钠元素原子失电子的能力比镁强,氟元素原子得电子能力比氯元素原子得电子能力强。3.元素的化学性质主要由原子的最外层电子数决定。
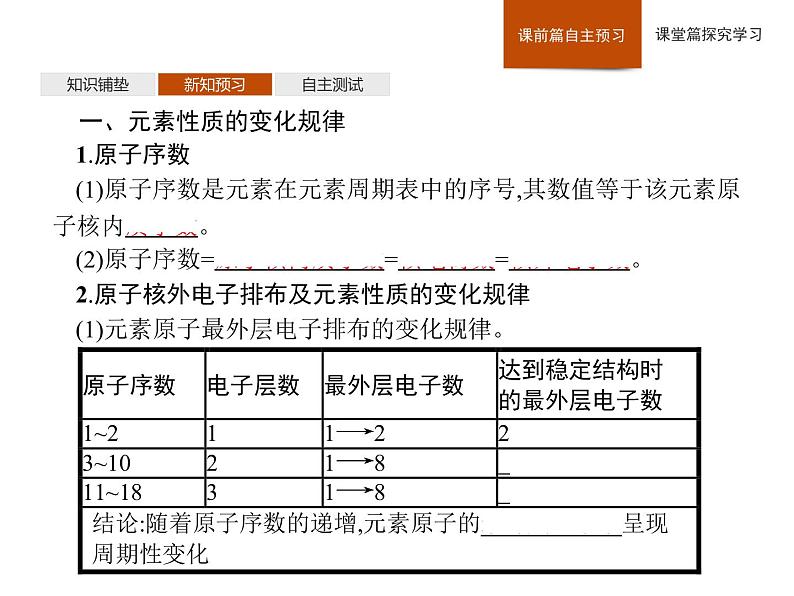
一、元素性质的变化规律1.原子序数(1)原子序数是元素在元素周期表中的序号,其数值等于该元素原子核内质子数。(2)原子序数=原子核内质子数=核电荷数=核外电子数。2.原子核外电子排布及元素性质的变化规律(1)元素原子最外层电子排布的变化规律。
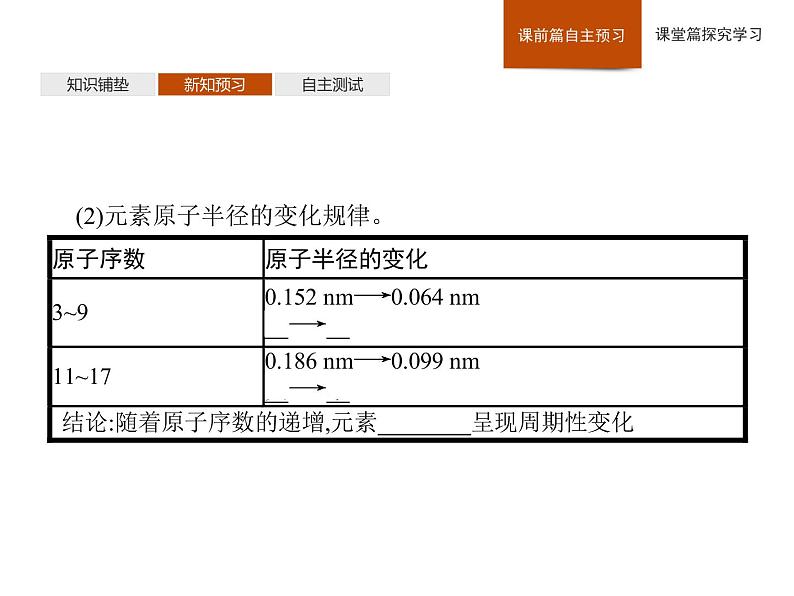
(2)元素原子半径的变化规律。
(3)元素化合价变化的规律。
通过探究可以发现,随着原子序数的递增,元素原子的最外层电子排布、原子半径、元素的化合价等均呈周期性变化。
二、元素周期律1.定义元素的性质随着元素原子序数的递增而呈周期性变化的规律。2.实质元素性质呈周期性变化是元素原子核外电子排布呈周期性变化的必然结果。【微思考】非金属元素的正价一定等于其原子最外层电子数吗?提示:不一定。非金属元素的正化合价等于在形成的化合物中原子所能偏移的最外层电子数,如硫元素原子最外层有6个电子,其正价有+4价、+6价。
1.元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )A.元素原子的核外电子排布呈周期性变化B.元素的原子半径呈周期性变化C.元素的化合价呈周期性变化D.元素的金属性、非金属性呈周期性变化答案:A
解析:由原子的电子排布可知,随原子序数的递增,原子的核外电子排布都呈现周期性的变化,从而引起元素性质的周期性变化,即原子的电子层排布的周期性变化是引起元素性质周期性变化的决定因素,故A项正确;元素的原子半径属于元素的性质,元素的原子半径的周期性变化是电子排布周期性变化的结果,故B项错误;化合价属于元素的性质,元素的最高正化合价的周期性变化是原子的核外电子排布周期性变化的结果,故C项错误;元素的金属性、非金属性的周期性变化是原子核外电子排布周期性变化的结果,故D项错误。
2.下列元素的常见化合价依次从+1价到+3价的是 ( )A.H、He、LiB.Na、Mg、AlC.Al、Be、NaD.N、O、F答案:B解析:A项中He的常见化合价为0价;C项中常见化合价依次为+3、+2、+1,与题目要求恰好相反;D项中F无正价。
3.元素的原子结构决定其性质。下列说法正确的是 ( )A.元素原子的最外层电子数等于元素的最高化合价B.多电子原子中,在离核较近的区域内运动的电子能量较高C.P、S、Cl得电子能力依次增强D.P、S、Cl最高化合价依次减小答案:C解析:多数原子的最外层电子数等于元素的最高化合价,但O、F及稀有气体元素不符合该规律,A项错误。多电子原子中,离核较近的电子能量较低,B项错误。P、S、Cl得电子能力依次增强,C项正确。P、S、Cl最高化合价依次增高,D项错误。
构成原子的微粒及其相互关系问题探究如何比较Na、Mg、Al元素原子半径的大小?,如何比较Na+、Mg2+、Al3+半径的大小?提示:Na、Mg、Al元素原子的电子层数相同,最外层电子数逐渐增多,核电荷数逐渐增大,原子核对外层电子的吸引力逐渐增大,半径逐渐减小。Na+、Mg2+、Al3+核外电子排布相同,核电荷数越大,原子核对外层电子的吸引力越大,半径越小。故原子半径:Na>Mg>Al,离子半径:Na+>Mg2+>Al3+。
知识归纳影响微粒半径的因素有:电子层数、核电荷数、核外电子数。一般地,电子层数越多,微粒半径越大;电子层数相同时,核电荷数越大,原子核对外层电子的吸引力越大,半径越小;当电子层数、核电荷数相同时,核外电子数越多,电子之间的斥力使半径趋于增大,故当电子层数、核电荷数相同时,核外电子数越多,半径越大。在比较微粒半径时,一般先看电子层数,再看核电荷数,后看核外电子数。(1)一看电子层数电子层数不同、最外层电子数相同时,电子层数越多,半径越大,如r(F)
典例剖析例1X和Y两种元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两种元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的大小关系是( )A.X>Y>ZB.Y>X>Z C.Z>X>YD.Z>Y>X答案:D解析:电子层结构相同的阳离子,核电荷数大的半径小;具有相同电子层数的原子,随着原子序数增大,原子半径减小。根据题意,X和Y两元素的阳离子具有相同的电子层结构,X的阳离子半径大于Y的阳离子半径,则X的原子序数小于Y的原子序数;Z和Y两元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,则Z的原子序数大于Y的原子序数。由此得出三种元素原子序数的关系为Z>Y>X。
变式训练1-1下列微粒半径的比较中,正确的是 ( )A.r(Na+)>r(Na)B.r(Cl-)>r(Cl)C.r(Ca2+)>r(Cl-)D.r(Mg)>r(Na)答案:B解析:同一种元素:r阳离子
元素化合价变化规律问题探究随着原子序数的递增,元素常见化合价的变化规律(元素主要化合价包括最高化合价和最低化合价)见下图:
你能根据 推测出该元素的最高正化合价和最低负化合价吗?提示:能;最高价为+6价,最低价为-2价。
知识归纳常见元素的化合价(1)氢元素的化合价有+1价、-1价、0价,如H2O、NaH、H2。(2)氟元素有0价和-1价,无正价。(3)氧元素常见化合价为-2价、-1价、0价,如CuO、Na2O2、O2,氧元素一般不显正价。(4)金属元素有0价和正价,无负价。(5)非金属元素既有正价又有负价,还有0价。(F除外)
(2)Y元素原子的最外层电子数是 。 (3)比较S2-和Y-的还原性: 。 答案:(1)+5 (2)7 (3)S2->Y-
解析:(1)根据电荷守恒得-n+(-2)×3+(+1)×6=-1,得n=1,代入
(2)由(1)及化学方程式知,Y有+5价、-1价两种价态,由于Y存在Y-,-1价是Y元素的最低化合价,其最外层电子数为8-1=7。(3)在题给反应中还原剂为S2-,还原产物为Y-,故还原性S2->Y-。
金属元素有正价、无负价。非金属元素既有正价又有负价,但F元素无正价,氧元素一般不显正价;一般地,最高正价存在于氧化物及酸根离子中,最低负价存在于氢化物中,最高正化合价+|最低负化合价|=8(H除外)。
变式训练2-1下列说法正确的是( )A.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数B.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数C.最外层有2个电子的原子都是金属原子D.金属元素只有正价和零价,而非金属元素既有正价又有负价和零价答案:B解析:非金属元素最低化合价的绝对值等于8减去对应原子的最外层电子数,A错误;非金属元素的最高正价等于该元素原子的最外层电子数(O、F除外),不会超过该数值,B正确;氦原子最外层有2个电子,C错误;并非所有非金属元素都有正价,如F无正价,D错误。
变式训练2-2原子序数小于20的X元素能形成H2X和XO2两种化合物,该元素的原子序数为( )A.8B.12C.15D.16答案:D解析:X元素在H2X中呈-2价,在XO2中呈+4价,根据-2价分析,该元素原子最外层应有6个电子,选项中只有原子序数为16的元素原子满足此条件。
1.已知下列元素的原子半径:
根据以上数据,磷原子的半径可能是( )×10-10m×10-×10-10m×10-10m答案:B解析:Si、P、S三种元素位于同一周期,原子半径Si>P>S,故磷的原子半径在1.06×10-10~1.17×10-10m之间,所以B项正确。
2.下列微粒半径大小比较正确的是( )A.Na
3.原子序数从11依次增大到17,下列所述递变关系错误的是( )A.原子电子层数不变B.从钠到铝金属性增强C.最高化合价数值逐渐增大D.从硅到氯最低化合价从-4→-1答案:B解析:原子序数11到17的元素,都具有3个电子层,电子层数相同,A项正确;同周期元素从左到右金属性逐渐减弱,B项错误;原子序数从11到17的元素在周期表同一周期,最高化合价依次增大,C项正确;原子序数从11到17的元素在周期表同一周期,从硅到氯最低化合价由-4价升高到-1价,D项正确。
4.(双选)已知原子序数小于18的元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是( )A.原子半径:A>B>D>CB.离子半径:C2->D->B+>A2+C.原子序数:d>c>b>aD.原子的最外层电子数目:D>C>A>B答案:BD解析:原子序数小于18的元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以其原子序数为a>b>d>c,原子半径为B>A>C>D,故A、C错误;离子的电子层结构相同,则原子序数小的半径大,所以离子半径为C2->D->B+>A2+,故B正确;原子的最外层电子数D>C>A>B,故D正确。
(1)按原子半径由大到小的顺序排列为 (填序号,下同)。 (2)按简单离子半径由大到小的顺序排列为 。 (3)微粒中质子数小于中子数的是 。 (4)能形成X2Y2型化合物的是 。 (5)通常情况下,化合价有0价、正价和负价的是 。 答案:(1)②③④① (2)④①②③ (3)①② (4)①②(5)④
高中鲁科版 (2019)第2节 元素周期律和元素周期表授课课件ppt: 这是一份高中鲁科版 (2019)第2节 元素周期律和元素周期表授课课件ppt,共36页。PPT课件主要包含了核外电子数,元素周期表,核电荷数,质子数,最外层电子数,主要化合价,元素原子序数,原子半径,元素的化合价,元素的主要化合价等内容,欢迎下载使用。
高中化学第1节 原子结构与元素性质图文课件ppt: 这是一份高中化学第1节 原子结构与元素性质图文课件ppt,共45页。PPT课件主要包含了电子数,质子数,质量数,中子数,相对原子质量,点击右图进入等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第2节 化学反应与能量转化说课ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第2节 化学反应与能量转化说课ppt课件,PPT课件主要包含了点击右图进入等内容,欢迎下载使用。













