





高中化学鲁科版 (2019)必修 第二册第2节 元素周期律和元素周期表课文配套ppt课件
展开学习任务一 元素周期律任务驱动: 元素的性质随着原子序数的递增呈现怎样的递变规律呢?1.原子序数:(1) 概念:元素在___________中的序号。(2)与其他量的关系:原子序数=_______=核电荷数=原子的___________。
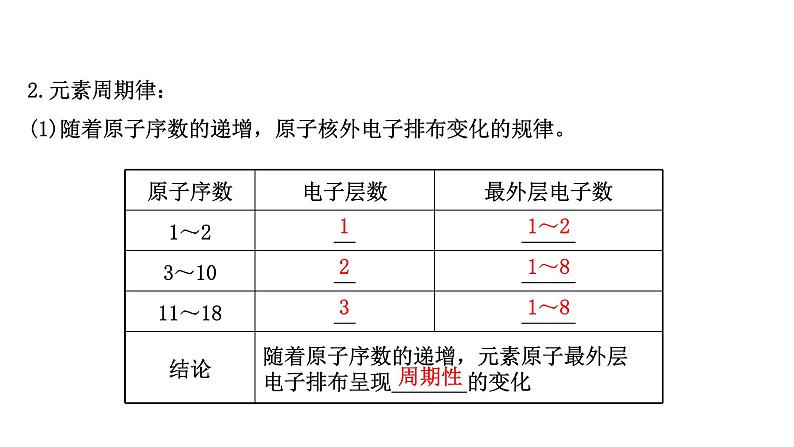
2.元素周期律:(1)随着原子序数的递增,原子核外电子排布变化的规律。
(2)随着原子序数的递增,元素原子半径变化的规律。
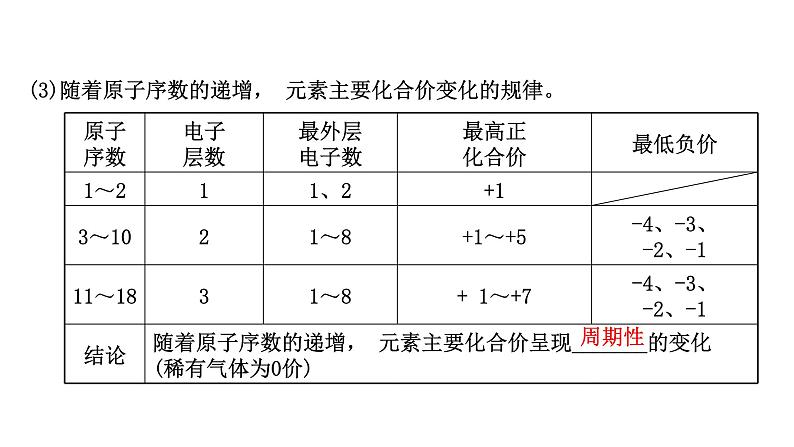
(3)随着原子序数的递增, 元素主要化合价变化的规律。
(4)结论:元素的性质___________________而呈周期性变化,这个规律叫元素周期律。(5)实质:元素周期律的实质是_________________的周期性变化。【想一想】元素的性质呈周期性变化的根本原因是什么?提示:元素的性质呈周期性变化的根本原因是核外电子排布呈周期性变化,其他周期性变化都是由它引起的。
学习任务二 元素周期表任务驱动: 已经发现的一百多种元素在元素周期表中是怎么排列的,这些元素的排布有什么规律吗?1.元素周期表的结构:(1)编排原则。①按_________递增顺序从左到右排列;②将_________相同的元素排成一横行,共有7个横行;③把_____________相同的元素按__________递增的顺序从上到下排成一纵列,共有___列。
(2)周期。7个横行,7个周期。
在第6周期和第7周期中有特殊的镧系和锕系元素。(3)族。18列,16个族。
(4)分区。①分界线:沿着元素周期表中_______________与___________________的交界处画一条虚线,即为金属元素区和非金属元素区分界线(氢元素除外)。②各区位置:分界线左下方为_________区,分界线右上方为___________区。③分界线附近元素的性质:既表现_________的性质,又表现___________的性质。
2.周期表中的部分重要元素:
3.焰色试验:多种_______________在灼烧时能使火焰呈现特殊的颜色,如钠:_____,钾:_____色(透过蓝色钴玻璃)。操作流程:灼烧→蘸取→蘸烧→清洗→洗烧
【想一想】元素周期表中所含元素种数最多的是哪一列?提示:第3列的元素最多,包含有镧系和锕系。
【情境·思考】元素周期表提供了每种元素的哪些信息?提示:在元素周期表中,每一种元素均占据一格。每一格均包含元素的原子序数、元素符号、元素名称、价电子排布、相对原子质量等内容。
探究任务一 元素周期律【教材情境】 “你以为我是坐着不动,五个戈比一行,五个戈比一行地写着,突然就成功了!事情并不是这样!这个问题(指发现元素周期律)我大约考虑了20年。”这是门捷列夫回答记者问题时所说的话。门捷列夫对那些认为他发现元素周期律是偶然而得、运气所至的提法非常恼火。门捷列夫发现元素周期律的过程是艰辛的,是一个长期不懈的探索过程。从门捷列夫正式提出元素周期律,到合成108号元素的一百年的时间里,人们发现或合成了46种元素,每一种元素的发现都证实了门捷列夫理论的正确性。
我们应该永远铭记门捷列夫的格言:“什么是天才?终身努力,便成天才!”
【问题探究】1.随着原子序数的递增,元素原子的最外层电子排布呈现怎样的变化规律?用柱状图和点状图表示。提示:随着原子序数的递增,元素原子的最外层电子排布呈现从1个递增到8个(一个电子层的例外)的规律,即逐步达到稳定结构的周期性变化。
2.随着原子序数的递增,元素原子半径呈现怎样的变化?请用坐标图画出来。提示:
3.随着原子序数的递增,元素的主要化合价呈现怎样的周期性变化?提示:
4.迁移应用:为什么教材中没有给出稀有气体的原子半径?提示:由于稀有气体的原子半径和其他元素的原子半径测量的标准不同,所以课本中没有给出其半径数值。
【探究总结】1.微粒的半径比较:微粒半径的大小主要由核电荷数、电子层数和核外电子数决定。(1)当电子层数和核电荷数均不同时,一般电子层数越多,半径越大,如H与S。(2)当电子层数相同,核电荷数不同时,核电荷数越大,半径越小,如Na与S。(3)当核电荷数相同,电子层数也相同时,核外电子数越多,半径越大,如Cl与Cl-。(4)当最外层电子数相同时,电子层数越多,半径越大,如Na与K。
2.元素主要化合价的确定:元素的主要化合价——最高正价和最低负价是由原子的最外层电子数决定的,它们与最外层电子数的关系为元素最高正化合价=最外层电子数(O、F除外);最低负价=最外层电子数-8。
【拓展提升】电子层结构相同的离子半径比较电子层结构相同,即核外电子排布相同,核外电子数相同。电子层结构相同的离子,随着原子序数的递增,半径逐渐减小,如Na+、Mg2+、Al3+。
【探究训练】1.(2020·全国Ⅰ卷)1934年约里奥—居里夫妇在核反应中用α粒子(即氦核 He)轰击金属原子 X,得到核素 Y,开创了人造放射性核素的先河: X He Y n其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( )A. X的相对原子质量为26B.X、Y均可形成三氯化物C.X的原子半径小于Y的D.Y仅有一种含氧酸
【解析】选B。原子轰击实验中,满足质子和质量数守恒,因此W+4=30+1,则W=27,X与Y原子之间质子数相差2,因X元素为金属元素,Y的质子数比X大,则Y与X位于同一周期,且Y位于X右侧,且元素X、Y的最外层电子数之和为8,设X最外层电子数为a,则Y的最外层电子数为a+2,解得a=3,因此X为Al,Y为P,以此解答。 Al的质量数为27,则该原子相对原子质量为27,故A错误;Al元素可形成AlCl3,P元素可形成PCl3,故B正确;Al原子与P原子位于同一周期,且Al原子序数小于P原子序数,故原子半径Al>P,故C错误;P的含氧酸有H3PO4、H3PO3、H3PO2等,故D错误。
2.下列各组元素性质递变情况中,错误的是( )A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正化合价依次升高C.N、O、F原子半径依次增大D.P、S、Cl元素的负化合价依次为-3、-2、-1
【解析】选C。本题主要考查对原子结构、原子半径、元素的最高正化合价和负化合价的变化认识规律。分析如下:
3.有下列四种微粒: O Na Mg N。(1)按原子半径由大到小的顺序排列为______(只填序号,下同)。 (2)按离子半径由大到小的顺序排列为_______。 (3)微粒中质子数小于中子数的是_______。 (4)能形成X2Y2型化合物的是_______。 (5)通常情况下,化合价有0价、正价和负价的是_______。
【解析】 Na与 Mg具有相同的电子层数,最外层电子数分别为1、2, O与 N具有相同的电子层数,最外层电子数分别为6、5;原子半径大小为23Na>24Mg>14N>18O;四种离子Na+、Mg2+、N3-和O2-核外电子排布相同,半径大小为r(Mg2+)
2.随着原子序数的递增,原子最外层电子数增多的是( )A.H、Be、Al B.He、O、NaC.C、F、SD.N、P、Cl【解析】选A。写出每个原子的核外电子排布,便可找出只有A项符合题意。
3.An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的离子半径由大到小的顺序为_______,对应的原子半径由大到小的顺序为 , 原子序数由大到小的顺序是__________。 【解析】根据四种离子具有相同的电子层结构可以推知,A、B同属于同一周期,C、D同属于同一周期,且A、B处于C、D的下一周期,然后根据各离子所带电荷可以推知A在B的前面,D在C的前面,故原子序数B>A>C>D,对应的原子半径A>B>D>C。最后由电子层结构相同的离子,核电荷数(原子序数)越大半径越小可知,离子半径D>C>A>B。答案:D>C>A>B A>B>D>C B>A>C>D
探究任务二 元素周期表【教材情境】 1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,制出了第一张元素周期表,这就是现代元素周期表的雏形。
【问题探究】1.周期表中每个横行为一个周期,每个纵列为一个族吗?提示:不一定。元素周期表有7个横行,每行为一个周期,共7个周期;有18个纵列,其中第Ⅷ族占三个纵列,其余每个纵列为一个族,共16个族。2.同一周期中,若第ⅡA族元素原子序数为a,则第ⅢA族元素原子序数可能是多少?提示:若为第2、3周期,则第ⅢA族元素的原子序数为a+1,若为第4、5周期,则第ⅢA族元素的原子序数为a+11,若为第6周期,则第ⅢA族元素的原子序数为a+25。
3.元素周期表中位于同一周期的元素,原子结构有何异同?同一主族呢?提示:同周期元素的原子,电子层数相同,最外层电子数随原子序数的递增逐渐增加;同主族元素的原子,最外层电子数相同,电子层数和核电荷数随原子序数的递增逐渐增多。4.主族元素的最外层电子数与族序数、元素最高正化合价的关系是什么?提示:主族元素的最外层电子数=元素的最高正化合价(O、F除外)=主族序数。
【探究总结】1.元素周期表与原子结构的关系:(1)原子序数=核电荷数=核外电子数=质子数(2)周期序数=电子层数(3)主族序数=最外层电子数2.巧记元素周期表:周期表7横行7周期,纵列分为四类族,七主七副一零一Ⅷ。
【典例】下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
【解题指南】解答本题要注意以下两点:(1)注意每一周期所容纳的元素种类数。(2)注意元素周期表中第一周期所容纳的元素种类。【解析】选D。元素周期表中第ⅡA族和ⅢA族并不相邻,因此A、B选项中的4号(ⅡA族的铍)和5号(ⅢA族的硼)的位置关系是错误的;C选项中1号氢和11号钠的位置关系是错误的。
【易错提醒】 对于元素周期表的结构要注意以下“两性”:一是“残缺”性,即第1至第3周期缺少过渡元素。二是“隐含”性,即第6、7周期ⅢB族中分别隐含着镧系元素和锕系元素,这两系中各有15种元素。
【探究训练】 1.(2020·青岛高一检测)下列对元素周期表的认识正确的是( )A.有9行7个周期B.有16列16个族C.有三个短周期和四个长周期D.非金属元素存在于主族与副族中
【解析】选C。A.周期表中有七个行,七个周期,故A错误;B.周期表中有18个纵列,每一纵列叫做一个族,8、9、10三个纵列共同组成一个族,为第Ⅷ族,7个主族,7个副族,一个0族,共有16个族,故B错误;C.有三个短周期、四个长周期,故C正确;D.非金属元素存在于主族和0族,不存在于副族中,故D错误。
2.下列有关第114号和第116号元素的说法错误的是( )A.两种元素位于同一周期B.116号元素位于第ⅥA族C.两种元素都是活泼的非金属元素D.114号元素的原子半径比116号元素的大
【解析】选C。第114号元素和第116号元素分别处于第7周期ⅣA族和ⅥA族,均为金属元素,故A、B正确,C错误;依据同周期原子半径递变规律,判断114号元素的原子半径比116号元素的原子半径大,故D正确。
3.下表是元素周期表的一部分,回答所列问题(用元素符号表示)
(1)写出下列元素符号①__________;⑥__________; ⑦__________;⑧__________。 (2)在这些元素中,最活泼的金属元素是_______,最活泼的非金属元素是__________,最不活泼的元素是_______。 (3)在这些元素中,原子半径最小的是_______,原子半径最大的是_______; (4)在③和④中,化学性质比较活泼的是_______,怎样用化学实验证明?________________________________________________________。
【解析】根据周期数和族序数可以知道①、⑥、⑦、⑧依次为N、Si、S、Cl。电子层数最多、最外层电子数最少的元素,原子半径最大,最容易失去电子,金属性最强,该元素是钾。电子层数最少、最外层电子数最多的元素,原子半径最小,最容易得电子,非金属性最强,该元素是氟。稀有气体最不活泼。答案:(1)N Si S Cl (2)K F Ar(3)F K (4)Na 可以利用金属与水反应的剧烈程度来判定
【补偿训练】1.我国的纳米基础研究能力已跻身于世界前列,如曾作为我国十大科技成果之一的RN就是一种合成纳米材料。已知该化合物中Rn+核外有28个电子。则R元素位于周期表的( )A.第3周期ⅤA族 B.第4周期ⅢA族C.第5周期ⅢA族D.第4周期ⅤA族
【解析】选B。R元素在化合物RN中的化合价取决于氮元素的化合价,因RN中R显正化合价,故氮元素在RN中显-3价,因此,R元素离子应为R3+,则R元素原子应含有28+3=31个电子,其质子数为31。第四周期0族元素的原子序数为36,说明R元素为第四周期元素。再由36-31=5,说明R元素在ⅢA族,即R为第四周期第ⅢA族元素。
2.下表给出了X、Y、Z、W四种短周期元素的部分信息,请根据这些信息判断下列说法中正确的是( )A.原子序数X>Y>Z>WB.纯净的X与纯净的Z反应生成XZ3C.Z的最高正价为+6D. XZ2具有漂白性
【解析】选D。已知X、Y、Z、W为短周期元素,由最高正价或最低负价,结合原子半径等条件,利用元素周期律可推出X是硫、Y是镁、Z是氧、W是氟。原子序数S>Mg>F>O,A错;硫在氧气中燃烧只能得到SO2,B错;氧元素一般显示-1或-2价,目前还没有发现氧元素有+6价,C错;SO2具有漂白性,D正确。
1.(2020·烟台高一检测)下列关于元素周期表的叙述正确的是( )A.有七个主族和八个副族B.只有六个周期C.0族位于元素周期表第18纵列D.第ⅢA族位于元素周期表第3纵列【解析】选C。A、元素周期表有18个纵列,其中包括七个主族、七个副族、一个0族和第Ⅷ族共16个族,故A错误;B、元素周期表有三个短周期、四个长周期,共有7个周期,故B错误;C、0族位于元素周期表的最右边,从左往右数为第18列,故C正确;D、第ⅢA族位于元素周期表的第13纵列,故D错误。
2.(双选)(2020·长沙高一检测)下列有关第三周期主族元素的性质,从左到右递变规律不正确的是( )A.原子半径逐渐减小B.最高正化合价逐渐增大C.电子层数逐渐增多D.原子半径:Al>Mg>Na
【解析】选C、D。A、同周期从左到右,原子半径逐渐减小,故A正确;B、同周期从左到右最外层电子数逐渐增多,最高正化合价等于最外层电子数,所以最高正化合价逐渐增大,故B正确;C、第三周期主族元素,电子层数为3,所以电子层数相同,故C错误;D、第三周期从左到右,原子半径逐渐减小,故D错误。
【补偿训练】元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。若发现119号元素,请您在元素大厦中安排好它的“房间”( )A.第七周期第0族B.第六周期第ⅡA族C.第八周期第ⅠA族D.第七周期第ⅦA族【解析】选C。118号元素是第七周期的最后一种元素,属于稀有气体元素,则119号元素位于第8周期第ⅠA族。
3.下图为一些元素原子半径规律性变化的示意图。由此图不能得出的下列结论是(不考虑稀有气体元素)( )A.当电子层数相同时,核电荷数越小,原子半径越大B.当最外层电子数相同时,质子数越多,原子半径越大C.r(F-)
【解析】选D。电子层数越多,原子半径越大是一种错误认识。理解这类问题,最好的方法是列举反例。根据图象知,上一周期的最左边原子半径比下一周期最右边的原子半径大,如r(Na)>r(Br),r(K)>r(I)。所以,不能根据电子层数的多少判断原子半径的大小。
4.在元素周期表中,对于同一主族相邻周期的两种元素原子序数之差的叙述正确的是( )A.第2、3周期两元素相差均为8B.第3、4周期两元素相差均为18C.第5、6周期两元素相差均为32D.以上叙述均正确
【解析】选A。同一主族相邻周期的两种元素原子序数之差也就是某个周期所含的元素种数,对本题所给的周期原子序数的差值所出现情况列表如下:
【补偿训练】下列叙述不能作为元素周期表中元素排列顺序依据的是( )A.原子的核电荷数 B.原子的中子数C.原子的质子数D.原子的核外电子数【解析】选B。元素周期表的排列顺序是依据原子序数的递增排列的,在原子中,原子序数=核电荷数=核内质子数=核外电子数,所以A、C、D正确。
5.(2020·滨州高一检测)某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( )A.R一定是第4周期元素 B.R一定是第ⅣA族元素C.R一定是第ⅦA族元素D.R的氢化物化学式为H2R【解析】选D。主族元素中,最高正价+|最低负化合价|=8,元素R的最高正价与最低负化合价的代数和为4,所以R元素的最高正价是+6价,最低负价是-2价,R的最外层电子数是6,A、R为S、Se和Te中一种,不一定是第四周期元素,A错误;B、R的最外层电子数是6,为第ⅥA族的元素,B、C错误;D、R的最低负价是-2价,气态氢化物化学式为H2R,D正确。
6.元素周期表是学习和研究化学的重要工具。下列是元素周期表的部分信息:
(1)地壳中含量最多的金属元素的原子序数是__________。 (2)分析上表规律,可推知,表中X的元素符号为_______。 (3)Ca在元素周期表中的位置为_______。 (4)写出一个由原子序数分别为1、7、17的三种元素组成的化合物的化学式:___________。
【解析】(1)地壳中含量最多的金属元素是Al,其原子序数为13。(2)由元素周期表中规律可推知X应为16S。(3)Ca位于元素周期表第4周期第ⅡA族。(4)H、N、Cl三种元素组成的常见化合物为NH4Cl。答案:(1)13 (2)S (3)第4周期第ⅡA族 (4)NH4Cl
鲁科版 (2019)必修 第二册第2节 化学反应与能量转化复习ppt课件: 这是一份鲁科版 (2019)必修 第二册第2节 化学反应与能量转化复习ppt课件,PPT课件主要包含了点击右图进入等内容,欢迎下载使用。
高中鲁科版 (2019)第2节 元素周期律和元素周期表课文配套ppt课件: 这是一份高中鲁科版 (2019)第2节 元素周期律和元素周期表课文配套ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,电子层数,铍Be,镁Mg,钙Ca,导电性,R2+,化合态,砷As,PAs等内容,欢迎下载使用。
高中鲁科版 (2019)第2节 元素周期律和元素周期表教课课件ppt: 这是一份高中鲁科版 (2019)第2节 元素周期律和元素周期表教课课件ppt,共55页。PPT课件主要包含了必备知识·自主学习,核电荷数,质子数,核外电子数,→18,由大到小,+1→+7,-4→-1,原子序数,原子核外电子排布等内容,欢迎下载使用。













