






高中化学第3节 元素周期表的应用图片课件ppt
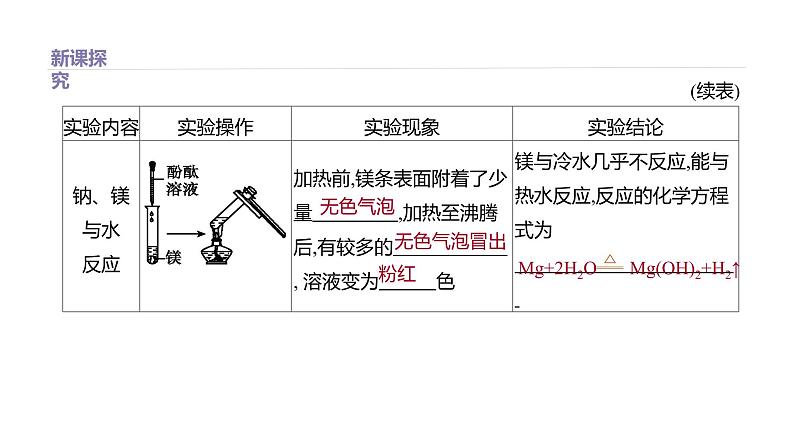
展开1.同周期钠、镁、铝三种元素原子失去电子能力的相对强弱(1)钠、镁、铝三种金属与水、稀盐酸的反应
同周期元素原子失电子能力的递变规律
2Na+2H2O=2NaOH+H2↑
Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑
(2)NaOH、Mg(OH)2、Al(OH)3的碱性强弱
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
AlCl3+3NaOH=Al(OH)3↓+ 3NaCl、Al(OH)3+NaOH= Na[Al(OH)4]
(3)结论①钠、镁、铝与水(或酸)反应置换出氢由易到难的顺序为 ;钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为 ;钠、镁、铝的金属性由强到弱的顺序为 。 ②随着原子序数的递增,同周期元素的原子失电子能力逐渐 ,金属性逐渐 。
NaOH>Mg(OH)2>Al(OH)3
2.判断元素原子失电子难易的方法(1)根据元素的单质与水或酸发生反应置换出氢的难易:越易置换出氢,失电子能力越 。 (2)根据元素的最高价氧化物对应水化物的碱性强弱:碱性越强,失电子能力 。
3.氢氧化铝的化学性质Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,属于 氢氧化物。 (1)与酸反应Al(OH)3+3HCl= 。 Al(OH)3+3H+= 。 (2)与碱反应Al(OH)3+NaOH=Na[Al(OH)4](四羟基合铝酸钠)。离子方程式为 。
AlCl3+3H2O
Al(OH)3+OH-=[Al(OH)4]-
[素养养成]1.元素的金属性强弱与失电子多少有没有关系?
[答案]没有关系,失电子多少是由原子结构所决定的,失电子多,但失电子能力不一定强,如Na和Al相比,因为二者的最外层分别有1个e-和3个e-,它们表现其金属性时,最外层电子都要失去,但失电子能力Na强于Al,不能因为Al失电子多而说它的金属性强。
2.难失电子的原子,得电子一定容易吗?
[答案]不一定,如稀有气体元素的原子难失电子,也难得电子。
例1 下列关于Na、Mg、Al的叙述中,正确的是( )A.Na、Mg、Al原子的最外层电子数依次增多,原子半径逐渐增大B.Na、Mg、Al单质都具有灰色的金属光泽C.常温下,Na、Mg、Al都与空气中的氧气反应D.Na、Mg、Al的活动性逐渐减弱,前者都可以将后者从其盐溶液中置换出来
[解析] 同周期主族元素的原子半径从左到右依次减小,所以Na、Mg、Al的原子半径逐渐减小,最外层电子数依次增多,故A错误;Na、Mg、Al单质都具有银白色的金属光泽,故B错误;
Na、Mg、Al属于活泼金属,常温下,Na、Mg、Al都与空气中的氧气反应,生成氧化物,故C正确;Na、Mg、Al的活动性逐渐减弱,Na在水溶液中与水剧烈反应,不与金属离子反应,所以前者不能将后者从其盐溶液中置换出来, 故D错误。
例2 将甲、乙两种金属的性质相比较,下列不能说明甲的金属性比乙强的是( )A.甲与水反应比乙与水反应剧烈B.甲单质能从乙的盐溶液中置换出单质乙C.与某非金属反应时甲原子失电子数目比乙的多D.甲的最高价氧化物对应的水化物比乙的最高价氧化物对应的水化物碱性强
[解析] 甲与水反应比乙与水反应剧烈,金属性越强,与水反应越剧烈,故能说明甲的金属性比乙强,A正确;甲单质能从乙的盐溶液中置换出单质乙,还原性甲>乙,故甲更活泼,金属性更强,B正确;
例2 将甲、乙两种金属的性质相比较,下列不能说明甲的金属性比乙强的是( )A.甲与水反应比乙与水反应剧烈B.甲单质能从乙的盐溶液中置换出单质乙C.与某非金属反应时甲原子失电子数目 比乙的多D.甲的最高价氧化物对应的水化物比乙的最高价氧化物对应的水化物碱性强
金属性的强弱与失去电子的难易有关,与失去电子的多少无关,如相同物质的量的Al、Na与氯气反应,Al失去电子数目较多,但Na的金属性强,C错误;金属性越强,其最高价氧化物对应的水化物的碱性越强,甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强,说明甲的金属性比乙强,D正确。
[易错警示]金属性、非金属性、氧化性和还原性概念辨析1.元素原子失电子的性质即元素的金属性,原子易失电子,元素的金属性强;原子不易失电子,元素的金属性弱。2.元素原子得电子的性质即元素的非金属性,原子易得电子,元素的非金属性强;原子不易得电子,元素的非金属性弱。元素的非金属性强弱的判断,不能依据得电子的多少,而要看得电子的难易程度。3.金属性、非金属性是元素的性质,而还原性、氧化性是具体某物质的性质,这是两个范畴的概念,不能混为一谈。
1.同周期硅、磷、硫、氯元素原子得电子能力的相对强弱
同周期元素原子得电子能力的递变规律
2.判断元素原子得电子难易的方法(1)根据元素的单质与H2化合的难易程度:化合越容易,得电子能力 。 (2)根据元素的气态氢化物的稳定性:稳定性越强,得电子能力 。 (3)根据元素的最高价氧化物对应水化物的酸性强弱:酸性越强,得电子能力 。
[素养养成] 1.同一周期中,非金属元素对应的所有含氧酸的酸性都随原子序数的增大而增强吗?
[答案]不是。同一周期,随着原子序数的递增,非金属元素最高价氧化物对应的水化物(即最高价含氧酸)酸性逐渐增强,但低价含氧酸(如HClO)不符合此规律。
2.试从原子结构的角度分析同周期主族元素性质的递变规律产生的原因。
[答案]同周期元素从左到右,金属性逐渐减弱,非金属性逐渐增强;元素的原子得电子能力逐渐增强,失电子能力逐渐减弱。同周期主族元素原子的电子层数相同,随原子序数递增,原子核对最外层电子的吸引力增大,原子半径减小(稀有气体元素除外),失电子能力减弱,得电子能力增强。
例3 同一短周期的元素W、X、Y、Z的原子序数依次增大,下列叙述正确的是( )A.单质的化学活泼性:W
例4 电子层数相同的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4。下列判断错误的是( )A.原子半径:X>Y>ZB.气态氢化物的稳定性:HX>H2Y>ZH3C.非金属性:X>Y>ZD.单质氧化性:X>Y>Z
[解析] X、Y、Z三种元素电子层数相同,即为同周期三种元素,其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4。根据同周期元素性质的递变规律,最高价氧化物对应水化物的酸性越强,则对应元素的非金属性越强,单质的氧化性越强:X>Y>Z,原子序数越大:X>Y>Z,原子半径越小:r(Z)>r(Y)>r(X),气态氢化物的稳定性越强:HX>H2Y>ZH3。由以上分析知A项错误。
[归纳小结] 同周期主族元素性质递变规律
1.判断正误(正确的打“√”,错误的打“×”)。(1)还原性:Na>Mg>Al( )(2)碱性:Mg(OH)2>NaOH>Al(OH)3( )(3)金属原子失电子数目越多,还原性越强( )(4)第3周期非金属元素含氧酸的酸性从左到右依次增强( )(5)同一周期从左到右,随着元素原子序数的递增,其气态氢化物的稳定性增强( )(6)C、N、O、F与H2化合越来越容易( )(7)酸性:H2SO3>HClO,所以非金属性:S>Cl( )(8)还原性:S2->Cl-,氧化性:S>Cl2( )
2.下列关于第3周期主族元素从左到右的递变规律的说法中,不正确的是( )A.原子半径逐渐减小 B.原子的电子层数逐渐增多C.最高正化合价逐渐增大 D.非金属性逐渐增强
3.能说明钠比铝活泼的是( )A.两种单质,钠比铝质软B.相等物质的量的钠和铝分别和盐酸反应,钠产生的气体少C.钠与铝的电子层数相等D.常温下钠能与水剧烈反应,而铝不能
4.下列氧化物对应的含氧酸酸性最强的是( )A.SiO2 B.N2O5 C.P2O5 D.CO2
5.下列叙述能肯定金属A比金属B更活泼的是( )A.A原子的最外层电子数比B原子的最外层电子数少B.A原子的电子层数比B原子多C.1 ml A从酸中置换出H2的量比1 ml B多D.常温下,A能从酸中置换出氢,而B不能
6.下列各组物质的性质比较,不正确的是( )A.酸性:H3PO4>HClO4B.气态氢化物稳定性:HF>H2O>NH3C.碱性:NaOH>Mg(OH)2>Al(OH)3D.氧化性:F2>O2>N2
7.短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )A.质子数:c>dB.离子还原性:Y2->Z-C.气态氢化物稳定性:H2Y>HZD.原子半径:Y>X
[解析] 因四种离子的电子层结构相同,确定四种元素在元素周期表中的相对位置关系为 ,所以质子数a>b>d>c, A项错误。非金属性Z>Y,则离子还原性Y2->Z-,B项正确。气态氢化物稳定性为HZ>H2Y,C项错误。原子半径X>Y,D项错误。
8.a、b、c、d、e、f、g为7种短周期元素构成的粒子,它们都有10个电子,其结构特点见表。其中d是四原子分子,c与f反应可生成2个g分子。试写出:(1)b与e相应元素的最高价氧化物对应的水化物碱性强弱: > 。(用化学式表示) (2)b与e的离子半径: > 。(填离子符号) (3)c粒子是 ,f粒子是 。(用化学式表示)
1.按C、N、O、F的排列顺序,下列递变规律错误的是( )A.原子半径逐渐减小B.元素原子得电子能力逐渐增强C.最高价氧化物对应的水化物的酸性依次增强D.气态氢化物稳定性逐渐增强
[解析] C、N、O、F属同一周期的元素,且原子序数依次增大,原子半径逐渐减小,得电子能力依次增强;气态氢化物稳定性依次增强;F无正价,F、O无最高价氧化物对应的水化物,故无法比较。
高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用备课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用备课课件ppt,共60页。PPT课件主要包含了必备知识·自主学习,非金属,2性质预测,CO2,SiF4,SiF4↑+2H2↑,SiO2,CaSiO3,Si粗+2CO↑,SiF4↑+2H2O等内容,欢迎下载使用。
鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文内容ppt课件: 这是一份鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文内容ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,逐渐增多,逐渐增大,化合态,HClO4,HBrO4,HIO4,HCl,HBr,深红棕等内容,欢迎下载使用。
化学必修 第二册第3节 元素周期表的应用示范课ppt课件: 这是一份化学必修 第二册第3节 元素周期表的应用示范课ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,b与酸反应,②置换氢气,点燃或光照,逐渐增强,逐渐减弱,关键能力·合作学习,课堂小结,课堂检测·素养达标等内容,欢迎下载使用。













