




化学必修 第二册第3节 元素周期表的应用备课ppt课件
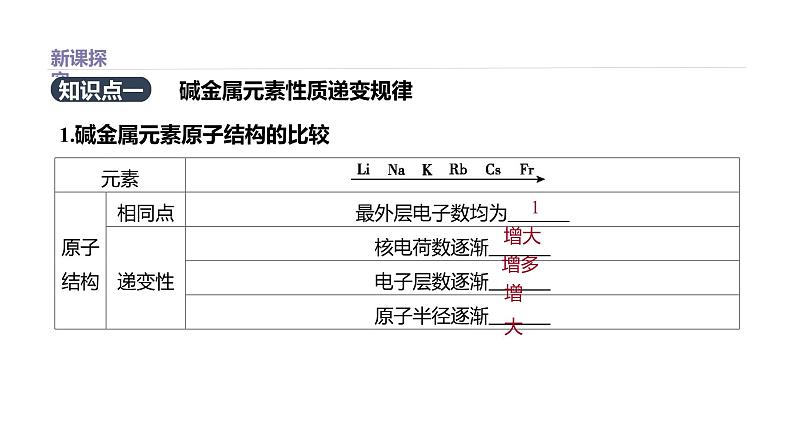
展开1.碱金属元素原子结构的比较
碱金属元素性质递变规律
2.碱金属单质的物理性质
3.碱金属元素单质的化学性质
[素养养成] 碱金属都具有强的还原性,极易与空气中的氧气和水蒸气反应,需要隔绝空气保存,那么它们都能保存在煤油中吗?
[答案]锂的密度比煤油小,通常用石蜡密封保存。
例1 下列关于碱金属元素按Li、Na、K、Rb、Cs的顺序叙述中不正确的是( )A.碱金属元素原子最外层都只有1个电子,在化学反应中容易失去电子表现出强还原性B.单质的熔点和沸点依次递减C.单质都能与水反应生成碱,都能在空气中燃烧生成过氧化物D.原子半径逐渐增大,单质与水反应的剧烈程度逐渐增强
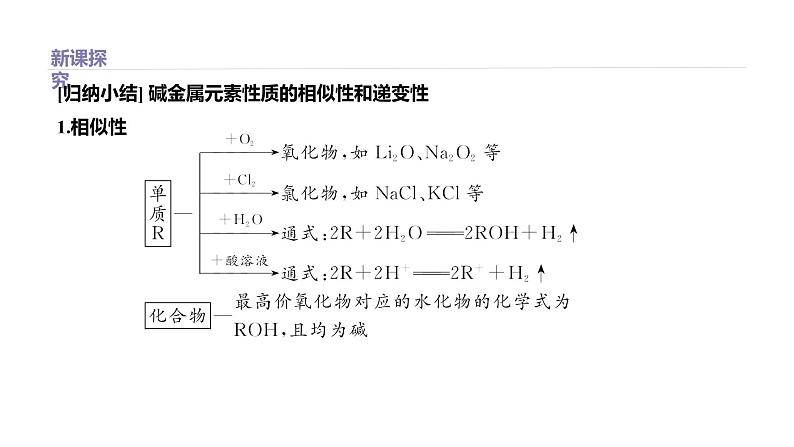
[归纳小结] 碱金属元素性质的相似性和递变性1.相似性
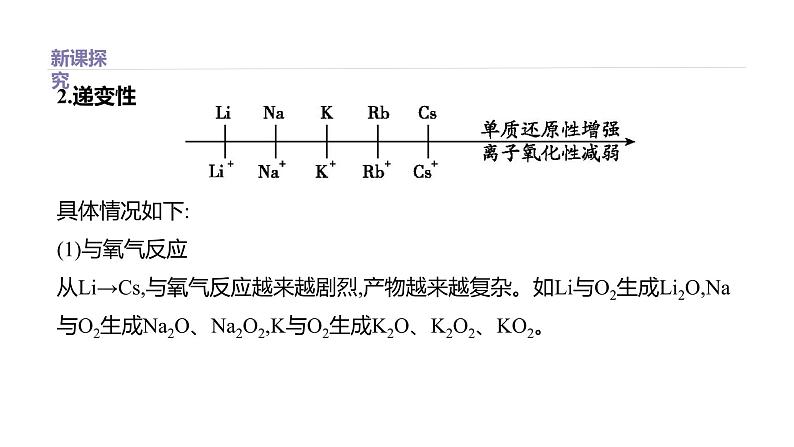
2.递变性 具体情况如下:(1)与氧气反应从Li→Cs,与氧气反应越来越剧烈,产物越来越复杂。如Li与O2生成Li2O,Na与O2生成Na2O、Na2O2,K与O2生成K2O、K2O2、KO2。
(2)与H2O(或酸)的反应从Li→Cs,与H2O(或酸)反应越来越剧烈。如K与H2O反应能发生轻微爆炸,Rb、Cs则遇水发生爆炸。因Na、K等活泼的金属易与H2O反应,故不能从盐的水溶液中置换出不活泼的金属,只有在熔融状态下才能置换出不活泼的金属。(3)最高价氧化物对应的水化物的碱性:LiOH
ⅦA族元素性质递变规律
3.卤素单质的化学性质(1)与氢气的化合
(2)卤素单质间的置换反应
Cl2+2KBr=Br2+2KCl
Cl2+2KI=I2+2KCl
Br2+2KI=I2+2KBr
4.卤族元素性质与原子结构的关系从F到I,随核电荷数的增加,电子层数逐渐 ,原子半径逐渐 ,原子核对最外层电子的吸引力逐渐 ,得电子能力逐渐 ,元素非金属性逐渐 。
[素养养成] 1.同主族非金属元素化学性质存在递变性的原因是什么?
[答案]同一主族元素原子最外层电子数相同,所以化学性质相似;从上而下,核电荷数逐渐增大,核外电子数逐渐增多,电子层数逐渐增多,原子半径逐渐增大,原子核对核外电子的吸引力逐渐减小,得电子能力逐渐减弱,所以单质的氧化性逐渐减弱,相对应的阴离子还原性逐渐增强。
2.如何通过实验证明非金属性:O>S。
[答案]将O2通入H2S溶液中,若得到黄色沉淀,则可证明非金属性:O>S。
例2 下列叙述中,正确的是( )A.C、N、O元素的单质与氢气化合越来越难B.Li、Na、K的最高价氧化物对应的水化物的碱性依次减弱C.Na、Mg、Al的简单离子的氧化性依次增强D.P、S、Cl元素的最高正价依次升高,其对应的气态氢化物的稳定性依次减弱
[解析] 同周期从左到右元素非金属性逐渐增强,单质与氢气化合越来越容易,生成的气态氢化物越来越稳定,简单阳离子的氧化性依次增强、阴离子还原性逐渐减弱,故A、D项错误,C项正确。同主族元素从上到下最高价氧化物对应水化物的碱性逐渐增强,故B项错误。
例3 X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )A.X原子的电子层数比Y原子的电子层数多B.X的氢化物的沸点比Y的氢化物沸点低C.X的气态氢化物比Y的气态氢化物稳定D.Y的单质能将X从NaX的溶液中置换出来
[解析] 本题是ⅦA族元素非金属性的比较,因此必须与本族元素的特性联合考虑。A选项中X原子电子层数多于Y,因此在同族中X在Y的下方,根据同主族元素由上向下,非金属性减弱可知,X的非金属性比Y弱,故A错误;
B是氢化物的沸点问题,如果Y的氢化物是HF,X的氢化物是HCl,HCl的沸点比HF的沸点低,但Cl的非金属性比F弱,氢化物的沸点与非金属性没有必然的联系,B选项有一定的干扰性;
C项比较的是气态氢化物的稳定性,X的气态氢化物稳定,说明其非金属性强,举例如: 稳定性HF>HCl>HBr>HI;D中Y单质能够将X从其盐溶液中置换出来,说明Y的非金属性强于X,与题干相反。
[规律小结] 同主族元素性质的相似性和递变规律(1)相似性:同主族元素原子的最外层电子数相等,因此它们的最高正化合价相同(O、F除外),最高价氧化物的通式相同(O、F除外),非金属元素的负化合价相同,气态氢化物的通式相同。(2)递变性同主族元素,自上而下:①原子、离子的电子层数依次增多。
②原子半径和离子半径依次增大。③最高价氧化物对应水化物的碱性逐渐增强,酸性逐渐减弱。④气态氢化物的热稳定性逐渐减弱,还原性逐渐增强。⑤元素的金属性(失电子能力)依次增强,非金属性(得电子能力)依次减弱。
1.判断正误(正确的打“√”,错误的打“×”)。(1)同主族元素自上而下,碱金属单质和卤素单质的熔、沸点逐渐升高( )(2)同一主族的元素性质完全相同( )(3)同主族元素自上而下,元素的原子半径逐渐增大( )(4)溴与氢气的反应不如氯气与氢气的反应剧烈,HBr也不如HCl稳定( )(5)同主族元素性质具有相似性,原因是同主族元素原子的最外层电子数相同( )(6)同主族元素具有相似的性质,所以卤族元素最低化合价均为-1价( )(7)元素的非金属性越强,其气态氢化物水溶液的酸性越强( )(8)碱金属单质的化学性质活泼,易失电子发生还原反应( )
2.下列关于碱金属元素的叙述中不正确的是( )A.从上到下,原子的半径依次增大B.从上到下,元素的金属性逐渐增强C.从上到下,原子的最外层电子数依次增多D.从上到下,氢氧化物的碱性逐渐增强
[解析] 碱金属元素从上到下,电子层数依次增多,原子半径依次增大,A正确;碱金属元素从上到下,原子半径依次增大,原子核对最外层电子的吸引力逐渐减弱,则元素的金属性逐渐增强,B正确;
碱金属元素同处于第ⅠA族,最外层电子数均为1,C错误;碱金属元素从上到下,金属性逐渐增强,则氢氧化物的碱性逐渐增强,D正确。
3.下列有关碱金属对应性质的叙述正确的是( )A.碱金属单质均为银白色,密度均小于水B.碱金属单质从Li到Cs,熔点依次升高C.氢氧化铯碱性强于氢氧化钠D.碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强
[解析] 铯略带金色光泽,Rb和Cs的密度大于水,A错误;从Li到Cs,单质的熔点逐渐降低,B错误;Cs的金属性强于Na,则CsOH的碱性强于NaOH,C正确;从Li到Cs,单质的还原性逐渐增大,则从Li+到Cs+的氧化性逐渐减弱,D错误。
4.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是( ) A B C D
[解析] 随着核电荷数的递增,卤族元素的非金属性逐渐减弱,A正确;随着核电荷数的递增,卤族元素单质的氧化性减弱,即氧化性:F2>Cl2>Br2,B错误;随着核电荷数的递增,卤族元素的非金属性减弱,则气态氢化物的稳定性减弱,C错误;由F2到Br2,单质的熔点逐渐升高,D错误。
5.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )A.A原子最外层电子数比B原子的最外层电子数少B.A原子电子层数比B原子的电子层数多C.1 ml A从酸中置换生成的H2比1 ml B从酸中置换生成的H2多D.常温时,A能从酸中置换出H2,而B不能
[解析] 金属的活泼性与原子最外层电子数多少无必然联系,A错误;电子层数多,金属的活泼性不一定强,如Na比Fe的电子层数少,但Na比Fe活泼,B错误;1 ml A从酸中置换出H2比1 ml B从酸中置换出H2多,说明A原子最外层电子数比B多,不能比较二者的活泼性,C错误;常温时,A能从酸中置换出H2,而B不能,则A比B活泼,D正确。
6.在硬质试管中的A、B、C处依次放有浸有KBr溶液、KI溶液、淀粉溶液的3个棉球(如图所示)。由左端缓慢导入氯气,在B处加热,可观察到A处棉球呈 色,B处棉球呈 色,C处棉球呈 色。将试管冷却后,在B、C之间的玻璃壁上,有 色的 ,这是因为 。
1.下列关于碱金属的原子结构和性质的叙述中不正确的是( )A.碱金属元素原子最外层都只有1个电子,在化学反应中容易失去最外层这个电子B.都是强还原剂C.都能在O2中燃烧生成过氧化物D.都能与水反应生成碱
高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用备课课件ppt: 这是一份高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用备课课件ppt,共60页。PPT课件主要包含了必备知识·自主学习,非金属,2性质预测,CO2,SiF4,SiF4↑+2H2↑,SiO2,CaSiO3,Si粗+2CO↑,SiF4↑+2H2O等内容,欢迎下载使用。
鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文内容ppt课件: 这是一份鲁科版 (2019)必修 第二册第3节 元素周期表的应用课文内容ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,逐渐增多,逐渐增大,化合态,HClO4,HBrO4,HIO4,HCl,HBr,深红棕等内容,欢迎下载使用。
化学必修 第二册第3节 元素周期表的应用示范课ppt课件: 这是一份化学必修 第二册第3节 元素周期表的应用示范课ppt课件,共60页。PPT课件主要包含了必备知识·自主学习,b与酸反应,②置换氢气,点燃或光照,逐渐增强,逐渐减弱,关键能力·合作学习,课堂小结,课堂检测·素养达标等内容,欢迎下载使用。













