

还剩19页未读,
继续阅读
高中化学鲁科版 (2019)必修 第一册第1节 元素与物质分类优秀第1课时学案
展开
这是一份高中化学鲁科版 (2019)必修 第一册第1节 元素与物质分类优秀第1课时学案,共22页。
第2章 元素与物质世界
第1节 元素与物质的分类
第1课时 元素与物质的关系 物质分类与物质性质
[知 识 梳 理]
知识点一 元素与物质的关系
盐酸(分析纯)的试剂标签
通过上图可以知道,盐酸是由氢元素和氯元素组成的,里面还含有其它的杂质,它们分别由什么元素组成的,元素与物质的关系究竟怎样?请完成下列知识点:
1.元素与物质的关系
(1)元素是物质的基本组成成分,物质都是由元素组成的。
(2)每一种元素都能自身组成单质;绝大多数元素都能与其他种类的元素组成化合物。而且几种元素组成化合物时,有的只能组成一种,有的则能组成几种不同的化合物。
同一种元素组成的物质不一定是单质,可能是混合物,如O2、O3
2.元素的存在形态及元素的化合价
(1)游离态:元素以单质形式存在的状态,其化合价为0。
(2)化合态:元素以化合物形式存在的状态,元素的化合价一般不为0。
(3)一种元素可以有多种化合价,金属元素只有0价和正价,非金属元素一般有0价、负价和正价。
一般认为O无最高正价,F无正价
(4)在不同的化合物中同一元素的化合价可能相同,也可能不相同。在化合物中各元素的化合价的代数和等于0。
NH4NO3中的N既有-3价,又有+5价
知识点二 物质的分类与物质性质
我们知道Ca(OH)2属于碱,其水溶液显碱性,HCl属于酸,其水溶液显酸性, 那么Ca(OH)2溶液、盐酸属于什么?物质是怎么分类的?
各个类别的物质分别有什么样的性质?请完成下列知识点:
1.物质分类的依据
(1)根据物质的元素组成分类
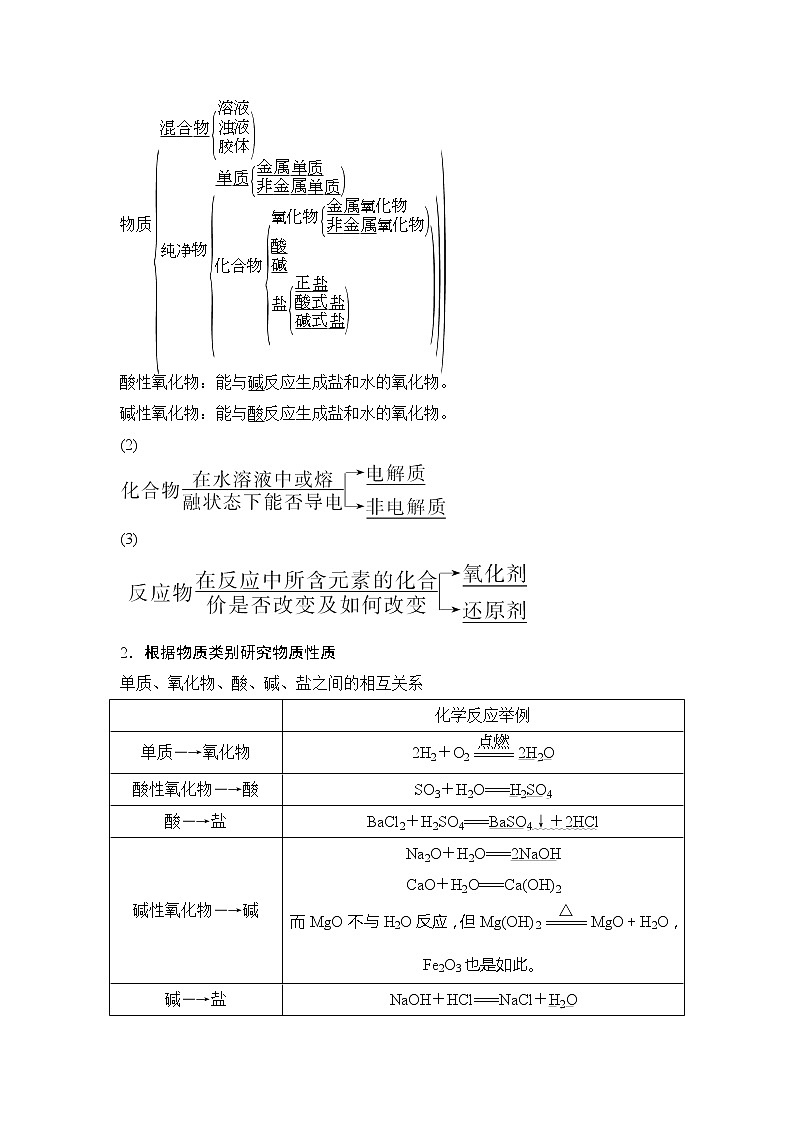
物质eq \b\lc\{(\a\vs4\al\c1(混合物\b\lc\{(\a\vs4\al\c1(溶液,浊液,胶体)),纯净物\b\lc\{(\a\vs4\al\c1(单质\b\lc\{(\a\vs4\al\c1(金属单质,非金属单质)),化合物\b\lc\{(\a\vs4\al\c1(氧化物\b\lc\{(\a\vs4\al\c1(金属氧化物,非金属氧化物)),酸,碱,盐\b\lc\{(\a\vs4\al\c1(正盐,酸式盐,碱式盐))))))))
酸性氧化物:能与碱反应生成盐和水的氧化物。
碱性氧化物:能与酸反应生成盐和水的氧化物。
(2)
(3)
2.根据物质类别研究物质性质
单质、氧化物、酸、碱、盐之间的相互关系
微判断
(1)Na2SO4既属于钠盐,又属于硫酸盐。(√)
(2)Na2CO3属于氧化物。(×)
(3)CuSO4·5H2O属于混合物。(×)
(4)只有一种元素组成的物质是纯净物。(×)
(5)金属铁和盐酸反应生成FeCl2和H2的反应是置换反应。(√)
微训练
1.下列化合物中依次属于氧化物、碱、盐的一组是( )
A.Na2CO3、KOH、CaO
B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl
D.CuO、Cu2(OH)2CO3、CaCO3
答案 B
2.下列判断正确的是( )
A.由同一种元素组成的物质一定是纯净物
B.两种元素只能组成一种化合物
C.一种元素在同一种化合物中只能显示一种价态
D.金属元素在化合物中只显示正化合价,而非金属元素在化合物中可以显示正化合价或负化合价
解析 只由一种元素组成的物质可能是纯净物,如O2,也可能是混合物(O2和O3的混合物),A项错误;两种元素可以组成不同的化合物,如SO2和SO3,B项错误;一种元素在同一化合物中不一定只显一种价态,如NH4NO3中,N有-3价和+5价,C项错误;金属元素只有正价,非金属元素在化合物中可以显正价,也可以显负价,如SO2中S为+4价,H2S中S为-2价。
答案 D
3.有物质①O2 ②Fe ③H2SO4
④NaOH ⑤CuCl2,请回答:
(1)写出一个上述物质发生化合反应的化学方程式_________________________
___________________________________________________________;
(2)写出两个上述物质发生复分解反应的化学方程式____________________
________________________________________________________;
(3)写出两个上述物质发生置换反应的化学方程式________________________
___________________________________________________________。
答案 (1)2O2+3Feeq \(=====,\s\up7(点燃))Fe3O4
(2)H2SO4+2NaOH===Na2SO4+2H2O
CuCl2+2NaOH===Cu(OH)2↓+2NaCl
(3)Fe+H2SO4===FeSO4+H2↑
Fe+CuCl2===Cu+FeCl2
微思考
1.分类标准是唯一的吗?以酸为例说明。
提示 分类标准不是唯一的,一定要注意分类标准,如酸按酸性强弱可以分为强酸、弱酸,按电离出H+的个数可以分为一元酸、二元酸、三元酸等,按是否含氧可分为含氧酸和无氧酸,一种酸可以有多个身份,如H2SO4:强酸、二元酸、含氧酸。
2.带结晶水的化合物是纯净物吗?常见的带结晶水的化合物有哪些?
提示 带结晶水的化合物是纯净物,如CuSO4·5H2O(蓝矾、胆矾)、KAl(SO4)2·12H2O(明矾)、FeSO4·7H2O(绿矾)等。
学习任务1 常用的分类方法
【情景】 (1)走进化学实验室,你是如何找到你所需要的药品的?
提示 实验室的药品都是分类存放的。
(2)处于丰富多彩的物质世界中,为了更好地探讨物质的性质和用途,应该怎样对物质分类?
提示 交叉分类法、树状分类法。
(3)从哪些角度认为Na2CO3和Na2SO4是同类物质?
提示 纯净物,化合物,盐,正盐,钠盐,含氧酸盐。
1.交叉分类法和树状分类法的区别
(1)交叉分类法中的类别之间存在交叉关系,如Na2SO4、K2SO4分别属于钠盐、钾盐,但它们又都属于硫酸盐;
(2)树状分类法中的物质类别间存在从属关系,如盐属于化合物,而化合物又属于纯净物等。
2.物质分类的几点注意事项
(1)根据不同标准可以对化学物质和化学反应进行不同的分类,因此没有固定的分类标准,就会出现错误的分类。如:把物质分为混合物、纯净物、化合物,就是分类标准不统一导致的错误。混合物和纯净物是并列关系,而纯净物包含化合物。
(2)概念间的关系——“并列”与“包含”。
①并列关系:纯净物与混合物,单质与化合物,酸与碱、盐;
②包含关系:纯净物>化合物>氧化物。
(3)酸的元数是酸电离出H+的个数,而不是分子中氢原子的个数,如CH3COOH是一元酸而不是四元酸。
(4)非金属氧化物不一定是酸性氧化物,如CO,酸性氧化物也不一定是非金属氧化物,如Mn2O7为酸性氧化物。
(5)金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。但碱性氧化物一定是金属氧化物。
【例题1】 纯净物根据其组成和性质可进行如下分类。
(1)如图所示的分类方法属于________(填字母)。
A.交叉分类法 B.树状分类法
(2)以H、O、S、N、K、Ca六种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
(3)从上表中选出一种酸和一种氧化物,写出其反应的化学方程式:_____________________________________________________________
__________________________________________________________。
解析 (1)图中是对同类事物按照某种属性进行再分类的分类法,属于树状分类法。
(2)题干中的六种元素可以形成H2SO4、HNO3、H2S等酸;可以形成KOH、Ca(OH)2、NH3·H2O等碱;可以形成Ca(NO3)2、KNO3、K2SO4、CaSO4、NH4NO3等盐;可以形成的氧化物有H2O、SO2、NO、NO2、K2O、CaO等。
(3)能够与酸反应的氧化物一般为金属氧化物,如CaO+2HNO3===Ca(NO3)2+H2O、K2O+H2SO4===K2SO4+H2O。
答案 (1)B
(2)H2SO4 KOH KNO3 K2O(其他合理答案也可以)
(3)K2O+H2SO4===K2SO4+H2O
变式训练1 下列物质分类的正确组合是( )
解析 A项中纯碱属于盐而不属于碱;B项中CO不能与碱反应,不属于酸性氧化物;C项中水不属于酸性氧化物。
答案 D
学习任务2 常见分类法的应用
生活中,我们往往用到分类记忆法,如:
水果:苹果、桃、梨
人物:王峰、鲍雲、王昱珩
球类:足球、篮球、乒乓球
动物:狗、马、猫
化学学习也用到分类法掌握物质的性质。
1.金属单质(以Fe为例)的通性是什么?
提示
2.氧化物(以CO2、CaO为例)的通性是什么?
提示
3.酸(以稀盐酸为例)的通性是什么?
提示
4.碱[以Ca(OH)2为例]的通性是什么?
提示
eq \x(碱)—
5.盐(以Na2CO3为例)的通性是什么?
提示
氧化物的分类中的特殊物质
(1)碱性氧化物指能与酸反应生成盐和水的氧化物。碱性氧化物都是金属氧化物,但金属氧化物不一定都是碱性氧化物,如Mn2O7为酸性氧化物。
(2)酸性氧化物指能与碱反应生成盐和水的氧化物。非金属氧化物不一定都是酸性氧化物,如CO、H2O等;酸性氧化物也不一定都是非金属氧化物,如Mn2O7。
(3)CO、NO等不能与碱反应生成盐,故属于不成盐氧化物。
(4)Na2O2、Na2O都能与酸反应,如:Na2O+2HCl===2NaCl+H2O;2Na2O2+4HCl===4NaCl+2H2O+O2↑,Na2O2和Na2O不都是碱性氧化物。与酸反应生成盐和水的氧化物属于碱性氧化物,Na2O符合概念,Na2O2与酸反应不仅生成盐和水,还生成了O2,故Na2O2不属于碱性氧化物。
【例题2】 在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在如图所示的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为①________;②________;③________;④________;⑤________。
(2)写出下列序号之间的化学方程式:
①和②:______________________________________________;
②和④:_____________________________________________;
②和⑤:______________________________________________;
③和④:_____________________________________________。
解析 据单质①能和酸②发生化学反应,推知①应为活泼金属单质即为铁,而酸只有稀H2SO4,即②为稀H2SO4,则氧化物④应为金属氧化物CaO,从而氧化物③为酸性氧化物,即CO2,⑤属于盐且其溶液既能与H2SO4反应,又能与CaO反应,则⑤应为Na2CO3。
答案 (1)Fe H2SO4 CO2 CaO Na2CO3
(2)Fe+H2SO4===FeSO4+H2↑
CaO+H2SO4===CaSO4+H2O
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
变式训练2 A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A.铜 B.碳 C.铁 D.钙
解析 A为CaO,B为Ca(OH)2,C为Ca(NO3)2,D为CaCl2,E为CaCO3。
答案 D
学习任务3 (核心素养)常见酸、碱分类
一、知识要点
二、核心素养
【素养解题】
[典例示范] 依据物质的分类标准,下列有关说法正确的是( )
A.同种元素组成的物质一定是纯净物
B.酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物
C.能电离出H+的一定是酸
D.在酸中有几个H原子就一定是几元酸
[分类问题解题思维模型]
答案 B
三、对点训练
1.墨鱼骨粉(主要成分为CaCO3)可作治疗胃酸过多的药剂。CaCO3属于( )
A.氧化物B.酸
C.碱D.盐
解析 CaCO3 是由钙离子和碳酸根离子构成的化合物,属于盐,D项正确。
答案 D
2.下列物质中属于氧化物的是( )
A.冰水混合物B.氧气
C.氯酸钾D.乙醇
解析 A项,冰水混合物是水,水是由氧元素和氢元素组成的化合物,属于氧化物,A项正确;B项,只含有氧元素,是单质,B项错误;C项,氯酸钾是由三种元素组成的化合物,不属于氧化物,C项错误;D项,乙醇含有三种元素,是含氧化合物,D项错误。
答案 A
3.原油是一种没有固定沸点的液态物质,加热原油使不同沸点的组分分别汽化,然后冷凝,就能得到汽油、煤油、柴油等产品。由此可以判断原油属于( )
A.化合物B.混合物
C.单质D.纯净物
解析 由题干所给信息可知,原油没有固定的沸点,汽化冷凝后能得到不同的产品,所以原油属于混合物。
答案 B
4.请按下列线索提示画出Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl的树状分类图:
解析 要正确填写树状分类图,必须首先明确各物质的组成和性质差异。依据基本化学知识即可解决。
答案 Fe、Cu S、H2 HCl、H2SO4 NaOH、Ba(OH)2 NaCl、NaHCO3 K2O、CuO
[学 考 练]
1.下列对Na2CO3的叙述中不正确的是( )
A.该物质属于盐类
B.该物质既含金属元素又含非金属元素
C.该物质不能发生化合反应
D.该物质有时候能和NaOH划为一类
解析 Na2CO3既含金属元素又含非金属元素(酸根离子),属于盐类,与NaOH具有相同的阳离子。Na2CO3能和水、二氧化碳发生化合反应生成NaHCO3。
答案 C
2.Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是(已知Na2O与水反应生成NaOH)( )
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物
A.①④⑤B.①②⑤⑥
C.①③④D.②⑤⑥
解析 物质都是钠的化合物,①对;NaCl、Na2SO4都不能与硝酸反应,②错误;都是可溶于水的物质,③对;Na2O与水反应生成NaOH,酸、碱、盐的水溶液导电,④对;Na2O、NaOH不属于钠盐,⑤错误;NaCl不属于钠的含氧化合物,⑥错误。
答案 C
3.下列各组物质按酸、碱、盐依次排列的是( )
A.醋酸、乙醇、氯化钠
B.硝酸、烧碱、纯碱
C.碳酸氢钠、氢氧化铜、硫酸钾
D.盐酸、熟石灰、苛性钠
解析 A.醋酸电离出的阳离子全部是H+,属于酸;乙醇是有机物,不属于碱;氯化钠是由钠离子和氯离子组成的化合物,属于盐,故A错误;B.硝酸电离出的阳离子全部是H+,属于酸;烧碱即NaOH电离出的阴离子全部是OH-,属于碱;纯碱即碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐,故B正确;C.碳酸氢钠是钠离子和碳酸氢根离子组成的化合物,属于盐;氢氧化铜电离出的阴离子全部是OH-,属于碱;硫酸钾是由钾离子和硫酸根离子组成的化合物,属于盐,故C错误;D.盐酸是HCl和水的混合物;熟石灰即氢氧化钙电离出的阴离子全部是OH-,属于碱;苛性钠即NaOH电离出的阴离子全部是OH-,属于碱,故D错误。
答案 B
4.实验室里有4个药品橱,已经存放以下物品:
实验室新购进一些碘,应该将这些碘放在( )
A.甲橱B.乙橱
C.丙橱D.丁橱
解析 碘是非金属单质。
答案 C
5.下列选项中各物质的分类、名称(或俗名)、化学式都正确的是( )
解析 A项中氧化铁的化学式为Fe2O3;B项中碳酸气应为CO2;C项中硫酸的化学式为H2SO4。
答案 D
6.下列说法正确的是( )
A.纯净物一定由分子构成
B.同种分子构成的物质一定是纯净物
C.混合物肯定由两种以上元素组成
D.含有氧元素的化合物都是氧化物
解析 纯净物可以由同种分子构成,如水、O2等,也可以由同种原子构成,如稀有气体,还可以由离子构成,A错误,B正确;混合物可以由两种以上元素组成,也可以由一种元素组成,如金刚石和石墨的混合物,只含碳元素,C错误;含氧元素的化合物不一定是氧化物,如Na2CO3、H2SO4等,D错误。
答案 B
7.下列分类正确的是( )
A.酸:CH3COOH、H2SO3、NaHCO3、HF
B.碱:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2
C.盐:AgCl、BaSO4、NaH2PO4、Mg(NO3)2
D.氧化物:FeO、N2O5、COCl2、SiO2
解析 A项中NaHCO3属于盐;B项中Cu2(OH)2CO3属于碱式盐;氧化物是指由两种元素组成,其中一种元素为氧元素的化合物,D项中COCl2不属于氧化物。
答案 C
8.如下图所示,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
解析 A中甲和乙、乙和丙、丙和丁、丁和甲均不能反应,丁也不能转化为乙;B中甲和乙、乙和丙、丁和甲之间也不能反应,丁也不能转化为乙,故A、B不符合题意。C中反应依次为甲和乙:2CO+O2eq \(=====,\s\up7(点燃))2CO2;乙和丙:CO+CuOeq \(=====,\s\up7(△))Cu+CO2;丙和丁:2CuO+Ceq \(=====,\s\up7(高温))2Cu+CO2↑;甲和丁:C+O2eq \(=====,\s\up7(点燃))CO2;丁→乙:2C+O2eq \(=====,\s\up7(点燃))2CO。D中,甲和乙、丁和甲均不能反应,故D不符合题意。
答案 C
9.KOH是我国古代纺织业常用于漂洗的洗涤剂。古代制取KOH的流程如下:
上述流程中没有涉及的化学反应类型是( )
A.化合反应B.分解反应
C.置换反应D.复分解反应
解析 该过程中发生的反应依次是CaCO3eq \(=====,\s\up7(高温))CaO+CO2↑(分解反应);CaO+H2O===Ca(OH)2(化合反应);Ca(OH)2+K2CO3===CaCO3↓+2KOH(复分解反应)。
答案 C
10.(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写到下面的适当位置。
物质eq \b\lc\{(\a\vs4\al\c1(纯净物\b\lc\{(\a\vs4\al\c1(化合物:① ,单质\b\lc\{(\a\vs4\al\c1(金属单质:② ,非金属单质:③ )))),混合物:④ ))
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:______________________________________________________。
②化合反应:______________________________________________。
③置换反应:___________________________________________。
④复分解反应:________________________________________________。
解析 (1)碳酸钙属于化合物,稀盐酸属于混合物,铁属于金属单质,氧气属于非金属单质。(2)CaCO3可以受热分解,Fe和O2可以化合生成Fe3O4,盐酸和铁可以发生置换反应。CaCO3与盐酸可以发生复分解反应。
答案 (1)①碳酸钙 ②铁 ③氧气 ④稀盐酸
(2)①CaCO3eq \(=====,\s\up7(高温))CaO+CO2↑
②3Fe+2O2eq \(=====,\s\up7(点燃))Fe3O4
③Fe+2HCl===FeCl2+H2↑
④CaCO3+2HCl===CaCl2+H2O+CO2↑
11.现有下列八种物质:①纯碱,②盐酸,③稀硫酸,④氯化钙溶液,⑤烧碱,⑥二氧化碳,⑦氧化铁,⑧氢氧化铁。按下列要求写出反应的化学方程式:
(1)无氧酸与钠盐:________________________________________。
(2)可溶性碱与无氧酸:____________________________________________。
(3)两种盐溶液:_______________________________________________________。
(4)酸性氧化物与可溶性碱:___________________________________________。
(5)含氧酸与不溶性碱:_________________________________________________。
解析 根据要求选择合适的物质。盐酸是无氧酸,纯碱是钠盐,碱有可溶性的烧碱和不溶性的氢氧化铁,硫酸是含氧酸,二氧化碳是酸性氧化物。
答案 (1)2HCl+Na2CO3===2NaCl+H2O+CO2↑
(2)NaOH+HCl===NaCl+H2O
(3)CaCl2+Na2CO3===2NaCl+CaCO3↓
(4)CO2+2NaOH===Na2CO3+H2O
(5)3H2SO4+2Fe(OH)3===Fe2(SO4)3+6H2O
12.单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示。限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
①C+O2eq \(=====,\s\up7(点燃))CO2;
②__________________________________________________________;
③_________________________________________________________;
④__________________________________________________________;
⑤______________________________________________________________;
⑥__________________________________________________________;
⑦______________________________________________________________。
解析 属于同一类的物质必定符合同一标准,就会有某一共同的性质,利用一类物质和另一类物质之间的关系,就可以找出物质之间转化的方法:
非金属eq \(――→,\s\up7(氧气),\s\d5(①))酸性氧化物eq \b\lc\{(\a\vs4\al\c1(\(――→,\s\up7(碱性氧化物))盐,\(――→,\s\up7(碱))盐,\(――→,\s\up7(水))酸));金属eq \(――→,\s\up7(氧气))碱性氧化物eq \b\lc\{(\a\vs4\al\c1(\(――→,\s\up7(酸性氧化物))盐,\(――→,\s\up7(酸))盐,\(――→,\s\up7(水))碱)),该题对各类物质之间的转化限定了8种物质,从这8种物质中选出符合条件的物质进行各类物质间的转化。
答案 ②CO2+H2OH2CO3
③CO2+Ca(OH)2===CaCO3↓+H2O(或 CaO+CO2===CaCO3) ④Fe+2HCl===FeCl2+H2↑
⑤CaO+2HCl===CaCl2+H2O
⑥Ca(OH)2+2HCl===CaCl2+2H2O
⑦CaO+H2O===Ca(OH)2
[能 力 练]
13.(1)从H、O、S、K四种元素中选择合适的元素,组成属于表中第一栏类型的物质,将其化学式填在表中相应的空格内(只要求举一例)。
(2)用你在上表中所填的物质,写出符合下列要求的化学方程式:
①酸性氧化物+碱性氧化物:_______________________________________。
②酸性氧化物+足量的碱:____________________________________。
③碱性氧化物+足量的酸:___________________________________________。
答案 (1)
(2)①SO3+K2O===K2SO4
②SO3+2KOH===K2SO4+H2O
③K2O+H2SO4===K2SO4+H2O(答案合理即可)
14.
如图五角星上排列的A、B、C、D、E五种物质均为中学化学中常见的化合物,相互之间的连线表示两种物质能发生化学反应。
A、C、E均为氧化物,A是人体呼出的气体之一;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D。
(1)写出下列物质的化学式:
A________,D________;
(2)B除了制取A之外的另一种用途是______________________________________
__________________________________________________;
(3)C和E反应的化学方程式为________________________________________
_________________________________________________________________;
(4)这五种物质之间两两发生反应,其中没有涉及的基本反应类型是________。
解析 人体呼出的气体中含有水蒸气和CO2,所以A最有可能是CO2,实验室可以用大理石(或石灰石)和稀盐
酸反应制取CO2,用澄清石灰水检验CO2,CaO和H2O反应能够生成Ca(OH)2。再结合“相互之间的连线表示两种物质能发生化学反应”这一条件,可以判断出各物质,如图所示:
这五种物质之间两两发生反应时,H2O与CaO、CO2的反应都是化合反应,CO2与Ca(OH)2的反应其本质是复分解反应,HCl和CaO、Ca(OH)2的反应都是复分解反应,没有涉及分解反应和置换反应。
答案 (1)CO2 Ca(OH)2 (2)用于金属表面除锈(制造药物、可帮助消化等) (3)CaO+H2O===Ca(OH)2
(4)分解反应和置换反应
学业要求
核心素养对接
1.根据物质的组成和性质可以对物质进行分类。
2.感受分类在科研和学习中的重要作用。
3.能从物质的宏观特征入手对物质进行分类和表征。
1.通过对“物质的分类”的学习增强宏观辨识水平。
2.通过“分类方法的应用”的学习,能从物质的宏观特征入手对物质及其反应进行分类和表征。
化学反应举例
单质―→氧化物
2H2+O2eq \(=====,\s\up7(点燃))2H2O
酸性氧化物―→酸
SO3+H2O===H2SO4
酸―→盐
BaCl2+H2SO4===BaSO4↓+2HCl
碱性氧化物―→碱
Na2O+H2O===2NaOH
CaO+H2O===Ca(OH)2
而MgO不与H2O反应,但Mg(OH)2eq \(=====,\s\up7(△))MgO+H2O,Fe2O3也是如此。
碱―→盐
NaOH+HCl===NaCl+H2O
盐―→盐
AgNO3+NaCl===AgCl↓+NaNO3
物质类别
酸
碱
盐
氧化物
化学式
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
胆矾
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
苛性钠
醋酸
石灰石
水
D
苛性钠
碳酸
碳酸镁
三氧化硫
酸
强酸
HCl、H2SO4、HNO3、HI、HBr、HClO4
弱酸
H2CO3、H2S、H2SO3、HNO2、H3PO4、CH3COOH、HCN、HF
碱
强碱
NaOH、KOH、Ba(OH)2、Ca(OH)2
弱碱
NH3·H2O、Mg(OH)2、Fe(OH)2、Fe(OH)3、Cu(OH)2
(1)物质的分类⇒提升学生的宏观辨识素养
(2)交叉分类的融合⇒培养学生的科学意识与科学精神
明晰分类标准
特例举证
易错防范
A项,纯净物——只含一种组分
O2、O3混合
(1)同素异形体混合只含一种元素
(2)酸性氧化物可能为非金属氧化物如CO2,也可能为金属氧化物如Mn2O7
(3)酸为几元酸取决于电离出的H+个数而非含H原子个数
B项,酸性氧化物——与碱反应生成盐和水
非金属氧化物—含非金属元素的氧化物
Mn2O7是酸性氧化物
CO是不成盐氧化物
C项,酸——电离出的阳离子全部为H+
NaHSO4溶于水电离出H+
D项,几元酸——电离出H+的个数
CH3COOH是一元酸
药品橱
甲橱
乙橱
丙橱
丁橱
药品
盐酸,硫酸
氢氧化钠,
氢氧化钙
红磷,硫
铜,锌
选项
分类
名称(或俗名)
化学式
A
碱性氧化物
氧化铁
FeO
B
酸性氧化物
碳酸气
CO
C
酸
硫酸
H2SO3
D
盐
纯碱
Na2CO3
选项
甲
乙
丙
丁
A
H2SO4
Na2SO4
NaOH
NaCl
B
KCl
K2CO3
KOH
HCl
C
O2
CO
CuO
C
D
FeCl2
CuCl2
Zn
HCl
类型
酸性氧化物
碱性氧化物
含氧酸
碱
含氧酸盐
化学式
类型
酸性氧化物
碱性氧化物
含氧酸
碱
含氧酸盐
化学式
SO2(或SO3)
K2O
H2SO3(或H2SO4)
KOH
K2SO3(K2SO4、KHSO3或KHSO4)
第2章 元素与物质世界
第1节 元素与物质的分类
第1课时 元素与物质的关系 物质分类与物质性质
[知 识 梳 理]
知识点一 元素与物质的关系
盐酸(分析纯)的试剂标签
通过上图可以知道,盐酸是由氢元素和氯元素组成的,里面还含有其它的杂质,它们分别由什么元素组成的,元素与物质的关系究竟怎样?请完成下列知识点:
1.元素与物质的关系
(1)元素是物质的基本组成成分,物质都是由元素组成的。
(2)每一种元素都能自身组成单质;绝大多数元素都能与其他种类的元素组成化合物。而且几种元素组成化合物时,有的只能组成一种,有的则能组成几种不同的化合物。
同一种元素组成的物质不一定是单质,可能是混合物,如O2、O3
2.元素的存在形态及元素的化合价
(1)游离态:元素以单质形式存在的状态,其化合价为0。
(2)化合态:元素以化合物形式存在的状态,元素的化合价一般不为0。
(3)一种元素可以有多种化合价,金属元素只有0价和正价,非金属元素一般有0价、负价和正价。
一般认为O无最高正价,F无正价
(4)在不同的化合物中同一元素的化合价可能相同,也可能不相同。在化合物中各元素的化合价的代数和等于0。
NH4NO3中的N既有-3价,又有+5价
知识点二 物质的分类与物质性质
我们知道Ca(OH)2属于碱,其水溶液显碱性,HCl属于酸,其水溶液显酸性, 那么Ca(OH)2溶液、盐酸属于什么?物质是怎么分类的?
各个类别的物质分别有什么样的性质?请完成下列知识点:
1.物质分类的依据
(1)根据物质的元素组成分类
物质eq \b\lc\{(\a\vs4\al\c1(混合物\b\lc\{(\a\vs4\al\c1(溶液,浊液,胶体)),纯净物\b\lc\{(\a\vs4\al\c1(单质\b\lc\{(\a\vs4\al\c1(金属单质,非金属单质)),化合物\b\lc\{(\a\vs4\al\c1(氧化物\b\lc\{(\a\vs4\al\c1(金属氧化物,非金属氧化物)),酸,碱,盐\b\lc\{(\a\vs4\al\c1(正盐,酸式盐,碱式盐))))))))
酸性氧化物:能与碱反应生成盐和水的氧化物。
碱性氧化物:能与酸反应生成盐和水的氧化物。
(2)
(3)
2.根据物质类别研究物质性质
单质、氧化物、酸、碱、盐之间的相互关系
微判断
(1)Na2SO4既属于钠盐,又属于硫酸盐。(√)
(2)Na2CO3属于氧化物。(×)
(3)CuSO4·5H2O属于混合物。(×)
(4)只有一种元素组成的物质是纯净物。(×)
(5)金属铁和盐酸反应生成FeCl2和H2的反应是置换反应。(√)
微训练
1.下列化合物中依次属于氧化物、碱、盐的一组是( )
A.Na2CO3、KOH、CaO
B.CO、NaOH、KCl
C.H2O、H2SO4、NaCl
D.CuO、Cu2(OH)2CO3、CaCO3
答案 B
2.下列判断正确的是( )
A.由同一种元素组成的物质一定是纯净物
B.两种元素只能组成一种化合物
C.一种元素在同一种化合物中只能显示一种价态
D.金属元素在化合物中只显示正化合价,而非金属元素在化合物中可以显示正化合价或负化合价
解析 只由一种元素组成的物质可能是纯净物,如O2,也可能是混合物(O2和O3的混合物),A项错误;两种元素可以组成不同的化合物,如SO2和SO3,B项错误;一种元素在同一化合物中不一定只显一种价态,如NH4NO3中,N有-3价和+5价,C项错误;金属元素只有正价,非金属元素在化合物中可以显正价,也可以显负价,如SO2中S为+4价,H2S中S为-2价。
答案 D
3.有物质①O2 ②Fe ③H2SO4
④NaOH ⑤CuCl2,请回答:
(1)写出一个上述物质发生化合反应的化学方程式_________________________
___________________________________________________________;
(2)写出两个上述物质发生复分解反应的化学方程式____________________
________________________________________________________;
(3)写出两个上述物质发生置换反应的化学方程式________________________
___________________________________________________________。
答案 (1)2O2+3Feeq \(=====,\s\up7(点燃))Fe3O4
(2)H2SO4+2NaOH===Na2SO4+2H2O
CuCl2+2NaOH===Cu(OH)2↓+2NaCl
(3)Fe+H2SO4===FeSO4+H2↑
Fe+CuCl2===Cu+FeCl2
微思考
1.分类标准是唯一的吗?以酸为例说明。
提示 分类标准不是唯一的,一定要注意分类标准,如酸按酸性强弱可以分为强酸、弱酸,按电离出H+的个数可以分为一元酸、二元酸、三元酸等,按是否含氧可分为含氧酸和无氧酸,一种酸可以有多个身份,如H2SO4:强酸、二元酸、含氧酸。
2.带结晶水的化合物是纯净物吗?常见的带结晶水的化合物有哪些?
提示 带结晶水的化合物是纯净物,如CuSO4·5H2O(蓝矾、胆矾)、KAl(SO4)2·12H2O(明矾)、FeSO4·7H2O(绿矾)等。
学习任务1 常用的分类方法
【情景】 (1)走进化学实验室,你是如何找到你所需要的药品的?
提示 实验室的药品都是分类存放的。
(2)处于丰富多彩的物质世界中,为了更好地探讨物质的性质和用途,应该怎样对物质分类?
提示 交叉分类法、树状分类法。
(3)从哪些角度认为Na2CO3和Na2SO4是同类物质?
提示 纯净物,化合物,盐,正盐,钠盐,含氧酸盐。
1.交叉分类法和树状分类法的区别
(1)交叉分类法中的类别之间存在交叉关系,如Na2SO4、K2SO4分别属于钠盐、钾盐,但它们又都属于硫酸盐;
(2)树状分类法中的物质类别间存在从属关系,如盐属于化合物,而化合物又属于纯净物等。
2.物质分类的几点注意事项
(1)根据不同标准可以对化学物质和化学反应进行不同的分类,因此没有固定的分类标准,就会出现错误的分类。如:把物质分为混合物、纯净物、化合物,就是分类标准不统一导致的错误。混合物和纯净物是并列关系,而纯净物包含化合物。
(2)概念间的关系——“并列”与“包含”。
①并列关系:纯净物与混合物,单质与化合物,酸与碱、盐;
②包含关系:纯净物>化合物>氧化物。
(3)酸的元数是酸电离出H+的个数,而不是分子中氢原子的个数,如CH3COOH是一元酸而不是四元酸。
(4)非金属氧化物不一定是酸性氧化物,如CO,酸性氧化物也不一定是非金属氧化物,如Mn2O7为酸性氧化物。
(5)金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。但碱性氧化物一定是金属氧化物。
【例题1】 纯净物根据其组成和性质可进行如下分类。
(1)如图所示的分类方法属于________(填字母)。
A.交叉分类法 B.树状分类法
(2)以H、O、S、N、K、Ca六种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填在下表相应类别中:
(3)从上表中选出一种酸和一种氧化物,写出其反应的化学方程式:_____________________________________________________________
__________________________________________________________。
解析 (1)图中是对同类事物按照某种属性进行再分类的分类法,属于树状分类法。
(2)题干中的六种元素可以形成H2SO4、HNO3、H2S等酸;可以形成KOH、Ca(OH)2、NH3·H2O等碱;可以形成Ca(NO3)2、KNO3、K2SO4、CaSO4、NH4NO3等盐;可以形成的氧化物有H2O、SO2、NO、NO2、K2O、CaO等。
(3)能够与酸反应的氧化物一般为金属氧化物,如CaO+2HNO3===Ca(NO3)2+H2O、K2O+H2SO4===K2SO4+H2O。
答案 (1)B
(2)H2SO4 KOH KNO3 K2O(其他合理答案也可以)
(3)K2O+H2SO4===K2SO4+H2O
变式训练1 下列物质分类的正确组合是( )
解析 A项中纯碱属于盐而不属于碱;B项中CO不能与碱反应,不属于酸性氧化物;C项中水不属于酸性氧化物。
答案 D
学习任务2 常见分类法的应用
生活中,我们往往用到分类记忆法,如:
水果:苹果、桃、梨
人物:王峰、鲍雲、王昱珩
球类:足球、篮球、乒乓球
动物:狗、马、猫
化学学习也用到分类法掌握物质的性质。
1.金属单质(以Fe为例)的通性是什么?
提示
2.氧化物(以CO2、CaO为例)的通性是什么?
提示
3.酸(以稀盐酸为例)的通性是什么?
提示
4.碱[以Ca(OH)2为例]的通性是什么?
提示
eq \x(碱)—
5.盐(以Na2CO3为例)的通性是什么?
提示
氧化物的分类中的特殊物质
(1)碱性氧化物指能与酸反应生成盐和水的氧化物。碱性氧化物都是金属氧化物,但金属氧化物不一定都是碱性氧化物,如Mn2O7为酸性氧化物。
(2)酸性氧化物指能与碱反应生成盐和水的氧化物。非金属氧化物不一定都是酸性氧化物,如CO、H2O等;酸性氧化物也不一定都是非金属氧化物,如Mn2O7。
(3)CO、NO等不能与碱反应生成盐,故属于不成盐氧化物。
(4)Na2O2、Na2O都能与酸反应,如:Na2O+2HCl===2NaCl+H2O;2Na2O2+4HCl===4NaCl+2H2O+O2↑,Na2O2和Na2O不都是碱性氧化物。与酸反应生成盐和水的氧化物属于碱性氧化物,Na2O符合概念,Na2O2与酸反应不仅生成盐和水,还生成了O2,故Na2O2不属于碱性氧化物。
【例题2】 在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在如图所示的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
(1)请推断它们的化学式分别为①________;②________;③________;④________;⑤________。
(2)写出下列序号之间的化学方程式:
①和②:______________________________________________;
②和④:_____________________________________________;
②和⑤:______________________________________________;
③和④:_____________________________________________。
解析 据单质①能和酸②发生化学反应,推知①应为活泼金属单质即为铁,而酸只有稀H2SO4,即②为稀H2SO4,则氧化物④应为金属氧化物CaO,从而氧化物③为酸性氧化物,即CO2,⑤属于盐且其溶液既能与H2SO4反应,又能与CaO反应,则⑤应为Na2CO3。
答案 (1)Fe H2SO4 CO2 CaO Na2CO3
(2)Fe+H2SO4===FeSO4+H2↑
CaO+H2SO4===CaSO4+H2O
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
变式训练2 A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A.铜 B.碳 C.铁 D.钙
解析 A为CaO,B为Ca(OH)2,C为Ca(NO3)2,D为CaCl2,E为CaCO3。
答案 D
学习任务3 (核心素养)常见酸、碱分类
一、知识要点
二、核心素养
【素养解题】
[典例示范] 依据物质的分类标准,下列有关说法正确的是( )
A.同种元素组成的物质一定是纯净物
B.酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物
C.能电离出H+的一定是酸
D.在酸中有几个H原子就一定是几元酸
[分类问题解题思维模型]
答案 B
三、对点训练
1.墨鱼骨粉(主要成分为CaCO3)可作治疗胃酸过多的药剂。CaCO3属于( )
A.氧化物B.酸
C.碱D.盐
解析 CaCO3 是由钙离子和碳酸根离子构成的化合物,属于盐,D项正确。
答案 D
2.下列物质中属于氧化物的是( )
A.冰水混合物B.氧气
C.氯酸钾D.乙醇
解析 A项,冰水混合物是水,水是由氧元素和氢元素组成的化合物,属于氧化物,A项正确;B项,只含有氧元素,是单质,B项错误;C项,氯酸钾是由三种元素组成的化合物,不属于氧化物,C项错误;D项,乙醇含有三种元素,是含氧化合物,D项错误。
答案 A
3.原油是一种没有固定沸点的液态物质,加热原油使不同沸点的组分分别汽化,然后冷凝,就能得到汽油、煤油、柴油等产品。由此可以判断原油属于( )
A.化合物B.混合物
C.单质D.纯净物
解析 由题干所给信息可知,原油没有固定的沸点,汽化冷凝后能得到不同的产品,所以原油属于混合物。
答案 B
4.请按下列线索提示画出Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl的树状分类图:
解析 要正确填写树状分类图,必须首先明确各物质的组成和性质差异。依据基本化学知识即可解决。
答案 Fe、Cu S、H2 HCl、H2SO4 NaOH、Ba(OH)2 NaCl、NaHCO3 K2O、CuO
[学 考 练]
1.下列对Na2CO3的叙述中不正确的是( )
A.该物质属于盐类
B.该物质既含金属元素又含非金属元素
C.该物质不能发生化合反应
D.该物质有时候能和NaOH划为一类
解析 Na2CO3既含金属元素又含非金属元素(酸根离子),属于盐类,与NaOH具有相同的阳离子。Na2CO3能和水、二氧化碳发生化合反应生成NaHCO3。
答案 C
2.Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是(已知Na2O与水反应生成NaOH)( )
①钠的化合物 ②能与硝酸反应的物质 ③可溶于水的物质 ④水溶液导电 ⑤钠盐 ⑥钠的含氧化合物
A.①④⑤B.①②⑤⑥
C.①③④D.②⑤⑥
解析 物质都是钠的化合物,①对;NaCl、Na2SO4都不能与硝酸反应,②错误;都是可溶于水的物质,③对;Na2O与水反应生成NaOH,酸、碱、盐的水溶液导电,④对;Na2O、NaOH不属于钠盐,⑤错误;NaCl不属于钠的含氧化合物,⑥错误。
答案 C
3.下列各组物质按酸、碱、盐依次排列的是( )
A.醋酸、乙醇、氯化钠
B.硝酸、烧碱、纯碱
C.碳酸氢钠、氢氧化铜、硫酸钾
D.盐酸、熟石灰、苛性钠
解析 A.醋酸电离出的阳离子全部是H+,属于酸;乙醇是有机物,不属于碱;氯化钠是由钠离子和氯离子组成的化合物,属于盐,故A错误;B.硝酸电离出的阳离子全部是H+,属于酸;烧碱即NaOH电离出的阴离子全部是OH-,属于碱;纯碱即碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐,故B正确;C.碳酸氢钠是钠离子和碳酸氢根离子组成的化合物,属于盐;氢氧化铜电离出的阴离子全部是OH-,属于碱;硫酸钾是由钾离子和硫酸根离子组成的化合物,属于盐,故C错误;D.盐酸是HCl和水的混合物;熟石灰即氢氧化钙电离出的阴离子全部是OH-,属于碱;苛性钠即NaOH电离出的阴离子全部是OH-,属于碱,故D错误。
答案 B
4.实验室里有4个药品橱,已经存放以下物品:
实验室新购进一些碘,应该将这些碘放在( )
A.甲橱B.乙橱
C.丙橱D.丁橱
解析 碘是非金属单质。
答案 C
5.下列选项中各物质的分类、名称(或俗名)、化学式都正确的是( )
解析 A项中氧化铁的化学式为Fe2O3;B项中碳酸气应为CO2;C项中硫酸的化学式为H2SO4。
答案 D
6.下列说法正确的是( )
A.纯净物一定由分子构成
B.同种分子构成的物质一定是纯净物
C.混合物肯定由两种以上元素组成
D.含有氧元素的化合物都是氧化物
解析 纯净物可以由同种分子构成,如水、O2等,也可以由同种原子构成,如稀有气体,还可以由离子构成,A错误,B正确;混合物可以由两种以上元素组成,也可以由一种元素组成,如金刚石和石墨的混合物,只含碳元素,C错误;含氧元素的化合物不一定是氧化物,如Na2CO3、H2SO4等,D错误。
答案 B
7.下列分类正确的是( )
A.酸:CH3COOH、H2SO3、NaHCO3、HF
B.碱:Cu2(OH)2CO3、NaOH、Fe(OH)2、Mg(OH)2
C.盐:AgCl、BaSO4、NaH2PO4、Mg(NO3)2
D.氧化物:FeO、N2O5、COCl2、SiO2
解析 A项中NaHCO3属于盐;B项中Cu2(OH)2CO3属于碱式盐;氧化物是指由两种元素组成,其中一种元素为氧元素的化合物,D项中COCl2不属于氧化物。
答案 C
8.如下图所示,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
解析 A中甲和乙、乙和丙、丙和丁、丁和甲均不能反应,丁也不能转化为乙;B中甲和乙、乙和丙、丁和甲之间也不能反应,丁也不能转化为乙,故A、B不符合题意。C中反应依次为甲和乙:2CO+O2eq \(=====,\s\up7(点燃))2CO2;乙和丙:CO+CuOeq \(=====,\s\up7(△))Cu+CO2;丙和丁:2CuO+Ceq \(=====,\s\up7(高温))2Cu+CO2↑;甲和丁:C+O2eq \(=====,\s\up7(点燃))CO2;丁→乙:2C+O2eq \(=====,\s\up7(点燃))2CO。D中,甲和乙、丁和甲均不能反应,故D不符合题意。
答案 C
9.KOH是我国古代纺织业常用于漂洗的洗涤剂。古代制取KOH的流程如下:
上述流程中没有涉及的化学反应类型是( )
A.化合反应B.分解反应
C.置换反应D.复分解反应
解析 该过程中发生的反应依次是CaCO3eq \(=====,\s\up7(高温))CaO+CO2↑(分解反应);CaO+H2O===Ca(OH)2(化合反应);Ca(OH)2+K2CO3===CaCO3↓+2KOH(复分解反应)。
答案 C
10.(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写到下面的适当位置。
物质eq \b\lc\{(\a\vs4\al\c1(纯净物\b\lc\{(\a\vs4\al\c1(化合物:① ,单质\b\lc\{(\a\vs4\al\c1(金属单质:② ,非金属单质:③ )))),混合物:④ ))
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:______________________________________________________。
②化合反应:______________________________________________。
③置换反应:___________________________________________。
④复分解反应:________________________________________________。
解析 (1)碳酸钙属于化合物,稀盐酸属于混合物,铁属于金属单质,氧气属于非金属单质。(2)CaCO3可以受热分解,Fe和O2可以化合生成Fe3O4,盐酸和铁可以发生置换反应。CaCO3与盐酸可以发生复分解反应。
答案 (1)①碳酸钙 ②铁 ③氧气 ④稀盐酸
(2)①CaCO3eq \(=====,\s\up7(高温))CaO+CO2↑
②3Fe+2O2eq \(=====,\s\up7(点燃))Fe3O4
③Fe+2HCl===FeCl2+H2↑
④CaCO3+2HCl===CaCl2+H2O+CO2↑
11.现有下列八种物质:①纯碱,②盐酸,③稀硫酸,④氯化钙溶液,⑤烧碱,⑥二氧化碳,⑦氧化铁,⑧氢氧化铁。按下列要求写出反应的化学方程式:
(1)无氧酸与钠盐:________________________________________。
(2)可溶性碱与无氧酸:____________________________________________。
(3)两种盐溶液:_______________________________________________________。
(4)酸性氧化物与可溶性碱:___________________________________________。
(5)含氧酸与不溶性碱:_________________________________________________。
解析 根据要求选择合适的物质。盐酸是无氧酸,纯碱是钠盐,碱有可溶性的烧碱和不溶性的氢氧化铁,硫酸是含氧酸,二氧化碳是酸性氧化物。
答案 (1)2HCl+Na2CO3===2NaCl+H2O+CO2↑
(2)NaOH+HCl===NaCl+H2O
(3)CaCl2+Na2CO3===2NaCl+CaCO3↓
(4)CO2+2NaOH===Na2CO3+H2O
(5)3H2SO4+2Fe(OH)3===Fe2(SO4)3+6H2O
12.单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示。限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
①C+O2eq \(=====,\s\up7(点燃))CO2;
②__________________________________________________________;
③_________________________________________________________;
④__________________________________________________________;
⑤______________________________________________________________;
⑥__________________________________________________________;
⑦______________________________________________________________。
解析 属于同一类的物质必定符合同一标准,就会有某一共同的性质,利用一类物质和另一类物质之间的关系,就可以找出物质之间转化的方法:
非金属eq \(――→,\s\up7(氧气),\s\d5(①))酸性氧化物eq \b\lc\{(\a\vs4\al\c1(\(――→,\s\up7(碱性氧化物))盐,\(――→,\s\up7(碱))盐,\(――→,\s\up7(水))酸));金属eq \(――→,\s\up7(氧气))碱性氧化物eq \b\lc\{(\a\vs4\al\c1(\(――→,\s\up7(酸性氧化物))盐,\(――→,\s\up7(酸))盐,\(――→,\s\up7(水))碱)),该题对各类物质之间的转化限定了8种物质,从这8种物质中选出符合条件的物质进行各类物质间的转化。
答案 ②CO2+H2OH2CO3
③CO2+Ca(OH)2===CaCO3↓+H2O(或 CaO+CO2===CaCO3) ④Fe+2HCl===FeCl2+H2↑
⑤CaO+2HCl===CaCl2+H2O
⑥Ca(OH)2+2HCl===CaCl2+2H2O
⑦CaO+H2O===Ca(OH)2
[能 力 练]
13.(1)从H、O、S、K四种元素中选择合适的元素,组成属于表中第一栏类型的物质,将其化学式填在表中相应的空格内(只要求举一例)。
(2)用你在上表中所填的物质,写出符合下列要求的化学方程式:
①酸性氧化物+碱性氧化物:_______________________________________。
②酸性氧化物+足量的碱:____________________________________。
③碱性氧化物+足量的酸:___________________________________________。
答案 (1)
(2)①SO3+K2O===K2SO4
②SO3+2KOH===K2SO4+H2O
③K2O+H2SO4===K2SO4+H2O(答案合理即可)
14.
如图五角星上排列的A、B、C、D、E五种物质均为中学化学中常见的化合物,相互之间的连线表示两种物质能发生化学反应。
A、C、E均为氧化物,A是人体呼出的气体之一;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D。
(1)写出下列物质的化学式:
A________,D________;
(2)B除了制取A之外的另一种用途是______________________________________
__________________________________________________;
(3)C和E反应的化学方程式为________________________________________
_________________________________________________________________;
(4)这五种物质之间两两发生反应,其中没有涉及的基本反应类型是________。
解析 人体呼出的气体中含有水蒸气和CO2,所以A最有可能是CO2,实验室可以用大理石(或石灰石)和稀盐
酸反应制取CO2,用澄清石灰水检验CO2,CaO和H2O反应能够生成Ca(OH)2。再结合“相互之间的连线表示两种物质能发生化学反应”这一条件,可以判断出各物质,如图所示:
这五种物质之间两两发生反应时,H2O与CaO、CO2的反应都是化合反应,CO2与Ca(OH)2的反应其本质是复分解反应,HCl和CaO、Ca(OH)2的反应都是复分解反应,没有涉及分解反应和置换反应。
答案 (1)CO2 Ca(OH)2 (2)用于金属表面除锈(制造药物、可帮助消化等) (3)CaO+H2O===Ca(OH)2
(4)分解反应和置换反应
学业要求
核心素养对接
1.根据物质的组成和性质可以对物质进行分类。
2.感受分类在科研和学习中的重要作用。
3.能从物质的宏观特征入手对物质进行分类和表征。
1.通过对“物质的分类”的学习增强宏观辨识水平。
2.通过“分类方法的应用”的学习,能从物质的宏观特征入手对物质及其反应进行分类和表征。
化学反应举例
单质―→氧化物
2H2+O2eq \(=====,\s\up7(点燃))2H2O
酸性氧化物―→酸
SO3+H2O===H2SO4
酸―→盐
BaCl2+H2SO4===BaSO4↓+2HCl
碱性氧化物―→碱
Na2O+H2O===2NaOH
CaO+H2O===Ca(OH)2
而MgO不与H2O反应,但Mg(OH)2eq \(=====,\s\up7(△))MgO+H2O,Fe2O3也是如此。
碱―→盐
NaOH+HCl===NaCl+H2O
盐―→盐
AgNO3+NaCl===AgCl↓+NaNO3
物质类别
酸
碱
盐
氧化物
化学式
碱
酸
盐
酸性氧化物
A
纯碱
盐酸
胆矾
二氧化硫
B
烧碱
硫酸
食盐
一氧化碳
C
苛性钠
醋酸
石灰石
水
D
苛性钠
碳酸
碳酸镁
三氧化硫
酸
强酸
HCl、H2SO4、HNO3、HI、HBr、HClO4
弱酸
H2CO3、H2S、H2SO3、HNO2、H3PO4、CH3COOH、HCN、HF
碱
强碱
NaOH、KOH、Ba(OH)2、Ca(OH)2
弱碱
NH3·H2O、Mg(OH)2、Fe(OH)2、Fe(OH)3、Cu(OH)2
(1)物质的分类⇒提升学生的宏观辨识素养
(2)交叉分类的融合⇒培养学生的科学意识与科学精神
明晰分类标准
特例举证
易错防范
A项,纯净物——只含一种组分
O2、O3混合
(1)同素异形体混合只含一种元素
(2)酸性氧化物可能为非金属氧化物如CO2,也可能为金属氧化物如Mn2O7
(3)酸为几元酸取决于电离出的H+个数而非含H原子个数
B项,酸性氧化物——与碱反应生成盐和水
非金属氧化物—含非金属元素的氧化物
Mn2O7是酸性氧化物
CO是不成盐氧化物
C项,酸——电离出的阳离子全部为H+
NaHSO4溶于水电离出H+
D项,几元酸——电离出H+的个数
CH3COOH是一元酸
药品橱
甲橱
乙橱
丙橱
丁橱
药品
盐酸,硫酸
氢氧化钠,
氢氧化钙
红磷,硫
铜,锌
选项
分类
名称(或俗名)
化学式
A
碱性氧化物
氧化铁
FeO
B
酸性氧化物
碳酸气
CO
C
酸
硫酸
H2SO3
D
盐
纯碱
Na2CO3
选项
甲
乙
丙
丁
A
H2SO4
Na2SO4
NaOH
NaCl
B
KCl
K2CO3
KOH
HCl
C
O2
CO
CuO
C
D
FeCl2
CuCl2
Zn
HCl
类型
酸性氧化物
碱性氧化物
含氧酸
碱
含氧酸盐
化学式
类型
酸性氧化物
碱性氧化物
含氧酸
碱
含氧酸盐
化学式
SO2(或SO3)
K2O
H2SO3(或H2SO4)
KOH
K2SO3(K2SO4、KHSO3或KHSO4)













