

【化学】安徽省合肥市六校2019-2020学年高二上学期期末考试试卷
展开安徽省合肥市六校2019-2020学年高二上学期期末考试试卷
(考试时间:90分钟 满分:100分)
相对原子质量:Mn: 55 Cl: 35.5 Cu:64 O:16
一、选择题:(本大题共16小题,每题3分,共48分。每小题只有一个正确答案,请把正确答案涂在答题卡上)
1.下列对生产、生活中的有关问题认识正确的是( )
A. 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
B. 采用催化转换技术不能提高汽车尾气中有害气体的转化率
C. 食品中加抗氧化剂可延长保质期,这与反应速率无关
D. 氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理
2.下列关于热化学反应的描述中正确的是 ( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热
ΔH=-114.6kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
3.下列说法中,正确的是:( )
A.对于△S>0的反应,若在任何条件下均能自发进行,则该反应△H>0
B. pH=2和pH=4的两种酸混合,其混合后溶液的pH一定在2到4之间
C.合成氨反应: N2(g)+3H2(g) ⇌ 2NH3(g)△H<0,升高温度有利于提高反应物的转化率
D. 氢氧燃料电池比氢气直接在空气中燃烧发电,能量转换率高
4.下列实验操作,能有效改变反应速率且达到变化要求的是( )
A.为增大泡沫灭火器中Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物
B.为加快盐酸和过量锌粒制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液
C.在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠
D.用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用
6 mL乙醇、4 mL浓H2SO4、4 mL冰醋酸
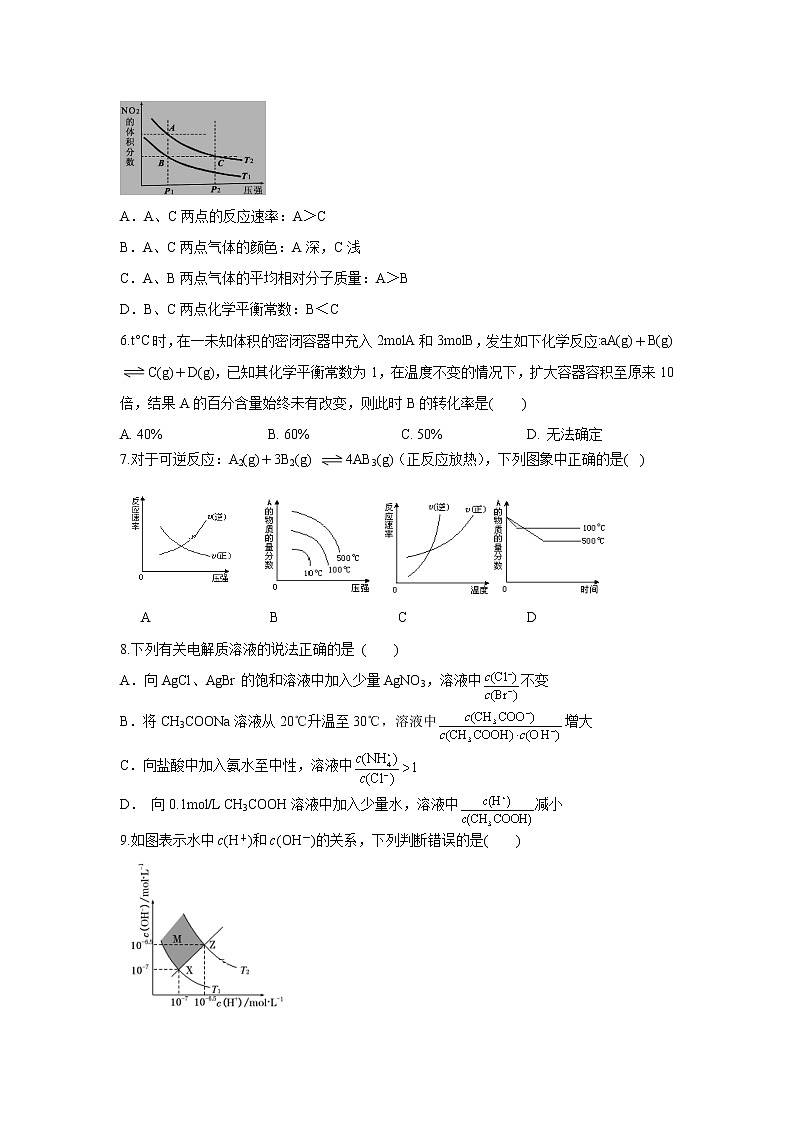
5.反应N2O4(g)2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B<C
6.t°C时,在一未知体积的密闭容器中充入2molA和3molB,发生如下化学反应:aA(g)+B(g) C(g)+D(g),已知其化学平衡常数为1,在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则此时B的转化率是( )
A. 40% B. 60% C. 50% D. 无法确定
7.对于可逆反应:A2(g)+3B2(g) 4AB3(g)(正反应放热),下列图象中正确的是( )
A B C D
8.下列有关电解质溶液的说法正确的是 ( )
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不变
B.将CH3COONa溶液从20℃升温至30℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中
D. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中减小
9.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)×c(OH-)=KW
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
10.下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;
若pH<7,则H2A是强酸
C.用0.2000 mol·L -1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸
的浓度均约为0.1 mol·L -1),至中性时,溶液中的酸未被完全中和
D.体积相同、pH相同的醋酸和盐酸完全溶解足量的镁粉,产生等量的氢气
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
B.0.1 mol·L-1 Na2CO3溶液:K+、Al3+、NO3-、Cl-
C.pH=3.5的溶液:K+、NH4+、I-、Fe3+
D.0.1 mol·L-1 NaOH溶液:K+、Na+、AlO2-、CO32-
12.下列表达式书写正确的是( )
A.NaHCO3的电离方程式:NaHCO3Na++H++CO32-
B.HS-的水解方程式:HS-+H2OH3O++S2-
C.CO32-的水解方程式:CO32-+2H2OH2CO3+2OH-
D.BaSO4的沉淀溶解平衡表达式:BaSO4(s) Ba2+(aq)+SO42-(aq)
13.某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是( )
A.含有大量SO42-的溶液中肯定不存在Ag+
B.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
14.下列溶液中各微粒的浓度关系正确的是( )
A.pH=4的盐酸中:c(H+)=4.0 mol·L-1
B.CH3COONa溶液中:c(CH3COO-)=c( Na+ )
C.NaCl溶液中:c( Na+ )= c(Cl-)
D.NaHCO3溶液中:c( Na+)+ c(H+) =c(HCO3-)+c(OH-)+ c(CO32-)
15.为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效
沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如下图所示。
电池反应为Zn(s)+2NiOOH(s)+H2O(l)ZnO(s)+2Ni(OH)2(s)。
下列说法错误的是( )
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH−通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e− Zn(s)+2OH−(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e− Ni(OH)2(s)+OH−(aq)
16.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、足量的CuSO4溶液和足量的 K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加6.4g。以下说法不正确的是:( )
A. 电源的N端为正极
B. 电极b上发生的电极反应为4OH--4e-=2H2O+O2↑
C. b电极上生成气体1.12L,e电极上生成气体0.2 g
D. 如果电解过程中铜全部析出,此时电解继续进行
二、填空题:(共52分。)
17.(12分) 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出
145.0 kJ热量,写出该反应的热化学方程式: ___ __________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:
4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,
则反应过程中,每转移1 mol电子放出的热量为_______。
(5) 已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH=__________________。
(6)已知拆开1 mol H—H键,1 mol N—H键,1mol N≡N键分别需要的能量是436 kJ、
391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:
___________________________________________________________。
18.(10分)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是
。若电解电路中通过2mol电子,MnO2的理论产量为 。
19.(14分)煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1) NaClO2中Cl元素的价态为_______。
(2)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol·L−1 。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①在NaClO2溶液脱硝的主要反应中,参加反应的n(ClO2-):n(NO)= 增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“升高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pc如下图所示:
=
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均_ __(填“增大”“不变”或“减小”)。
②反应ClO2−+2SO32−===2SO42−+Cl−的平衡常数K表达式为___________。
20.(16分) 已知:I2+2S2O===S4O+2I-;CuI是不溶于水的白色沉淀。
相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入____ ____,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=__ ______。过滤后,将所得滤液低温蒸发、浓缩结晶,可得CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是(用文字叙述):
_________________ ____________。
由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______ ____。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用______ __作滴定指示剂,滴定终点的现象是__________________ ____。
②CuCl2溶液与KI反应的离子方程式为__________ ________________。
③该试样中CuCl2·2H2O的质量百分数为____ ____
【参考答案】
(考试时间:90分钟 满分:100分)
一、选择题:(本大题共16小题,每题3分,共48分。每小题只有一个正确答案,请把正确答案涂在答题卡上)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
答案 | B | B | D | C | D | A | C | A |
题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
答案 | D | C | D | D | B | C | B | C |
二、填空题(共52分)
17.(共12分)
(1)M (1分) (2)< (1分)
(3)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290.0 kJ·mol-1(3分)
(4)98.0 kJ (2分)(5) —80 kJ·mol-1(2分)
(6)N2(g)+3H2(g) 2NH3(g) ΔH=-92.0 kJ·mol-1 (3分)
18.(共10分)
(1)Zn(或锌) (1分) , 正极 (1分)
(2)锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀 (2分) , b (2分)
(3)2H++2e-→H2 (2分),87g(2分)
19. (共14分)
(1)+3;(1分)
(2)① 3:4(2分); 提高(2分) ②降低;(2分) ③大于(1分);SO2的还原性强于NO(2分)
(3)①增大;(2分) ②(2分)
20.(共16分)
(1)Cu(OH)2或Cu2(OH)2CO3 或CuO(2分) ; 2.6×10-9 mol·L-1 (2分)
(2)CuCl2在加热过程中水解被促进,产生Cu(OH)2,且生成的HCl易挥发脱离体系,造成完全水解。(2分)(答出:产生Cu(OH)2,得1分;答出:HCl挥发,得1分。)
在干燥的HCl气流中加热(2分)
(3)①淀粉溶液 (1分) 蓝色褪去,维持半分钟不变蓝 (2分)
②2Cu2++4I-===2CuI↓+I2 (2分)
③95%(3分)








