
【化学】安徽省黄山市2019-2020学年高二下学期期末考试
展开安徽省黄山市2019-2020学年高二下学期期末考试
(考试时间:100分钟 满分:100分)
注意事项:
1.答题前在答题卡上填写好自己的姓名、班级、考号等信息。
2.请将选择题答案用2B铅笔正确填写在答题卡上;请将非选择题答案用黑色中性笔正确填写在答案卡上。
可能用到的相对原子质量:H-1 Li-7 B-11 C-12 N-14 O-16 Na-23 K-39 Cu-64
第I卷(选择题 共45分)
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题目要求,请将答案填在答题卷上。)
1.化学与生活、生产、科技密切相关。下列说法错误的是
A. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
B. 中国天眼传输信息用的光纤材料的主要成分是高纯硅
C. 研发新能源,减少化石燃料使用,与“绿水青山就是金山银山”的绿色发展理念一致
D. 港珠澳大桥用到的合金材料,具有强度大、耐腐蚀等性能
2.下列物质中,属于纯净物的是
①陶瓷 ②水泥 ③玻璃 ④漂白粉 ⑤胆矾 ⑥氯水 ⑦液氯
A. ①③⑤ B. ②④⑥ C. ⑥⑦ D. ⑤⑦
3.下列化学用语表达正确的是
A. CaCl2的电子式:
B. Cl-的结构示意图:
C. 乙烯的分子式:C2H4
D. 纯碱溶液呈碱性的原因:CO32-+2H2OH2CO3+2OH-
4.把各组中的气体通入相应溶液中,溶液的导电能力显著增强的是
A. NH3(g)通入CH3COOH溶液
B. CO2(g)通入石灰水
C. CO2(g)通入NaOH溶液
D. NH3(g)通入盐酸中
5.设NA为阿伏加德罗常数的值,下列说法正确的是
A. 28gN2与6gH2充分反应,生成NH3分子的数目为2NA
B. 6.4gCu与过量S充分反应,转移电子的数目为0.2NA
C. 标准状况下,2.24L 三氯甲烷中有分子的数目为0.1NA
D. 25°C时,1L pH=1的NaHSO4溶液中含有H+的数目为0.1NA
6.某溶液中含有HCO3-、SO32-、CO32-、CH3COO- 4种阴离子。若向其中加入适量的Na2O2固体充分反应后,忽略溶液体积变化,溶液中离子浓度基本保持不变的是
A. SO32- B. CH3COO- C. CO32- D. HCO3-
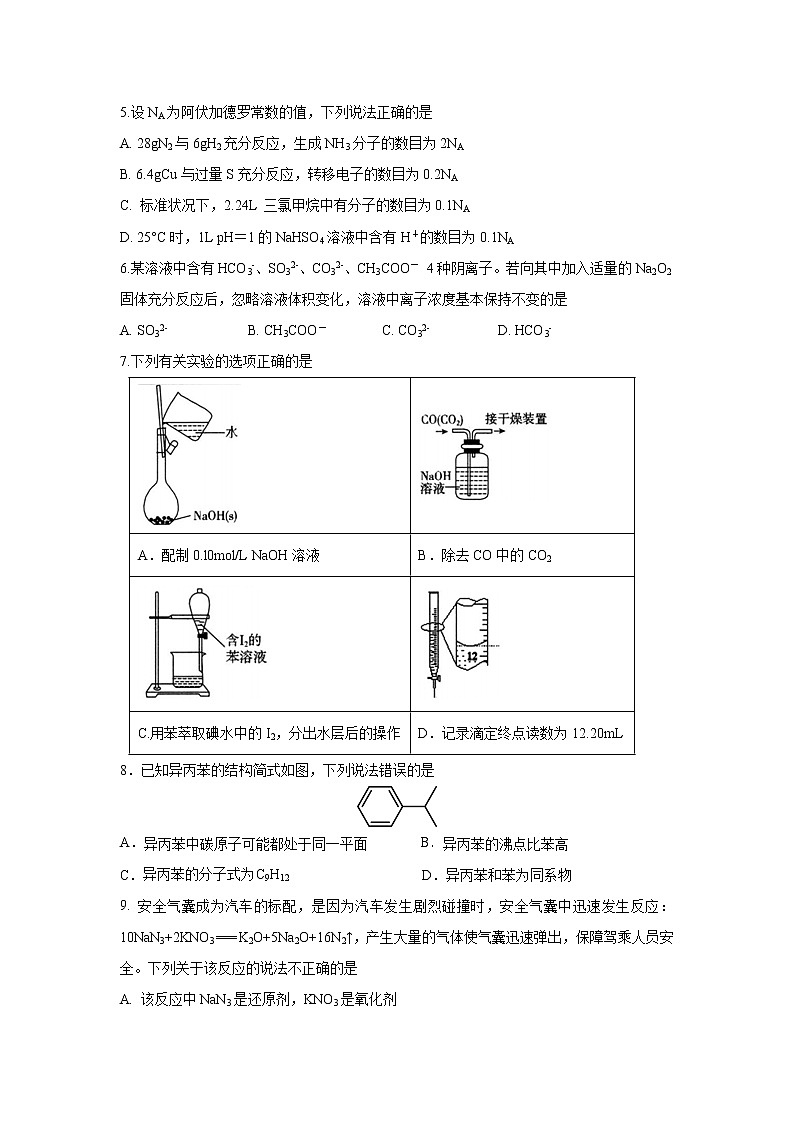
7.下列有关实验的选项正确的是
A.配制0.l0mol/L NaOH溶液 | B.除去CO中的CO2 |
C.用苯萃取碘水中的I2,分出水层后的操作 | D.记录滴定终点读数为12.20mL |
8.已知异丙苯的结构简式如图,下列说法错误的是
A.异丙苯中碳原子可能都处于同一平面 B.异丙苯的沸点比苯高
C.异丙苯的分子式为 C9H12 D.异丙苯和苯为同系物
9. 安全气囊成为汽车的标配,是因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘人员安全。下列关于该反应的说法不正确的是
A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e−,可生成标准状况下N2的体积为35.84 L
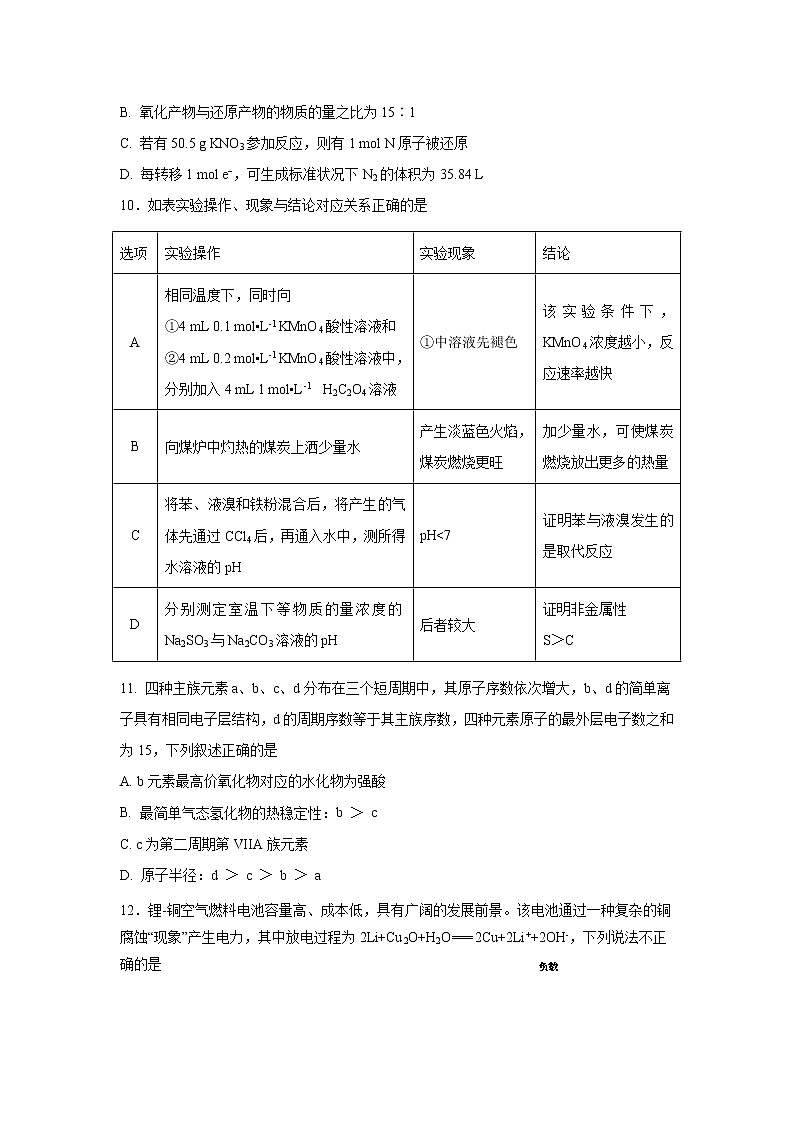
10.如表实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 mol▪L-1 KMnO4酸性溶液和 ②4 mL 0.2 mol▪L-1 KMnO4酸性溶液中,分别加入4 mL 1 mol▪L-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水,可使煤炭燃烧放出更多的热量 |
C | 将苯、液溴和铁粉混合后,将产生的气体先通过CCl4后,再通入水中,测所得水溶液的pH | pH<7 | 证明苯与液溴发生的是取代反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
11. 四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的周期序数等于其主族序数,四种元素原子的最外层电子数之和为15,下列叙述正确的是
A. b元素最高价氧化物对应的水化物为强酸
B. 最简单气态氢化物的热稳定性:b > c
C. c为第二周期第VIIA族元素
D. 原子半径:d > c > b > a
12.锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜
腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正
确的是
A. 放电时,正极的电极反应式为:Cu2O + H2O + 2e- = 2Cu+2OH-
B.放电时,电子透过固体电解质向Li极移动
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
13.以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下,下列说法正确的是
A.粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B.电解时用粗银作阴极,硝酸银溶液为电解质溶液
C.用稀硫酸处理渣料时主要发生了氧化还原反应
D.从滤液 B 中可以提取绿矾(FeSO4•7H2O)
14. 有机物甲分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有
A. 8种 B. 10种 C. 12种 D. 16种
15. 25°C时,用浓度为0.01mol∙L-1的HA溶液滴定20mL浓度为0.01mol∙L-1的NaOH溶液,滴定曲线如下图所示。下列说法错误的是
A. 应选用酚酞作指示剂
B. M点溶液中存在:c(Na+)>c(A-)
C.
D. N点溶液中存在:
第II卷 (非选择题 共55分)
考生须知:共计4道题,16-18题为必考题,共40分;19题为选考题,共15分。
二、必考题:
16.(13分)
氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备
① 氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
② 欲收集一瓶干燥氨气,选择上图中的装置,其连接顺序为:发生装置→____ _(按
气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
17.(13分)
某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:
(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分MgCO3发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+,
①加入30%H2O2后,检验溶液中是否含有Fe2+的最佳试剂是_________________。
②萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是__________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol·L−1)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:① Ksp[Al(OH)3]=1.0×10-33;② pH=8.5时,Mg(OH)2开始沉淀
(5)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象是____________________________。
18. (14分)
H2 是一种重要的清洁能源。
(1)已知: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0kJ•mol-1
CO(g)+H2O(g)CO2(g)+H2(g) ΔH3= -41.1 kJ•mol-1
H2 还原 CO 反应合成甲醇的热化学方程式为:CO(g)+2H2(g)CH3OH(g) ΔH1
则ΔH1= kJ•mol-1,该反应自发进行的条件为 。
A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入 1mol CO
和2.2 mol H2,发生反应 CO(g)+2H2(g) CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1 P2,判断的理由是
。
(3)若反应 CO(g)+2H2(g) CH3OH(g)在温度不变且体积恒定为1L的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 |
| 2 |
|
CO | 2 |
|
| 1 |
CH3OH(g) | 0 | 0.7 |
|
|
① 下列各项能作为判断该反应达到平衡标志的是 (填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
② 若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp= (kPa)-2
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③ 反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=
kPa•min-1。
三、选考题
以下是选考题,共有2个小题,考生任选其中一题作答,若两题都做,按第一题计分。
19.(15分)
选考题I-物质结构与性质
硼及其化合物在工农业生产中具有广泛应用。 请回答下列问题:
(1)基态B原子的价电子排布图为 ,B属于元素周期表中的 区元素。
(2)NaBO2可用于织物漂白。
① 第二周期中第一电离能介于B和O之间的元素为 (填元素符号)。
② BO2-的空间构型为 ,写出两种与其互为等电子体的分子的化学式: 。
(3)BF3和F-可以形成BF4-,BF3和BF4-中B原子的杂化方式分别为 、 。
(4)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为 。
(5)-种新型轻质储氢材料的晶胞结构如图所示:
①化合物的化学式为 。
②设阿伏加德罗常数的值为NA,该晶体的密度为 g∙cm-3(用含a、NA的代数式表示)。
20.(15分)
选考题II-有机化学基础
有机化合物G可用来制备抗凝血药,可通过下列路线合成。
请回答:
(1)C+E→F的反应类型是 ,F中含有的官能团名称为 。
(2)在A→B的反应中,检验A是否反应完全的试剂为 。
(3)写出G和过量NaOH溶液共热时反应的化学方程式 。
(4)化合物E的同分异构体很多,符合下列条件的结构共 种。
①能与氯化铁溶液发生显色;②能发生银镜反应;③能发生水解反应;④苯环上只有两个取代基。其中,核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的结构简式为 。
(5)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数
据)完全相同,该仪器是 (填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(6)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯是一种重要的有机合成中间体。
请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。
参考答案
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题目要求)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | B | D | C | A | D | B | B | A | C | C |
题号 | 11 | 12 | 13 | 14 | 15 |
|
|
|
|
|
答案 | A | B | D | D | C |
|
|
|
|
|
二、必考题(本题包括3大题,共40分)
16.(除第一空1分外,其余每空2分,共13分)
(1) A(或B)(1分) 2NH4Cl+Ca(OH)22NH3↑+ CaCl2+2H2O
(或B NH3·H2ONH3↑+H2O ) d→c→f→e→i
(2) ① 红棕色气体慢慢变浅 ② 8NH3+6NO27N2 +12H2O
③ Z中NaOH溶液产生倒吸现象 ④反应后气体分子数减少,Y管中压强小于外压
17.(13分)
(1)升高温度、搅拌、提高硫酸浓度等(1分);
MgCO3+2H+===Mg2++H2O+CO2↑(2分)
(2)将Fe2+氧化为Fe3+ ,便于除去 (2分)
(3)① K3[Fe(CN)6]溶液;② KSCN溶液 (每空1分)
(4)MgO、Mg(OH)2、MgCO3或Mg2(OH)2CO3(2分)5.0≦pH<8.5(2分)
(5)取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤干净 (2分)其他合理答案也可。
18.(每空2分,共14分)
(1) -90.1 B
(2) > 正反应为气体分子数减小的反应,加压平衡右移,CO的转化率增大,由图知相同温度时 P1下 CO 的转化率大于 P2
(3) ①AC ②9/p02 ③P0/30
三、选考题(共15分,请从2道题中任选一题作答,如果多做,则按所做第一题计分。)
19.(15分)
(1)
(2)① Be、C(2分,错答、漏答不得分)
② 直线形(1分) CO2 或CS2或N2O或BeCl2 (2分,任写两种,其他合理答案也给分)
(3)sp2(1分) sp3(l 分)
(4)B原子半径更小,B—N键键长更短,键能更大(2分)
(5)① Na3 Li(BH4)4(2分)
② (2分)
20.(15分)
(1)取代反应(1分) 酯基(1分)
(2)新制的Cu(OH)2悬浊液或新制的银氨溶液(2分)
(3) (2分)
(4)3(2分) (2分)
(5)c(2分)
(6)
(3分)








