
【化学】黑龙江省绥芬河市高级中学2018-2019学年高二上学期期中考试
展开黑龙江省绥芬河市高级中学2018-2019学年高二上学期期中考试
(分值:100分 考试时间:90分钟)
一、选择题(每小题2分,共计40分)
- 下列装置工作时,将化学能转化为电能的是( )
A | B | C | D |
燃气灶 | 硅太阳能电池 | 碱性锌锰电池 | 风力发电机 |
- 下列气体中,主要成分不是甲烷的是( )
A. 沼气 B. 天然气 C. 坑气 D. 水煤气
3. 下列有关金属腐蚀与防护的说法正确的是( )
A.金属的化学腐蚀比电化学腐蚀更普遍
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.海轮外壳焊接锌块是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
4. 以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性 B.溶解度与CuS、PbS、CdS相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
5. 在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是 ( )
A.CH 3 Cl B.CH 2 Cl 2 C.CHCl 3 D.HCl
6. 下列对沉淀溶解平衡的描述正确的是 ( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶的该沉淀物,将促进溶解
7. 已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是 ( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于×10-11 mol·L-1
8. 关于CH4和 的叙述正确的是( )
A. 均能用通式CnH2n+2来表示
B. 与所有烷烃互为同分异构体
C. 它们结构相似,物理、化学性质相同
D. 通常情况下后者能使酸性高锰酸钾溶液褪色
9.鉴别甲烷、一氧化碳和氢气3种无色气体的方法,是将它们( )
A.先后通入溴水和澄清石灰水
B.点燃,先后罩上干燥的冷烧杯和涂有澄清石灰水的烧杯
- 点燃后罩上涂有澄清石灰水的烧杯
D.点燃后罩上涂有澄清石灰水的烧杯,通入溴水
10. 下列反应中,不属于取代反应的是( )
A.
B.
C.CH4 + Cl2 → CH3CI + HCl(光照)
D.
11. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水,阳极的电极反应式为:2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电池正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
12. Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图所示,电解总反应为 2Cu+H2OCu2O+H2↑。 下列说法正确的是( )
A. 石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
13.下列有关说法不正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.把铜片和铁片紧靠在起浸入稀硫酸中,铜片表面出现气泡
C.把铜片插入三氯化铁溶液中,在铜片表面不会出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
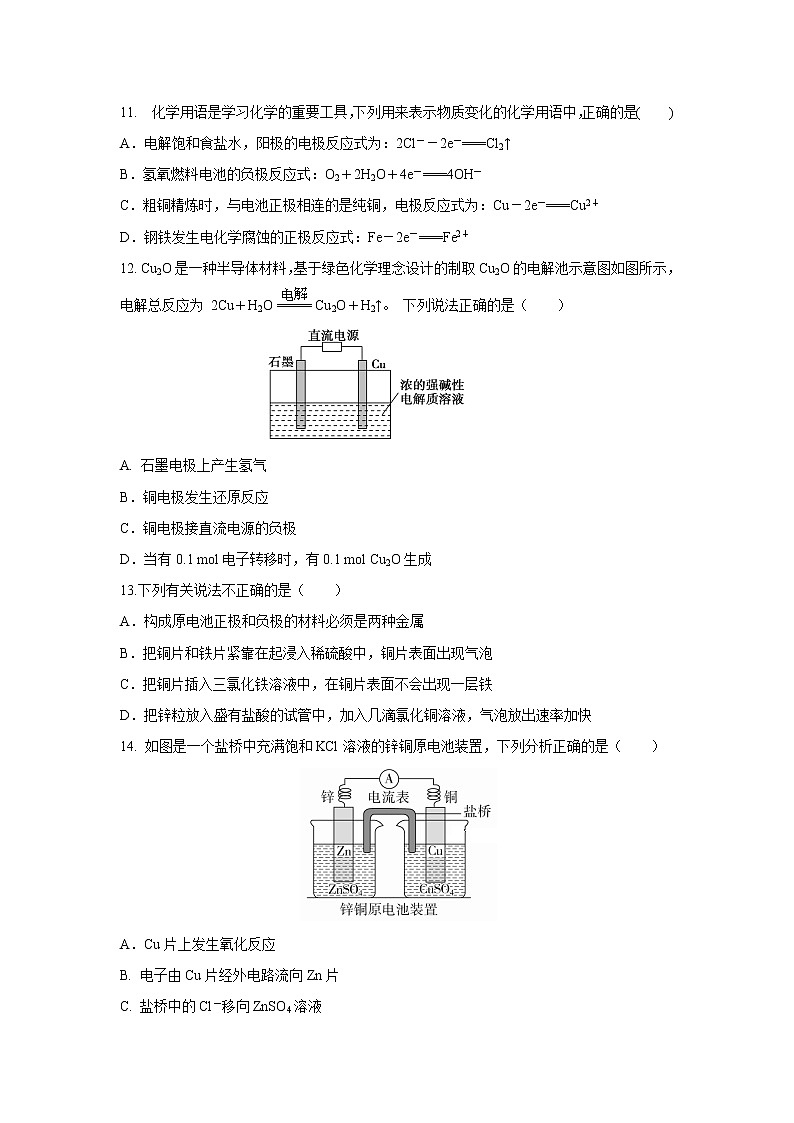
14. 如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )
A.Cu片上发生氧化反应
B. 电子由Cu片经外电路流向Zn片
C. 盐桥中的Cl-移向ZnSO4溶液
D. 一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小
15. 工业上,常用Fe2(SO4)3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4,含少量Fe2(SO4)3。某学习小组设计装置从废液中提取铜,如图所示。已知:Fe2+失电子能力比OH- 强。下列说法正确的是( )
A.电解初期阴极没有铜析出,原因是2H++2e-=H2↑
B.石墨极的电极反应式为2H2O+4e-=4H++O2↑
C.若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移
D.若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)
- 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e- + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
- 钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法不正确的是( )
A.此过程中可能涉及反应:4Fe(OH)2+O2+2H2O===4Fe(OH)3
B.钢铁被腐蚀的负极反应式为:Fe-3e-===Fe3+
C.钢铁设备上连接锌块可以防止腐蚀
D.钢铁与外加直流电源的负极相连可以防止腐蚀
18. 下列各装置中都盛有0.1 mol·L-1的NaCl溶液,放置一定时间后,纯锌片的腐蚀速率由快到慢的顺序是( )
A.②①④③ B.①②④③
C.①②③④ D.③①④②
19. 一种碱性“二甲醚(CH3OCH3)燃料电池”具有启动快、能量密度高、效率高等优点,其电池总反应为: CH3OCH3 + 3O2 + 4OH- === 2CO32 - + 5H2O,下列说法不正确的是( )
A. 电池正极可用多孔碳材料制成
B. 电池负极发生的反应为: CH3OCH3 - 12e- + 3H2O = 2CO32- + 12H+
C. 理论上,1mol二甲醚放电量是1mol甲醇放电量的2倍
D. 电池工作时,OH- 向电池负极迁移
20. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )
提示:BaSO4(s)Ba2+(aq)+SO(aq)的平衡常数Ksp=c(Ba2+)·c(SO),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
二、非选择题(共计60分)
21. (10分)化石燃料之一的天然气,其主要成分是甲烷.请回答下列问题.
(1)甲烷的电子式是: .
(2)甲烷与氯气在光照下反应的产物有 种,该反应的类型是 ________.
(3)甲烷的空间构型是 ,可证明其构型的实验事实是:
22.(4分)已知在Ca3(PO4)2的饱和溶液中存在平衡:Ca3(PO4)2(s)3Ca2+(aq)+2PO43﹣(aq)
(1)溶度积Ksp= ;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10﹣6 mol•L﹣1,c(PO43﹣)=1.58×10﹣6 mol•L﹣1,Ksp= .
23.(24分) 如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。
(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是________。
(2)A池中Zn是_____极,电极反应式为 ;Cu是 极,电极反应式为_________,A中总反应的化学方程式为________________________。
(3)B池中总反应的化学方程式为________________。
(4)C池中Zn是 极,电极反应式为 ;
Cu是 极,电极反应式为 。
24. (14分) 某研究小组对铁生锈进行研究。
(1)甲同学设计了A、B、C三组实验(如上图),探究铁生锈的条件。经过较长时间后,甲同学观察到的现象是:A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈。
①通过上述实验现象分析,可得出铁生锈的外部条件是____________________________;
②铁钉发生电化学腐蚀的正极电极反应式为 ;
③实验B所用的水要经过________处理;植物油的作用是__________________________;
④实验C中碱石灰的作用是___________________________。
(2)乙同学为了达到同样目的,设计了实验D(如图),发现一段时间后,试管中的液面升高,其原因是____________________,该实验________(填“能”或“不能”)说明水对铁钉生锈产生影响。
25.(8分) 某课外活动小组利用如图所示装置探究甲烷与氯气的反应。根据题意,回答下列问题:
(1)CH4与Cl2发生反应的条件是__________;若用日光直射,可能会引起________________________。
(2)实验中可观察的实验现象有:量筒内壁出现油状液滴,饱和食盐水中有少量固体析出,________________,__________________等。
(3)实验中生成的油状液滴中的氯仿可作局部麻醉剂,常因保存不慎而被空气氧化,产生剧毒气体——光气,反应的化学方程式为2CHCl3+O2―→2COCl2+2HCl,上述反应__________(填选项符号,下同)。
①属于取代反应 ②不属于取代反应
参考答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C | D | C | C | D | B | A | A | B | B |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
A | A | A | C | D | A | B | A | B | C |
21.(每空2分,共10分)
(1)略 (2)5种 取代反应
(3) 正四面体 二氯甲烷只有一种结构
22. (每空2分,共4分) (1)略 (2)2.0×10-29
23. (每空2分,共24分)
(1)A BC
(2)负 Zn - 2e- == Zn2+; 正 Cu2+ + 2e- == Cu
Zn + CuCl2 == ZnCl2 + Cu
(3)CuCl2 ===Cu + Cl2↑(条件电解)
(4)阴 Cu2+ + 2e- == Cu; 阳 Cu - 2e- == Cu2+
- (每空2分,共14分)
(1) ①有水(或电解质溶液)和氧气(或空气)
② O2+2H2O+4e-===4OH-
③ 煮沸 隔绝空气(或防止氧气与铁接触)
④ 吸收水蒸气(或干燥或保持试管内干燥环境)
(2)铁的腐蚀要吸收氧气(或氧气参与反应或消耗了氧气)使气体体积减小 不能
- (共8分)(1)光照(1分) 爆炸(1分)
(2)量筒内黄绿色气体变浅;(2分) 量筒内液面上升 (2分)
(3)②(2分)








