

【化学】内蒙古大板三中2018-2019学年高二上学期第一次(10月)月考 试卷
展开内蒙古大板三中2018-2019学年高二上学期第一次(10月)月考
(考试时间90分钟 满分100分)
可能用到相对原子质量H:1 C:12 O:16
1、25℃、101 kPa时,中和热为ΔH=-57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是( )
A.2H+(aq)+ SO42-(aq)+Ba2+(aq)+2OH-==BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
B.2KOH(aq)+H2SO4(aq) ==K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
C.C8H18(l)+25/2O2(g) ==8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(l)+25O2(g) ==16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
2、 下图是镁和卤素反应的能量变化图(反应物和产物均为298 K时的稳定状态)。下列选项中不正确的是
A. Mg与F2反应的ΔS<0
B. MgF2(s)+Br2(l)=MgBr2(s)+F2(g) ΔH=+600 kJ·mol-1
C. MgBr2与Cl2反应的ΔH<0
D. 化合物的热稳定性顺序:MgI2 >MgBr2>MgCl2>MgF2
3、下列关于化学反应中的能量变化的说法中错误的是( )
A.化学反应的发生一般是先吸热再放热,反应热的正负取决于它们的相对大小
B.吸热反应的发生不一定需要加热,而放热反应的发生也可能需要加热
C.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应生成2mol水时的反应热ΔH=2×(-57.3)kJ/mol
D.CO(g)的燃烧热是-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+566.0kJ/mol
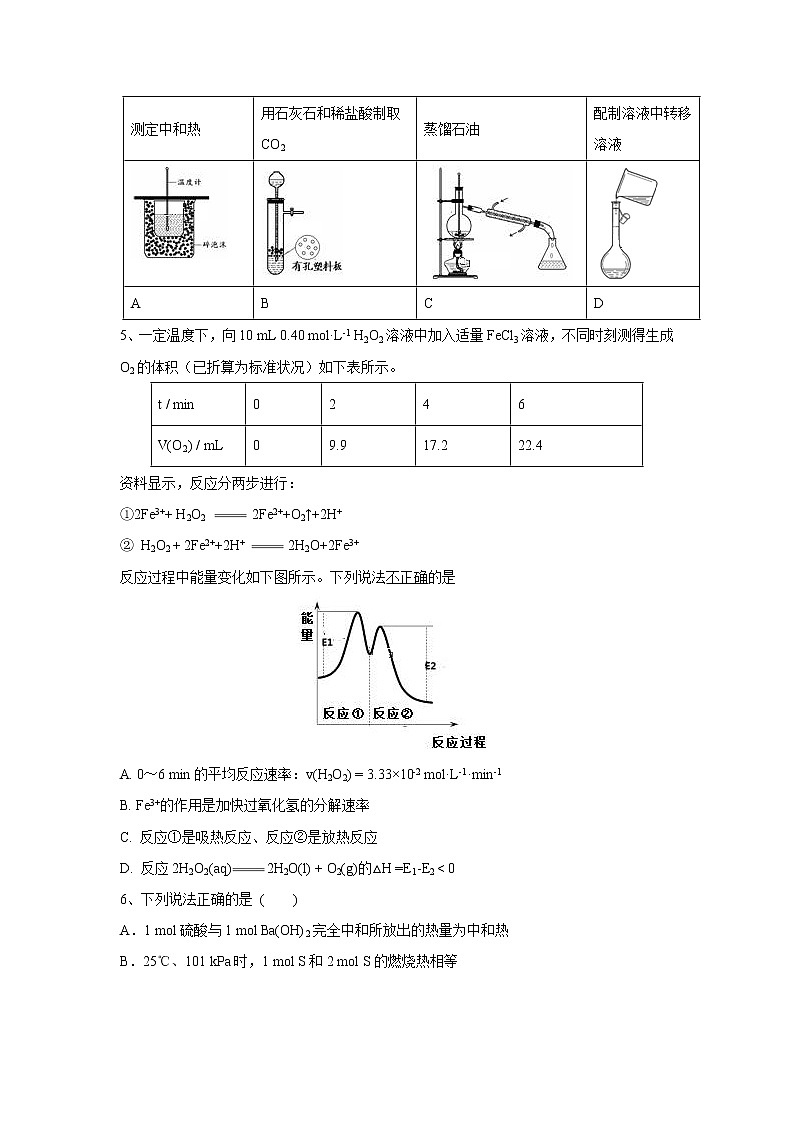
4、下图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的是( )
测定中和热 | 用石灰石和稀盐酸制取CO2 | 蒸馏石油 | 配制溶液中转移溶液 |
A | B | C | D |
5、一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ 2H2O+2Fe3+
反应过程中能量变化如下图所示。下列说法不正确的是
A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)2H2O(l) + O2(g)的△H =E1-E2 < 0
6、下列说法正确的是 ( )
A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
7、将2.0 g H2(g)在O2(g)中完全燃烧,生成H2O(g),放出热量Q kJ。则下列说法正确的是( )
A.若使用H2(l),则放出热量大于Q kJ B.若生成H2O(l),则放出热量大于Q kJ
C.若使用O2(s),则放出热量大于Q kJ D.电解18.0 g液态水,需要吸收Q kJ的热
8、下列变化过程,属于吸热过程的是( )
①金属钠与水 ②酸碱中和 ③浓H2SO4稀释 ④固体氢氧化钠溶于水 ⑤H2在Cl2中燃烧 ⑥液态水变成水蒸气 ⑦NH4Cl晶体与Ba(OH)2•8H2O混合搅拌 ⑧碳酸钙热分解.
A. ①②③④⑤ B. ①②⑤ C. ⑦⑧ D. ⑥⑦⑧
9、 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是 ( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
10、合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+H2O(g)CO2(g)+H2(g) ΔH <0。反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强 B. 增大CO的浓度 C. 降低温度 D. 更换催化剂
11、一定温度下某容积不变的密闭容器中,可逆反应C(s)+H2O(g)CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2 D. 1 mol H—H键断裂的同时断裂2 mol H-O键
12、在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)2C(g),反应达平衡,若混合气体中A和B的物质的量之和与C的物质的量相等,此时A的转化率为
A.60% B.50% C.40% D.70%
13、已知:4NH3(g)+5O2(g) == 4NO(g)+6H2O(g) △H=-1025kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
14、在一密闭容积的容器中进行反应:2SO2(g)+O2(g) 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol•L-1、0.1 mol•L-1、0.2 mol•L-1。当反应达平衡时,可能存在的数据是( )
A. SO2为0.4 mol•L-1,O2为0.2 mol•L-1 B. SO2为0.25 mol•L-1
C. SO2、SO3均为0.15 mol•L-1 D. SO3为0.4 mol•L-1
15、下图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
16、某化学反应其△H= —122 kJ·mol-1,∆S=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
17、下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.活化分子间所发生的碰撞为有效碰撞
D.升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数
18、根据相应的图像,判断下列相关说法正确的是( )
A.aX(g)+bY(g)cZ(g) B.I2(s)+aG(g)bR(g)
C.aA+bBcC D.A+2B2C+3D
A.t1时改变某一条件,如图所示,则改变的条件一定是加入催化剂
B.反应达到平衡时,外界条件对平衡的影响如图所示,则该反应为放热反应
C.从加反应物开始,物质的百分含量与温度的关系如图,则该反应为吸热反应
D.反应速率和反应条件的变化如图所示,则该反应为放热反应,若A、B、C是气体,则D为固体或液体
19、下列实验事实不能用平衡移动原理解释的是
20、下列说法正确的是( )
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 氨气是弱电解质,铜是强电解质
C.硫酸钡是强电解质,醋酸是弱电解质
D.相同温度下,浓度均为0.1 mol•L-1的NH4Cl溶液和氨水,NH4+的浓度一样大
二 填空题
21、(10分) 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
(1)反应的ΔH_______0(填“大于”或“小于”);若加入催化剂ΔH会 (填变大、变小、不变)100 ℃时,体系中各物质浓度随时间变化如图所示。反应的平衡常数K1为_____________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
22、(12分)2017年12月19日,中国绿色碳汇基金会印发《关于授予江口县“碳汇城市”称号的决定》。我市江口县成为全国第三个、我省首个“碳汇城市”。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳6CO2(g) +6H2O(l) === C6H12O6(s)+6O2(g) ,并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知每吸收1molCO2需要吸收能量约为470kJ.据此回答下列问题:
(1)碳汇过程中能量的转化形式由__________能转化为___________能;据相关资料表明,每1m3林木,大约能吸收能量为1.88×107kJ,大约可以吸收CO2______吨;葡萄糖燃烧的热化学方程式为:_____________ 。
(2)工业废气中的CO2可用碱液吸收。所发生的反应如下:
CO2(g)+2NaOH(aq)===Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1
CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-b kJ·mol-1
则:①反应CO2(g)+H2O(l)+Na2CO3(aq)===2NaHCO3(aq)的ΔH=______ kJ·mol-1(用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3和CO2一样是一种温室气体 ,在大气中的寿命可长达740年之久。以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
反应:N2(g)+3F2(g)=2NF3(g)ΔH=_________________
23、(8分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应。各物质的起始加入量如下:M为2.5mol,N为3mol,P为0,A、C、D各为0.5mol,B为xmol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应达到平衡,并且隔板恰好处于反应器的正中位置。
若达到平衡后测得M的转化率为75%,请填写下列空白:
(1)达到平衡后,反应器左侧气体总物质的量为__________mol。
(2)若欲使右侧反应开始时v正>v逆,x的取值范围为_________。
(3)若欲使右侧反应开始时v正<v逆,x的取值范围为_________。
24、(10分) 现有下列十种物质:①冰醋酸(CH3COOH) ②铝 ③CaCO3 ④干冰 ⑤H2SO4 ⑥Ba(OH)2 ⑦氢氧化铁胶体 ⑧液态氨气 ⑨稀硝酸 ⑩KAl(SO4)2
(1)以上物质属于非电解质的是__________,在熔融态不导电而水溶液中导电的电解质是__________(填序号)。
(2)写出⑩在水溶液中的电离方程式_____________________________________
(3)上述物质中两种物质之间发生反应可用离子方程式表示为:H++OH-H2O的有_________________(填序号)
参考答案
一选择题
1.B 2.D 3.C 4.B 5.D 6.B 7.B 8.D 9.B 10.C 11.C 12.C
13.C 14.B 15.C 16.A 17.D 18.D 19.C 20.C
二填空题
21(1). 大于 不变 0.36 (2). 大于 反应正方向吸热,反应向吸热方向进行,故温度升高
22(1). 太阳 (2). 化学 (3). 1.76 (4). C6H12O6(s)+6O2(g)= 6CO2(g) +6H2O(l)
ΔH=-2820kJ/mol (5). a-2b)kJ/mol (6). -291.9kJ•mol-1
23(1)2.5mol (2)1<x<2 (3)0.5<x<1
24 (1). ④⑧ ①⑤ (2). KAl(SO4)2==K++Al3++2SO42- (3)⑥⑨








