
2019版高考化学一轮优化探究练习:大题规范练(三) (含解析)
展开大题规范练(三)
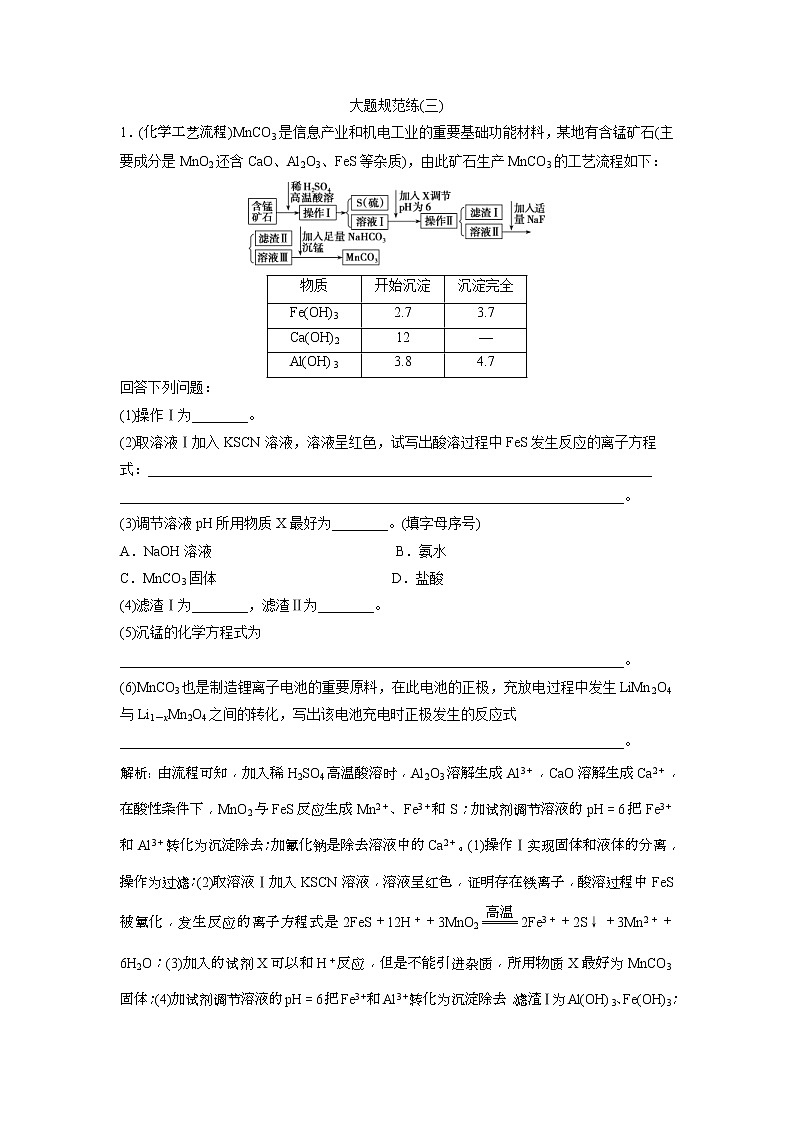
1.(化学工艺流程)MnCO3是信息产业和机电工业的重要基础功能材料,某地有含锰矿石(主要成分是MnO2还含CaO、Al2O3、FeS等杂质),由此矿石生产MnCO3的工艺流程如下:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Ca(OH)2 | 12 | — |
Al(OH)3 | 3.8 | 4.7 |
回答下列问题:
(1)操作Ⅰ为________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈红色,试写出酸溶过程中FeS发生反应的离子方程
式:________________________________________________________________________
________________________________________________________________________。
(3)调节溶液pH所用物质X最好为________。(填字母序号)
A.NaOH溶液 B.氨水
C.MnCO3固体 D.盐酸
(4)滤渣Ⅰ为________,滤渣Ⅱ为________。
(5)沉锰的化学方程式为
________________________________________________________________________。
(6)MnCO3也是制造锂离子电池的重要原料,在此电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,写出该电池充电时正极发生的反应式
________________________________________________________________________。
解析:由流程可知,加入稀H2SO4高温酸溶时,Al2O3溶解生成Al3+,CaO溶解生成Ca2+,在酸性条件下,MnO2与FeS反应生成Mn2+、Fe3+和S;加试剂调节溶液的pH=6把Fe3+和Al3+转化为沉淀除去;加氟化钠是除去溶液中的Ca2+。(1)操作Ⅰ实现固体和液体的分离,操作为过滤;(2)取溶液Ⅰ加入KSCN溶液,溶液呈红色,证明存在铁离子,酸溶过程中FeS被氧化,发生反应的离子方程式是2FeS+12H++3MnO22Fe3++2S↓+3Mn2++6H2O;(3)加入的试剂X可以和H+反应,但是不能引进杂质,所用物质X最好为MnCO3固体;(4)加试剂调节溶液的pH=6把Fe3+和Al3+转化为沉淀除去,滤渣Ⅰ为Al(OH)3、Fe(OH)3;加氟化钠是除去溶液中的钙离子,所以滤渣Ⅱ为CaF2;(5)加入碳酸氢钠可以将锰离子沉淀,沉锰的化学方程式为:MnSO4+2NaHCO3===MnCO3↓+Na2SO4+H2O+CO2↑;(6)因电池的正极,充放电过程中发生LiMn2O4与Li1-xMn2O4之间的转化,该电池充电时正极发生氧化反应,电极反应式为:LiMn2O4-xe-===Li1-xMn2O4+xLi+。
答案:(1)过滤
(2)2FeS+12H++3MnO22Fe3++2S↓+3Mn2++6H2O
(3)C (4)Al(OH)3、Fe(OH)3 CaF2
(5)MnSO4+2NaHCO3===MnCO3↓+Na2SO4+H2O+CO2↑
(6)LiMn2O4-xe-===Li1-xMn2O4+xLi+
2.(化学综合实验)(NH4)2Fe(SO4)2·6H2O(俗称“摩尔盐”)是分析化学中的重要试剂,在制药、电镀方面有广泛的应用。某学习小组欲探究其样品的纯度及其分解产物,查阅文献得知:“摩尔盐”隔绝空气加热至500 ℃时可完全分解,但产物复杂。
Ⅰ.探究(NH4)2Fe(SO4)2·6H2O样品的纯度
某学习小组想测定一瓶摩尔盐样品的纯度,其实验装置如图所示。请回答下列问题:
(1)装置A中需要检查是否漏液的仪器名称是______;装置B中的试剂是________;装
置C中球形干燥管的作用是
________________________________________________________________________。
(2)实验结束后再通入一会儿N2的目的是
________________________________________________________________________。
(3)该学习小组同学称取了10.0 g摩尔盐样品,若实验结束后测得洗气瓶及瓶内溶液共增重0.85 g,则依此数据推算这份摩尔盐样品的纯度为________%(精确到小数点后1位)。
Ⅱ.探究(NH4)2Fe(SO4)2·6H2O的分解产物
为检验(NH4)2Fe(SO4)2·6H2O的分解产物,该学习小组设计了如下实验装置。请回答下列问题:
(4)甲同学观察到装置D中样品固体逐渐变为红棕色,装置E、F中均产生白色沉淀。装置F中发生反应的离子方程式为
________________________________________________________________________。
(5)乙同学设计实验验证装置D中的残留物不含FeO,操作方法及实验现象是取少量装置D中残留物放入试管中,
________________________________________________________________________。
(6)乙同学认为:装置E中产生白色沉淀不能证明分解产物中一定含有SO3,用化学方程式解释其原因为NH3+HCl===NH4Cl、
________________________________________________________________________。
解析:(1)该实验是通过测定生成氨气的质量测定摩尔盐的纯度,故应先除去氨气中的水蒸气,再用酸溶液吸收;因为氨气极易溶解于水会产生倒吸,故用球形干燥管防止倒吸。(2)通入氮气可以使生成的气体被完全吸收。(3)n[(NH4)2Fe(SO4)2·6H2O]=n(NH3)=×0.85 g÷17 g·mol-1=0.025 mol,m[(NH4)2Fe(SO4)2·6H2O]=0.025 mol×392 g·mol-1=9.80 g,纯度为9.80÷10.0×100%=98.0%。(4)装置F中有白色沉淀生成,是因为生成的SO2被双氧水氧化成SO,SO再与Ba2+结合生成白色沉淀BaSO4,则装置F中发生的反应为:SO2+H2O2+Ba2+===BaSO4↓+2H+。(5)要验证装置D中残留物不含FeO,先取少量装置D中的残留物放入试管中,再加入稀硫酸溶解,然后滴加KMnO4溶液检验,若溶液不褪色,说明残留物中没有FeO。(6)氨气过量时,产生的氨气消耗完装置B中的HCl后二氧化硫与氨气反应生成亚硫酸铵,亚硫酸铵与BaCl2溶液反应生成BaSO3沉淀,所以不能说明分解产物中一定含有SO3。
答案:(1)分液漏斗 碱石灰 防止倒吸
(2)将产生的气体全部吸收
(3)98.0
(4)SO2+H2O2+Ba2+===BaSO4↓+2H+
(5)加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色
(6)SO2+2NH3+BaCl2+H2O===BaSO3↓+2NH4Cl








