
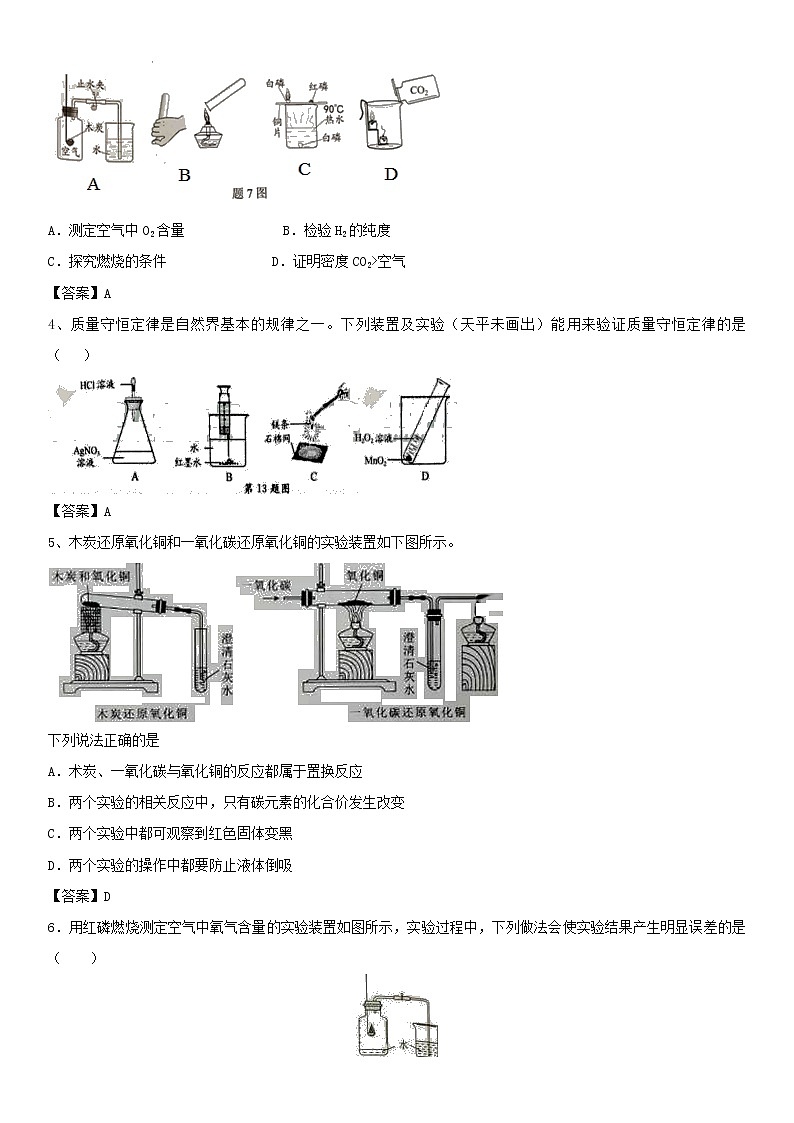
2018年中考化学重要知识点《科学探究》练习卷(含答案)
展开科学探究练习卷
1.小东通过查阅资料,根据铁在空气中生锈的原理,设计了如右图所示的实验装置,来测定空气中氧气含量(装置中的饱和食盐水、活性炭会加速铁生锈)。已知广口瓶的有效容积为242mL,实验8分钟后打开止水夹,水从烧杯流人广口瓶中的体积为48mL。下列说法错误的是
A.该实验的不足之处在于实验前广口瓶底未放少量水
B.通过分析本次实验数据,可知空气中暇气的体积分数约为19.8%
C.若实验药品充足,时间足够长,可十分接近拉瓦锡实验的结果
D.此实验可有效解决拉瓦锡实验中的汞污染问题
【答案】A
2、如图是用燃磷法测定“空气中氧气含量”的实验,下列说法正确的是
A.装置中的红磷可以用铁丝来代替 待红磷熄灭并冷却后,打开弹簧夹,再观察现象
C.红磷在空气中燃烧产生大量的白雾 实验测定氧气的质量约占空气总质量的1/5
【答案】B
3 “题7图”的实验设计不能实现其对应实验目的的是
A.测定空气中O2含量 B.检验H2的纯度
C.探究燃烧的条件 D.证明密度CO2>空气
【答案】A
4、质量守恒定律是自然界基本的规律之一。下列装置及实验(天平未画出)能用来验证质量守恒定律的是( )
【答案】A
5、木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如下图所示。
下列说法正确的是
A.术炭、一氧化碳与氧化铜的反应都属于置换反应
B.两个实验的相关反应中,只有碳元素的化合价发生改变
C.两个实验中都可观察到红色固体变黑
D.两个实验的操作中都要防止液体倒吸
【答案】D
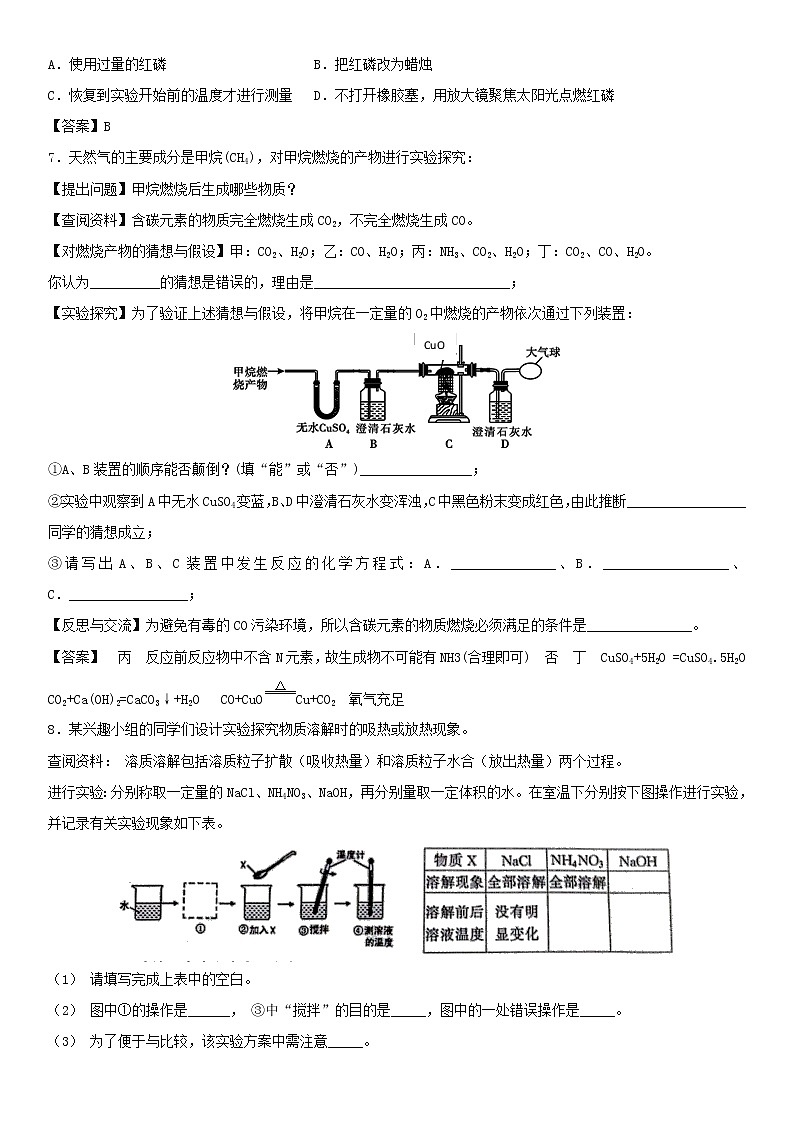
6.用红磷燃烧测定空气中氧气含量的实验装置如图所示,实验过程中,下列做法会使实验结果产生明显误差的是( )
A.使用过量的红磷 B.把红磷改为蜡烛
C.恢复到实验开始前的温度才进行测量 D.不打开橡胶塞,用放大镜聚焦太阳光点燃红磷
【答案】B
7.天然气的主要成分是甲烷(CH4),对甲烷燃烧的产物进行实验探究:
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO。
【对燃烧产物的猜想与假设】甲:CO2、H2O;乙:CO、H2O;丙:NH3、CO2、H2O;丁:CO2、CO、H2O。
你认为__________的猜想是错误的,理由是____________________________;
【实验探究】为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置:
①A、B装置的顺序能否颠倒?(填“能”或“否”)________________;
②实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中黑色粉末变成红色,由此推断_________________同学的猜想成立;
③请写出A、B、C装置中发生反应的化学方程式:A._______________、B.__________________、C._________________;
【反思与交流】为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是_______________。
【答案】 丙 反应前反应物中不含N元素,故生成物不可能有NH3(合理即可) 否 丁 CuSO4+5H2O =CuSO4.5H2O CO2+Ca(OH)2=CaCO3↓+H2O CO+CuOCu+CO2 氧气充足
8.某兴趣小组的同学们设计实验探究物质溶解时的吸热或放热现象。
查阅资料: 溶质溶解包括溶质粒子扩散(吸收热量)和溶质粒子水合(放出热量)两个过程。
进行实验:分别称取一定量的NaCl、NH4NO3、NaOH,再分别量取一定体积的水。在室温下分别按下图操作进行实验,并记录有关实验现象如下表。
(1) 请填写完成上表中的空白。
(2) 图中①的操作是______, ③中“搅拌”的目的是_____,图中的一处错误操作是_____。
(3) 为了便于与比较,该实验方案中需注意_____。
反思与评价:
(4) 同学们对溶质溶解时两个过程热量变化的相对大小展开了讨论。请选择上述一种溶质的溶解进行分析_____。
【答案】 (1)温度显著降低 (2)全部溶解 (3)温度明显升高 (4)测量水的温度 (5)加速溶解 (6)用温度计搅拌 (7)实验中所用水的质量要相等 (8)NaOH在溶解时,扩散过程吸收的热量小于水合过程放出的热量
9、运用所学知识解决实际生活中遇到的问题是我们学习化学的主要目的之一。熟练地掌握物质的性质更有助于我们区分和辨别一些物质。
(1)中国的铁锅源远流长,受到联合国卫生组织的推崇,原因之一是由于铁锅能为人体补充铁元素。若人体缺乏铁元素,容易引起__________症;
(2)食品包装盒里常有一小袋粉末状物质,该物质对食品同时具有防潮和防氧化作用。小明从食品包装里取出装有粉末状物质的小袋,撕开后发现袋里有板结的铁锈。你猜测这种粉末状物质是_________,其作用原理是_____________________________________。
(3)碳酸钙在高温下煅烧一段时间后,得到白色固体。两研究性学习小组的同学为了确定色固体的成分,对其可能的组成进行了探究。
Ⅰ组.【组成问题】 白色固体的成分是什么?
【作出猜想】 白色固体的成分可能是CaCO3和CaO的混合物。
【实验验证】 (请你写出实验的步骤和现象)_________________。
【实验结论】 白色固体的成分是CaCO3和CaO的混合物。
Ⅱ组.【作出猜想】 白色固体可能全部是CaO。
【试验方案】 取试样于试管中,加入水,再通入CO2,变浑浊。
Ⅱ组的方案正确吗? __________,理由是________________。
【答案】 贫血 铁粉 铁生锈时需要吸收空气中的氧气和水 取适量样品于试管中加入稀盐酸,有气泡产生 不正确 试样加水后,由于有碳酸钙与微溶的Ca(OH)2,本来就显浑浊
10.过氧化氢在生产生活中有广泛应用。实验小组对过氧化氢的某些性质进行研究。
I.不稳定性
(1)如下图所示进行实验,过氧化氢分解的化学方程式为_______________,产生3.2g O2时分解的过氧化氢的质量为______ g。
(2)能用排水法收集O2的原因是______。
(3)探究温度对过氧化氢分解速率的影响
同学们进行了如下的实验,实验数据如下表:
实验序号 | ① | ② | ③ |
H2O2溶液的浓度% | 30 | 30 | 30 |
H2O2溶液的体积/mL | 6 | 6 | 6 |
温度/℃ | 20 | 35 | 55 |
MnO2的用量/g | 0 | 0 | 0 |
收集O2的体积/mL | 0 | 1.9 | 7.8 |
反应时间 | 40min | 40min | 40 min |
由此得出的结论是_____________________________。
Ⅱ.腐蚀性
【查阅资料】H2O2溶液有腐蚀性。
【进行实验】
将铜片分别浸泡在3种溶液中进行实验,如下表。
编号 | ① | ② | ③ |
实验 | |||
一段时间后的现象 | 无明显变化 | 溶液变蓝,缓慢产生细小气泡 | 无明显变化 |
【解释与结论】
(4)实验①的作用是_____________________。
(5)铜片被腐蚀的反应如下,补全该反应的化学方程式。
Cu + H2O2+ H2SO4=== CuSO4 +_______。
【反思交流】
(6)某同学提出,实验②中,除发生(5)的反应外,还发生了一个反应导致有细小气泡产生,该反应的反应物为_______。
【答案】 2H2O22H2O+O2↑ 6.8g 氧气不易溶于水 其他条件相同,温度越高,过氧化氢分解速率越快 验证只有双氧水溶液,不能腐蚀铜片 2H2O H2O2或H2O2和CuSO4
11.某废液M可能含有硫酸钠、氯化钠、碳酸钠、氢氧化钠中的一种或几种,为确定其成分进行实验。
①反应生成气体的化学方程式是_______________。
②M中一定没有____________。
③为进一步确定M的成分,进行实验,步骤如下:
Ⅰ 重新取M样品,滴加过量的试剂X,静置; Ⅱ 取Ⅰ中的上层清液,滴加酚酞;
Ⅲ 向Ⅱ中的溶液滴加过量的稀硝酸; Ⅳ 向Ⅲ中的溶液滴加试剂Y。
完成填空:
试剂X是________(选填“氯化钡”或“硝酸钡”)溶液;试剂Y是________溶液。能确定M中含有氢氧化钠的最主要的一个现象是________;能确定M中含有氯化钠的最主要的一个现象是__________。(需写明现象对应的步骤编号)
【答案】①Na2CO3+2HCl→2NaCl+H2O+CO2↑ ②硫酸钠 ③ 硝酸钡 硝酸银; 步骤II:滴加酚酞,溶液变红; 步骤IV:滴加硝酸银溶液,有白色沉淀生成








