
江西省赣州市会昌县七校2021届高三联合月考 化学(含答案) 试卷
展开化学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Na 23 Fe 56
一、选择题(每题只有一个正确选项,每题3分,共48分)
1.化学与生活密切相关。下列说法错误的是
A. 华为首款5G手机搭载了麒麟980芯片,此芯片主要成分是二氧化硅
B.医用外科口罩的核心功能层聚丙烯熔喷布属于有机高分子材料
C.将84消毒液和医用酒精混合使用,会降低杀死新冠病毒效果
D.疫苗必须冷藏存放,其目的是避免疫苗蛋白质变性
2.设为阿伏加德罗常数的数值,下列说法正确的是( )
A.23 g Na与足量反应完全后可生成个分子
B.足量和80ml 10mol/L浓盐酸共热可生成0.2个分子
C.3 mol单质Fe完全转变为,失去8 个电子
D.标准状况下,22.4 L 和混合气中含个原子
3.作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是
A.鲁米诺的化学式为C8H6N3O2
B.一定条件,A可以和甘油发生聚合反应
C.B中处于同一平面的原子最多12个
D.(1)、(2)两步的反应类型分别为加成反应和取代反应
4. 下列化学反应对应的离子方程式表示正确的是( )
A.溶液与Cu的反应:
B.溶于过量的NaOH溶液中:
C.少量和反应:
D.溶液与等物质的量的反应:
5.氮化硅(Si3N4 )可用作高级耐火材料、新型陶瓷材料、LED基质材料等。已知:Si对电子对的吸引力比H的小,利用硅烷( SiH4)制备氮化硅的反应为
3SiH4 +4NH3=Si3N4+ 12H2。下列有关说法正确的是
A.硅烷中Si的化合价为-4价 B.NH3在该反应中作还原剂
C. H2既是氧化产物,也是还原产物 D.转移1.2 mol电子时,生成26.88 L H2
6.下列提供的仪器和试剂,能达到实验目的的是
7. 化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是( )
A.图①可以表示某化学平衡体系改变温度后,反应速率随时间的变化
B.图②中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) △H<0未使用和使用催化剂时,反应过程中的能量变化
C.图③表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,且甲的压强大
D.图④中曲线表示反应2SO2(g)+O2(g) 2SO3(g) △H<0逆反应的平衡常数K随温度的变化
8. 最近,科学家成功研制出一种电源,该电源在消耗二氧化碳的同时,还可释放电能。电源电极为铝电极和多孔碳电极,电解质溶液为草酸盐溶液,放电过程中草酸盐浓度基本不变,电源示意图如图所示。下列有关该电源的说法正确的是( )
A. 用该电源电解饱和食盐水,理论上每消耗2 mol二氧化碳可收集到标准状况下22.4 L 氢气
B. 铝电极为正极
C.若生成0.5 mol 草酸铝,有3 mol电子通过电解质溶液
D.正极的电极反应式为
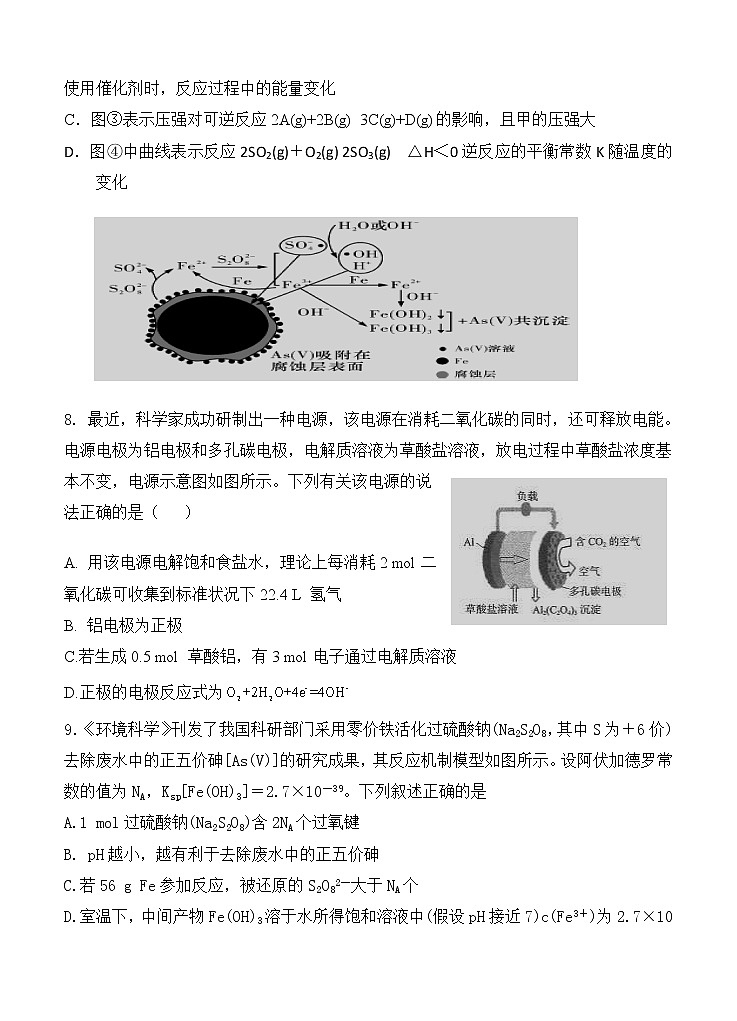
9.《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B. pH越小,越有利于去除废水中的正五价砷
C.若56 g Fe参加反应,被还原的S2O82-大于NA个
D.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中(假设pH接近7)c(Fe3+)为2.7×10-32 mol·L-1
10.下列有关说法正确的是
A.已知电离平衡常数(25℃),Ka(HClO)=2.95×10-8;H2CO3 Ka1=4.3×10-7、
Ka2=5.6×10-11,将少量的CO2通入NaClO溶液中反应离子方程式为
2ClO-+CO2+H2O=2HClO+CO32-。
B.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
C.已知常温下A-的水解常数Kh=1.61×10-5。含等物质的量浓度HA、NaA的混合液中则有:c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+)
D.在25℃,Ksp(AgCl)约为1×10-10,Ksp(Ag2CrO4)约为4×10-12,向均为0.1 mol/L的NaCl和Na2CrO4混合液中滴加0.1 mol/L AgNO3溶液,CrO42-先沉淀
11.已知反应S2O82-(aq)+2I-(aq)2SO42-(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如下图所示。下列有关该反应的说法不正确的是
①2Fe3+(aq)+2I-(ag)I2(aq)+2Fe2+(aq)
②2Fe2+(aq)+S2O82-(aq)2Fe3+(aq)+2SO42-(aq)
A.Fe3+是该反应的催化剂,加入Fe3+后降低了该反应的活化能
B.反应①比反应②所需活化能大
C.向该溶液中滴加淀粉溶液,溶液变蓝,适当升温,蓝色加深
D.该反应可设计成原电池
12.X、Y、Z为三种原子序数依次递增的短周期主族元素,分别为这三元素形成的单质A~F均为化合物,有关反应及转化关系如下图所示,其中F为不含金属元素的含氧酸盐。已知是阿伏加德罗常数的值,下列说法错误的是( )
A.X为第一周期第ⅠA族元素,Y与Z为同周期元素
B.B、C、D均属于氧化物,E和F中存在的化学键类型不完全相同
C.和反应时生成A分子的数目为0.2
D. 与、C反应完全转化为E时,转移电子的数目为
13. 压缩天然气汽车以天然气代替汽车用油,具有价格低、污染少、安全等优点。未经处理的天然气含有H2S,直接使用会造成大气污染,T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法错误的是( )
A. Fe2(SO4)3可以视为该脱硫过程中的催化剂
B. 该脱硫过程的总反应为:2H2S+O2=2S+2H2O
C. 该脱硫过程不能在高温下进行
D. 该脱硫过程是将H2S转化为FeSO4
14. 一定温度下,在3个容积均为1.0 L的恒容密闭容器中发生反应:
PCl5 (g) PCl3(g)+Cl2(g)。下列说法错误的是( )
容器编号 | 物质的起始浓度/(mol·L-1) | 物质的平衡浓度/(mol·L-1) | ||
Ⅰ | 0.4 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0 | 0.2 |
|
Ⅲ | 0.8 | 0 | 0 |
|
A.反应达到平衡时,容器I中比容器Ⅱ中的小
B.反应达到平衡时,容器I与容器Ⅱ中的总压强之比为3︰4
C.反应达到平衡时,容器Ⅲ中的体积分数小于
D.反应达到平衡时,容器Ⅲ中0.4mol/L<C(PCl5)<0.8 mol/L
15. 常温下,现有0.1 mol·L-1 NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
A.当pH=9时,溶液中存在下列关系:c(NH4+)>c(NH3·H2O)>c(HCO3-)>c(CO32-)
B.将0.2 mol CO2通入1 L 0.3 mol·L-1 NH3·H2O溶液中充分反应,
则有:c(HCO3-)+3c(H2CO3)-c(CO32-)>0
C.向pH=6.5的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3-浓度逐渐减小
D.分析可知,常温下水解平衡常数Kh(HCO3-)的数量级为10-7
16. X、Y、M、L四种原子序数依次增大的短周期元素的原子构成的一种特殊的离子化合物的结构如图所示,其中Y元素的最高价氧化物对应的水化物和其最低价氢化物相遇有白烟生成,M元素的硫酸盐能用作工业污水净水剂,且M元素和L元素同周期。下列有关说法不正确的是( )
A.简单离子半径:M<Y
B.最高价氧化物对应的水化物的酸性:L>Y
C. L元素原子的最外层电子数等于Y元素的核电荷数
D.含的盐溶液和NaOH溶液混合一定会产生大量有刺激性气味的气体
二、填空题(共52分)
17.(14分)ClO2气体的氧化性与Cl2的氧化性相近,是安全、无毒的绿色消毒剂和保鲜剂。某兴趣小组对其制备、吸收、释放和应用进行了研究,如图1。
(1)安装F中导管时,应选用图2中的 (填字母)。
(2)A装置用于制备ClO2,在制备过程中会生成Cl2,则发生反应的化学方程式为: 。C装置用于吸收Cl2,ClO2在D中会被稳定剂完全吸收生成NaClO2,整个过程中,F溶液的颜色不变。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。在ClO2释放实验中,打开装置 (填字母)的活塞,使反应发生,则装置F的作用是 。
(4)已吸收ClO2气体的稳定剂I和稳定剂II,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 。
(5)ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的 倍。
18. (14分) 铜的多种化合物在生产生活中都有广泛用途。请回答下列问题:
(1)Cu2O和CuO是铜的两种氧化物,可互相转化。已知:
i.2Cu2O(s)+O2(g)=4CuO(s) △H=-292.0 kJ·mol-1
ii.C(s)+2CuO(s)=Cu2O(s)+CO(g) △H=+35.5 kJ·mol-1
若CO的燃烧热为283.0 kJ·mol-1,则C(s)的燃烧热为 。
(2)Cu2O和CuO常用作催化剂。
①质子交换膜燃料电池(PEMFC)的燃料气中除含有H2外还含有少量的CO和CO2,其中CO是PEMFC催化剂的严重毒化剂,可用CuO/CeO2作催化剂优先氧化脱除CO。160℃、用CuO/CeO2作催化剂时,氧化CO的化学方程式为 ;分别用HIO3和H3PO4对CuO/CeO2进行处理,在一定条件下,利用不同催化剂进行CO氧化的对比实验,得如图曲线,其中催化剂 (填“b”或“c”)催化性能最好。
②在Cu2O催化作用下合成CH3OH,反应如下:
CO(g)+2H2(g)CH3OH(g) △H=-90.0 kJ·mol-1,有利于提高该反应CO的平衡转化率的条件是 (填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
T℃时,将CO和H2按一定比例混合后投入容积为2L的恒容密闭容器中,CO的起始浓度为1.0 mol·L-1,平衡时,测得体系中,n(H2)=1.4 mol,n(CH3OH)=1.7 mol,反应达到平衡时CO的转化率为 ,若反应达到平衡状态后,保持其他条件不变,再充入0.2 mol CO和0.2 mol CH3OH,平衡向 (填“正”或“逆”)反应方向移动。
(3)CuS呈黑色,是最难溶的物质之一,由于它的难溶性使得一些看似不可能的反应可以发生。向0.01 mol·L-1 CuSO4溶液中,持续通入H2S维持饱和(H2S饱和浓度为0.1 mol·L-1),发生反应:H2S(aq)+Cu2+(aq)CuS(s)+2H+(aq),该反应的化学平衡常数K为 (保留2位有效数字)。已知:Ka1(H2S)=1.1×10-7,Ka2(H2S)=1.3×10-13,Ksp(CuS)=6.3×10-36。
19. (12分)钛白的化学名称是二氧化钛,是一种重要的白色颜料。工业上常以钛铁矿(主要成分为钛酸亚铁,含有少量、、FeO、CaO和等杂质)为原料,采用硫酸法生产钛白,简易流程如下:
回答下列问题:
(1)“碱浸”操作的目的是_______________。
(2)“酸浸”后钛元素主要以的形式存在,且没有元素化合价发生变化,写出“酸浸”操作中发生的主要反应的化学方程式___________________。 “酸浸”时,Ti的浸出率与温度的关系如图所示,温度高于40 ℃ 时,Ti的浸出率降低的主要原因是___________________。
(3)已知“还原”过程中加入的铁屑适量,则“滤渣”的主要成分为_______________,副产品的化学式是_________________________。
(4)“加热水解”过程中发生反应的离子方程式为_______________________。
20. (12分) 环丙胺()是合成新型抗菌素、除草剂等产品的中间体。以γ-丁内酯()为原料合成环丙胺的传统“五步合成法”工艺如下。
回答下列问题:
(1)γ-丁内酯的分子式为_______,本工艺中两次用到的的名称为_______。
(2)B中官能团的名称为_______。
(3)B→C反应过程中还生成了醇和无机盐,该反应的化学方程式为________________。
(4)与A分子式相同,且分子中含有酯基的同分异构体有______种。
(5)环氧丁烯()来源丰富且经济,利用环氧丁烯合成环丙胺是目前一些国家正在研发的项目,其前两步反应过程如下。
下列关于环氧丁烯和2,3-二氢呋喃的说法不正确的是______。(填标号)
a.二者分子式相同互为同分异构体
b.二者均能发生取代、氧化、加成反应
c.可以用酸性溶液鉴别二者
(6)环丙甲醛再经过四步反应即可得到环丙胺,写出合成路线___________________。
答案
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
A | C | B | D | C | B | D | A |
9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
C | C | C | C | D | B | B | D |
18.(共14分,每空2分)
(1)393.5 kJ/ mol
(2)①2CO+O2 2CO2 b
② B 85﹪ 正
(3)2.3×1015
19. (共12分,每空2分)
(1)除去钛铁矿中的杂质、
(2);温度过高,的水解程度增大
(3); FeSO4.7H2O
(4)TiO2++2H2O==Ti0(OH)2↓+2H+
20. (共12分,第(1)每空1分,其它每空2分)
(1); 甲醇钠
(2)酯基、氯原子
(3)
(4)13
(5)c
(6).








