
还剩30页未读,
继续阅读
所属成套资源:2020高考化学通用版新创新一轮复习3-12章学案()
成套系列资料,整套一键下载
2020版高考新创新一轮复习化学通用版学案:第四章第四节氮及其化合物
展开
第四节
氮及其化合物
1.了解氮元素单质及其重要化合物的制备方法,掌握其主要性质及其应用。
2.了解氮元素单质及其重要化合物对环境的影响。
3.掌握氨气的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
4.了解化学与生活、材料、能源、环境、生命、信息技术等的关系。
5.了解“绿色化学”的重要性。
考点(一) 氮及其氧化物 【点多面广精细研】
1.氮气的结构与性质
(1)氮元素的存在与氮的固定
(2)N2的物理性质
无色、无味气体,密度比空气略小,难溶于水。
(3)N2的化学性质
①与氧气反应:N2+O22NO。
②与氢气反应:N2+3H22NH3。
③与镁反应:3Mg+N2Mg3N2。
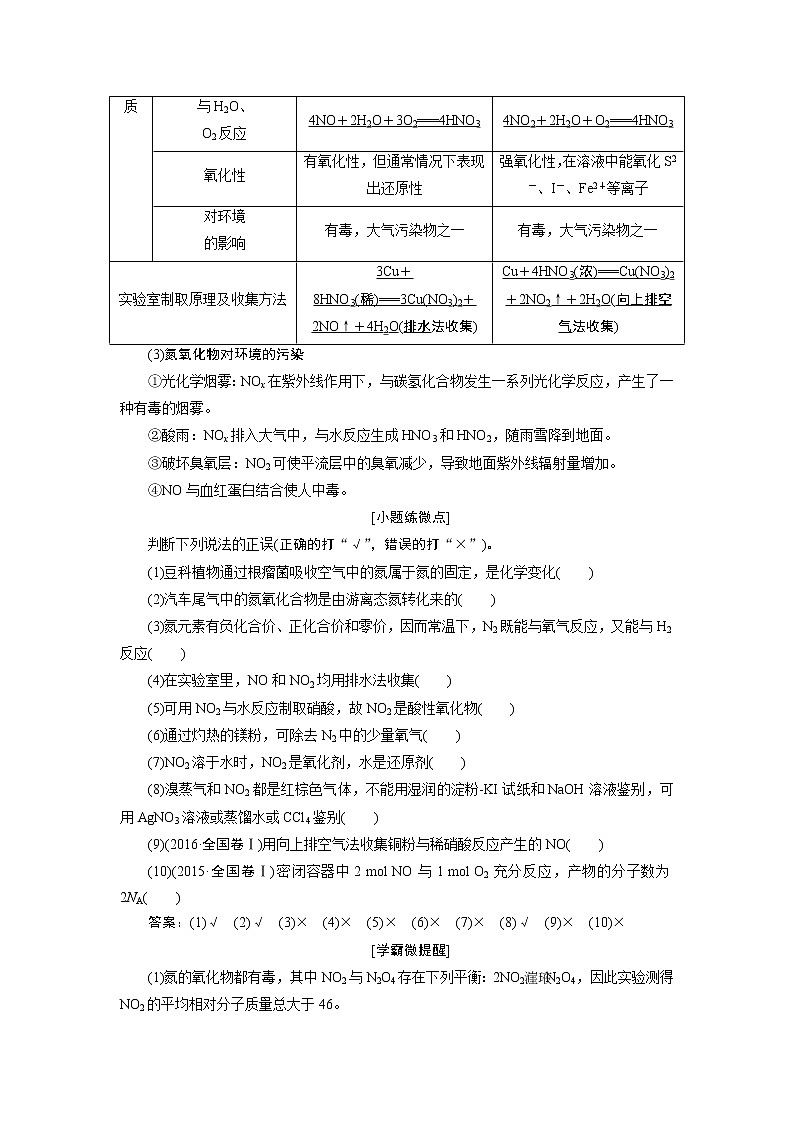
2.氮的氧化物的种类与性质
(1)氮有多种价态的氧化物
如N2O、NO、NO2、N2O4、N2O3、N2O5等。其中属于硝酸酸酐的是N2O5。
(2)NO与NO2性质的比较
NO
NO2
氮的价态
+2价
+4价
物理性质
无色、不溶于水的气体
红棕色、有刺激性气味的气体,易液化,易溶于水
化
学
性
质
与O2
反应
2NO+O2===2NO2
不反应
与H2O反应
不反应
3NO2+H2O===2HNO3+NO
与H2O、
O2反应
4NO+2H2O+3O2===4HNO3
4NO2+2H2O+O2===4HNO3
氧化性
有氧化性,但通常情况下表现出还原性
强氧化性,在溶液中能氧化S2-、I-、Fe2+等离子
对环境
的影响
有毒,大气污染物之一
有毒,大气污染物之一
实验室制取原理及收集方法
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O(排水法收集)
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O(向上排空气法收集)
(3)氮氧化物对环境的污染
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中,与水反应生成HNO3和HNO2,随雨雪降到地面。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化( )
(2)汽车尾气中的氮氧化合物是由游离态氮转化来的( )
(3)氮元素有负化合价、正化合价和零价,因而常温下,N2既能与氧气反应,又能与H2反应( )
(4)在实验室里,NO和NO2均用排水法收集( )
(5)可用NO2与水反应制取硝酸,故NO2是酸性氧化物( )
(6)通过灼热的镁粉,可除去N2中的少量氧气( )
(7)NO2溶于水时,NO2是氧化剂,水是还原剂( )
(8)溴蒸气和NO2都是红棕色气体,不能用湿润的淀粉KI试纸和NaOH溶液鉴别,可用AgNO3溶液或蒸馏水或CCl4鉴别( )
(9)(2016·全国卷Ⅰ)用向上排空气法收集铜粉与稀硝酸反应产生的NO( )
(10)(2015·全国卷Ⅰ)密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA( )
答案:(1)√ (2)√ (3)× (4)× (5)× (6)× (7)× (8)√ (9)× (10)×
[学霸微提醒]
(1)氮的氧化物都有毒,其中NO2与N2O4存在下列平衡:2NO2N2O4,因此实验测得NO2的平均相对分子质量总大于46。
(2)验证某无色气体为NO的方法是向无色气体中通入O2(或空气),无色气体变为红棕色。
NOx的污染治理
1.(2018·全国卷Ⅱ)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是( )
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
解析:选C 雾和霾的分散剂都是空气,A项正确;雾霾中的无机颗粒物含有硝酸铵和硫酸铵,B项正确;NH3参与反应生成铵盐,是反应物,不是催化剂,C项错误;过度施用氮肥会增加大气中氨的含量,D项正确。
2.(2018·天津高考)烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140 ℃;
③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用为________________。
(2)C中填充的干燥剂是(填标号)________。
a.碱石灰 B.无水CuSO4 c.P2O5
(3)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。
(4)采样步骤②加热烟道气的目的是_________________
________________________。
Ⅱ.NOx含量的测定
将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO,加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。
(5)NO被H2O2氧化为NO的离子方程式为______________________________________
________________________________________________________________________。
(6)滴定操作使用的玻璃仪器主要有________________。
(7)滴定过程中发生下列反应:
3Fe2++NO+4H+===NO↑+3Fe3++2H2O
Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O
则气样中NOx折合成NO2的含量为__________ mg·m-3。
(8)判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”)。
若缺少采样步骤③,会使测定结果________。
若FeSO4标准溶液部分变质,会使测定结果________。
解析:(1)装置A是过滤器,装有无碱玻璃棉的作用是过滤除去粉尘。(2)C中填充的是干燥剂,除去H2O且不能与NOx反应,所以应选有酸性、干燥能力强的P2O5。(3)D装置中装有碱液,用于除去NOx,作用与实验室中的洗气瓶相同,该装置的示意图见答案。(4)烟道气中有水,采样步骤②加热器将烟道气加热至140 ℃的目的是防止NOx溶于冷凝水。(5)NO被H2O2氧化为NO,H2O2的还原产物为H2O,离子方程式为2NO+3H2O2===2H++2NO+2H2O。(6)滴定操作使用的玻璃仪器主要有锥形瓶、滴定管,因为该滴定液呈酸性,所以选用酸式滴定管。(7)滴定过程中发生反应:3Fe2++NO+4H+===NO↑+3Fe3++2H2O、Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,与Cr2O反应的Fe2+的物质的量为6c2v2×10-3 mol,标准液中Fe2+的物质的量为c1v1×10-3 mol,则与NO反应的Fe2+的物质的量为(c1v1-6c2v2)×10-3mol,NO的物质的量为 mol,则v L气样中折合成NO2的含量为 mol×46 g·mol-1××1 000 mg·g-1×1 000 L·m-3=×104 mg·m-3。(8)若缺少采样步骤③,系统内存在空气,会使收集的气样中NOx偏少,测定结果偏低。若FeSO4标准溶液部分变质,溶液中的Fe2+浓度减小,消耗的K2Cr2O7标准溶液体积减小,使测定结果偏高。
答案:(1)除尘 (2)c
(3) (4)防止NOx溶于冷凝水
(5)2NO+3H2O2===2H++2NO+2H2O
(6)锥形瓶、酸式滴定管 (7)×104
(8)偏低 偏高
[方法规律] NOx尾气的处理
(1)碱液吸收法
2NO2+2NaOH===NaNO3+NaNO2+H2O,
NO2+NO+2NaOH===2NaNO2+H2O,
NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。一般适合工业尾气中NOx的处理。
(2)催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。反应方程式为
①4NH3+6NO5N2+6H2O;
②8NH3+6NO27N2+12H2O;
③2NO+2CON2+2CO2;
④2NO2+4CON2+4CO2。
氮的氧化物与O2、H2O反应的计算
3.在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( )
①1.2 mL ②2.4 mL ③3 mL ④4 mL
A.①② B.②③
C.③④ D.①④
解析:选D 混合气体通入水中,涉及的反应有①4NO2+O2+2H2O===4HNO3,②3NO2+H2O===2HNO3+NO。若12 mL全部为NO2,发生反应②,剩余气体4 mL大于实际剩余气体2 mL,故剩余气体为NO或O2。若剩余的气体是O2,则V(NO2)=×(12-2)mL=8 mL,V(O2)=12 mL-8 mL=4 mL。若剩余的气体是NO(2 mL)⇒6 mL NO2,则V(O2)=×(12-6)mL=1.2 mL。
4.(2019·石家庄二中模拟)将充有m mol NO和n mol NO2气体的试管倒立于水槽中,然后通入m mol O2,若已知n>m,则充分反应后,试管中的气体在同温同压下的体积为( )
A. B.
C. D.3(n-m)
解析:选B 根据3NO2+H2O===2HNO3+NO知,n mol NO2气体反应后生成 mol NO气体,再根据4NO+3O2+2H2O===4HNO3得∶m>4∶3,则知NO过量,故剩余的体积为-=。
5.氮氧化合物(用NOx表示)是大气污染的重要因素,根据NOx的性质特点,开发出多种化学治理氮氧化合物污染的方法。
(1)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO5N2+6H2O,8NH3+6NO27N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是__________。
(2)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:____________________________________________________________________。
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是___________________________________________________。
解析:(1)设NO的体积为V(NO),NO2的体积为V(NO2),依据方程式知,处理NO需NH3:V(NO),处理NO2需NH3:V(NO2),则,解得V(NO)=0.75 L,V(NO2)=2.25 L,V(NO)∶V(NO2)=1∶3。(2)①生成两种钠盐,必然是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。②NO中氮的化合价为+2价,NO2中氮的化合价为+4价,二者1∶1 混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。
答案:(1)1∶3 (2)①2NO2+2NaOH===NaNO3+NaNO2+H2O ②NaNO2
[方法规律]
氮的氧化物与O2、H2O反应的3种计算方法
1.关系式法
(1)NO和O2混合气体通入水中
由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3。
(2)NO2和O2混合气体通入水中
由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3。
(3)NO、NO2和O2三种混合气体通入水中
先按3NO2+H2O===2HNO3+NO计算出生成的NO体积,然后加上原来混合气体中NO体积,再按①计算。
2.电子守恒法
当NOx转化为硝酸时要失去电子,如果是NOx与O2混合,则反应中O2得到的电子数与NOx失去的电子数相等。
3.原子守恒法
4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O===2HNO3等效。当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
1.我国“神舟 11 号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体成分有 CO2、H2O、N2、NO 等,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量“红烟”,产生“红烟”的原因是( )
A.“红烟”是 Fe2O3
B.NO 与 H2O 反应生成
C.CO2 与 NO 反应生成 NO2
D.NO 遇空气生成 NO2
巧用平衡思想理解NO2气体存在形式
2NO2N2O4 ΔH<0
①NO2能使湿润的淀粉KI试纸变蓝。
②1 mol NO2在标准状况下的体积应小于22.4 L。
③标准状况下,22.4 L NO2的质量大于46 g。
解析:选D 引燃后的高温气体成分有CO2、H2O、N2、NO等无色气体中,NO容易被O2氧化为NO2,NO2是红棕色气体。
2.如图所示,将相同条件下的m体积NO和n体积O2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留 体积的气体,该气体与空气接触后立即变为红棕色。则m与n的比值为( )
A.3∶2 B.2∶3
C.8∶3 D.3∶8
掌握氮的氧化物的相关计算
①计算剩余气体体积。
②溶液的浓度,在计算时一般设容器的体积为V L,通过反应方程式计算剩余气体体积、溶液的浓度。
解析:选C 该过程中涉及的反应有2NO+O2===2NO2、3NO2+H2O===2HNO3+NO,可将两个方程式“合并”为4NO+3O2+2H2O===4HNO3。剩余气体与空气接触立即变为红棕色,说明剩余气体为NO。则可知 体积的NO气体与n体积的O2恰好完全反应。
4NO+3O2+2H2O===4HNO3
4 3
n
4∶=3∶n,解得m∶n=8∶3。
考点(二) 氨和铵盐 【点多面广精细研】
1.氨的物理性质与喷泉实验
(1)物理性质
无色有刺激性气味的气体,密度比空气小,易液化。极易溶于水(1∶700),可由喷泉实验证明。
(2)喷泉实验
①喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。
②常见的能形成喷泉实验的气体和吸收剂如表:
气体
HCl
NH3
CO2、SO2、Cl2、H2S
NO2+O2
吸收剂
水或NaOH溶液
水或盐酸
浓NaOH溶液
水
2.氨的化学性质
(1)与水反应
反应原理为NH3+H2ONH3·H2ONH+OH-。氨气溶于水得氨水,氨水中含有的粒子有:NH3·H2O、H2O、NH3、NH、OH-、H+。NH3·H2O为可溶性一元弱碱,不稳定,易分解,化学方程式为NH3·H2ONH3↑+H2O。
(2)氨气与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为有白烟生成,将浓盐酸改为浓硝酸,也会出现相同的现象。化学方程式为HCl+NH3===NH4Cl、NH3+HNO3===NH4NO3。
(3)与盐溶液的反应
过量氨水与AlCl3溶液反应的离子方程式:
Al3++3NH3·H2O===Al(OH)3↓+3NH。
(4)氨气的还原性
①催化氧化:4NH3+5O24NO+6H2O。
②被CuO氧化:2NH3+3CuO3Cu+N2+3H2O。
③被氯气氧化:2NH3+3Cl2===N2+6HCl或8NH3+3Cl2===N2+6NH4Cl。
(5)氨的用途
①液氨汽化时吸收大量的热,故用作制冷剂。
②制氮肥、硝酸、铵盐、纯碱等。
3.氨气的实验室制法
4.铵盐及NH的检验
(1)铵盐的物理性质
铵盐都是白色固体,均易溶于水。
(2)铵盐的化学性质
(3)NH的检验
未知液产生使湿润的红色石蕊试纸变蓝色的气体,则证明含NH。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)氨易液化,因此可用来作制冷剂( )
(2)氨溶解于水显弱碱性,因此可使酚酞溶液变为红色( )
(3)氨气遇到浓盐酸、硫酸都会发生反应,产生白烟( )
(4)实验室可用浓氨水与生石灰制取氨气( )
(5)加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华( )
(6)氨水中含氮微粒中最多的微粒是NH( )
(7)铵盐都易溶于水,其水溶液均呈酸性( )
(8)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效( )
(9)向某无色溶液中加入稀NaOH溶液,把湿润的红色石蕊试纸放在试管口,不变蓝,则原溶液中不含NH( )
(10)NH4H的结构与NH4Cl相似,NH4H固体与少量H2O反应可有两种气体生成( )
(11)用浓NH4Cl溶液处理过的舞台幕布不易着火是因为NH4Cl隔绝了空气( )
(12)现有1 mol·L-1的氨水,则该溶液中NH3·H2O的浓度是1 mol·L-1( )
答案:(1)√ (2)√ (3)× (4)√ (5)× (6)× (7)×
(8)√ (9)× (10)√ (11)× (12)×
[学霸微提醒]
(1)极易溶于水的气体有NH3(1∶700)、HCl(1∶500)。
(2)NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。
(3)氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
氨气的制备和性质
1.判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)(2018·江苏高考)NH4Cl与Ca(OH)2混合加热可生成NH3( )
(2)(2017·全国卷Ⅱ)加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝,说明NH4HCO3显碱性( )
(3)(2017·天津高考)用烧碱处理含高浓度NH的废水并回收利用氨( )
(4)(2017·北京高考)氨气使AlCl3溶液产生白色沉淀,氨气发生还原反应( )
(5)(2017·江苏高考)利用NH3易溶于水的性质,可用作制冷剂( )
(6)(2016·江苏高考)下列物质间的转化能够实现N2NH3NH4Cl(aq)( )
(7)(2016·上海高考)用生石灰与浓氨水制得的气体能使湿润的红色石蕊试纸变蓝,说明NH3为碱性气体( )
(8)(2015·重庆高考)实验室用如图所示装置制取氨( )
答案:(1)√ (2)× (3)√ (4)× (5)× (6)√ (7)√ (8)×
2.(2016·全国卷Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的________,反应的化学方程式为________________________________________________________________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中
①Y管中_______________________________________________
②反应的化学方程式_______________________________________________
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K2
③________________________________________________
④________________________________________________
解析:(1)①图中给出了两种气体制备装置,一种是固固加热制气装置,一种是固液加热制气装置。如果选择A装置制取氨气,则反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;如果选择B装置制取氨气,则反应的化学方程式为NH3·H2ONH3↑+H2O。②欲收集一瓶干燥的氨气,首先要除去杂质,制备氨气的杂质只有水蒸气,由于氨气溶于水显碱性,因此要选用碱石灰作干燥剂,干燥管的进出口方向为粗进细出,因此先接d后接c;其次要收集氨气,由于氨气的密度小于空气,要从短管进气,因此先接f再接e;最后要进行尾气处理,由于氨气极易溶于水,因此可以选择水吸收尾气,还要注意防倒吸,所以接i。(2)由题干内容“工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2”,结合实验条件可知反应为8NH3+6NO27N2+12H2O,NO2为红棕色气体,发生反应后变成无色气体,因此现象为红棕色气体逐渐变浅。反应后气体分子数减少,Y管中的压强小于外压,因此产生倒吸现象。
答案:(1)①A 2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O(或B NH3·H2ONH3↑+H2O) ②dcfei
(2)①红棕色气体慢慢变浅 ②8NH3+6NO27N2+12H2O ③Z中NaOH溶液产生倒吸现象
④反应后气体分子数减少,Y管中压强小于外压
[易错提醒] 实验室制氨气的注意事项
(1)制氨时铵盐不选(NH4)2CO3、NH4HCO3、NH4NO3等,因为它们受热易分解,使产生的NH3中混有较多的杂质气体,另外NH4NO3易爆炸;选碱时,用Ca(OH)2而不用NaOH或KOH,因为NaOH、KOH具有吸湿性,易结块,不利于产生氨,且在高温下均能腐蚀玻璃。
(2)干燥氨气不能用浓硫酸,也不能用无水CaCl2(8NH3+CaCl2===CaCl2·8NH3),通常用碱石灰干燥氨气。
(3)实验室制取NH3的简易方法
方法
化学方程式(或原理)
发生装置
加热浓氨水
NH3·H2ONH3↑+H2O
浓氨水+
固体NaOH
NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大有利于NH3的生成
浓氨水+
固体CaO
CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解。化学方程式:NH3·H2O+CaO===NH3↑+Ca(OH)2
喷泉实验的原理
3.(2019·南京师大附中检测)
利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是________________________________________________________________________
________________________________________________________________________。
(2)若先打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是
________________________________________________________________________。
(3)通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________________________________________。
若要在该装置中产生双喷泉现象,其操作方法是______________________________
________________________________________________________________________。
解析:(1)打开a、b活塞,再将胶头滴管中的水挤入烧瓶Ⅱ中,由于NH3极易溶于水,使烧瓶内气体压强迅速减小,烧杯中的水迅速进入烧瓶Ⅱ中,形成喷泉。(2)先打开a、c活塞,再将胶头滴管中的水挤入烧瓶Ⅱ中,烧瓶Ⅱ中的气压迅速减小,烧瓶Ⅰ中的HCl气体会流向烧瓶Ⅱ中,且与NH3化合生成NH4Cl而产生白烟。(3)在(2)基础上,若关闭a活塞,打开b活塞,烧杯中的水会迅速进入烧瓶Ⅰ中,形成喷泉;若打开b活塞,不关闭a活塞,烧瓶中的水便会同时进入烧瓶Ⅰ和Ⅱ中,形成双喷泉。
答案:(1)先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞)
(2)烧瓶Ⅱ中导管口处产生白烟
(3)先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,关闭a活塞,然后打开b活塞 先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,打开b活塞
4.(2017·全国卷Ⅰ节选)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3===NH3·H3BO3;NH3·H3BO3+HCl===NH4Cl+H3BO3。
回答下列问题:
(1)a的作用是________________。
(2)b中放入少量碎瓷片的目的是_____________________________________________。
f的名称是________。
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是___________________________________________;
打开k2放掉水。重复操作2~3次。
解析:(1)导管a与大气相通,其作用是避免烧瓶内气压过大,发生危险。(2)加热液体时加入碎瓷片,其作用是防止液体暴沸。冷凝管有直形冷凝管和球形冷凝管、蛇形冷凝管,要指明。(3)停止加热,瓶内水蒸气冷凝,气体压强减小,会引起g中液体倒吸入c中,利用蒸馏水倒吸来洗涤仪器e、f。
答案:(1)避免b中压强过大 (2)防止暴沸 直形冷凝管
(3)c中温度下降,管路中形成负压
归纳拓展
1.喷泉实验的原理分析
(1)形成喷泉的原因
形成喷泉最根本的原因是烧瓶内外存在压强差。当烧瓶内气体溶于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内,如此持续,最后液体将充满烧瓶。
(2)影响喷泉实验成功的因素
①盛气体的烧瓶必须干燥。②气体要充满烧瓶。③烧瓶不能漏气(实验前应先检查装置的气密性)。④所用气体能大量溶于所用液体或气体与液体可以快速反应。
2.喷泉实验的发散装置及操作方法
喷泉实验是中学化学的重要实验,其本质是形成压强差而引发液体上喷,以教材中的装置(发散源)可设计如图所示的多种不同的装置和采用不同的操作(如使气体溶于水、热敷或冷敷、生成气体等)来形成喷泉。
设计说明:装置(Ⅰ)改变了胶头滴管的位置,胶头滴管挤入少量水于试剂瓶中,即可使少量溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。装置(Ⅱ)向导管中通入一定量的H2S和SO2,现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液上喷形成喷泉。装置(Ⅲ)打开①处的止水夹并向烧瓶中缓慢通入等体积的HCl气体后关闭该止水夹,等充分反应后再打开②处的止水夹,观察到先有白烟产生,后产生喷泉。装置(Ⅳ)挤压胶头滴管,然后打开导管上部的两个活塞,则在右面烧瓶出现喷烟现象,再打开导管下部活塞,则可产生双喷泉。
1.如图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。表中对实验现象所做的解释正确的是( )
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH3与浓盐酸反应产生了NH4Cl固体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝
NH3是一种可溶性碱
解析:选A B项,NH3与浓硫酸反应;C项,AlCl3、MgCl2等氯化物溶液均可与NH3反应使溶液变浑浊;D项,NH3·H2O是碱,NH3不属于碱。
2.如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
理清喷泉实验原理
烧瓶中气压减小,形成喷泉,类型是极易溶于水的气体,如NO2、NH3,或者气体与溶液极易反应,如Cl2~NaOH溶液,CO2~NaOH溶液。
解析:选B H2难溶于NaOH溶液,不能形成较大压强差,不能引发“喷泉”现象。
3.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列说法正确的是( )
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质都属于正盐
点拨:NH3中N的化合价为-3价,NO2中N的化合价为+4 价。
解析:选C NaHCO3不是化肥,故A错误;NH4Cl、HNO3受热时都易分解,Na2CO3性质稳定,受热不分解,故B错误;NH3和NO2中氮元素存在中间价态,一定条件下可发生氧化还原反应,故C正确;NaHCO3为酸式盐,故D错误。
4.下列说法中正确的是( )
A.所有铵盐受热均可以分解,产物均有NH3
B.硝酸铵受热易分解爆炸,实验室常用加热氯化铵与氢氧化钙的固体混合物制备氨气
C.在盛有硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的试管中,滴加少量NaOH溶液,在试管口用湿润的红色石蕊试纸检验,试纸变蓝
D.铵盐都易溶于水,其水溶液均呈酸性
解析:选B 铵盐分解不一定产生NH3,如NH4NO3在400 ℃以上分解生成N2、NO2和H2O,A项错;Fe2+比NH更易结合OH-,因而加入少量NaOH,不会产生NH3,C项错;NH4HCO3、(NH4)2S溶液等均呈碱性,D项错。
5.NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。
(2)按如图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是____________________,原因是_____________________
_____________________________________________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是______________________________________________。
解析:(1)制备氨气时,加热固体的试管口应略向下倾斜,所以制备装置应选取装置A;氨气的密度比空气的小,因此应用向下排空气法收集,所以收集装置应选取装置C;氨气极易溶于水,应防止发生倒吸,因此尾气处理装置应选取装置G。(2)A瓶的压强大于B瓶的,因此A瓶中的氯化氢进入B瓶中,与氨气反应生成氯化铵,可以看到B瓶中有白烟生成。由于氯化氢和氨气反应导致B瓶中的压强降低,且B瓶中的氯化氢相对过量,因此当打开旋塞2时,石蕊水溶液会被倒吸入B瓶中,遇氯化氢溶液变红色。
答案:(1)A、C、G
(2)①有白烟生成 A瓶中的氯化氢移动到B瓶中,与B瓶中的氨气反应生成氯化铵,能看到白烟
②液体进入B瓶中,溶液的颜色变红
考点(三) 硝酸 【精讲精练快冲关】
[知能学通]
1.物理性质
硝酸是无色易挥发的液体,有刺激性气味。
2.化学性质
(1)不稳定性
反应的化学方程式:
4HNO32H2O+4NO2↑+O2↑。
(2)强氧化性
浓、稀硝酸均具有强氧化性,浓度越大,氧化性越强,其还原产物的价态越高。还原产物一般为HNO3(浓)―→NO2,HNO3(稀)―→NO。
与金属
反应
稀硝酸与铜反应的化学方程式:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
浓硝酸与铜反应的化学方程式:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
与非金
属反应
浓硝酸与C反应的化学方程式:
C+4HNO3(浓)CO2↑+4NO2↑+2H2O
与还原
性化合
物反应
硝酸可氧化Fe2+、H2S、SO2、Na2SO3、HI等还原性物质。如稀硝酸与FeSO4溶液反应的离子方程式: 3Fe2++4H++NO===3Fe3++NO↑+2H2O
(3)与有机物反应
①硝化反应(与苯反应):
。
②颜色反应:含苯基的蛋白质遇到浓硝酸时变黄色。
3.硝酸工业制法的反应原理
(1)NH3在催化剂作用下与O2反应生成NO:
4NH3+5O24NO+6H2O。
(2)NO进一步氧化生成NO2:2NO+O2===2NO2。
(3)用水吸收NO2生成HNO3:
3NO2+H2O===2HNO3+NO。
[注意] ①硝酸与变价金属反应,金属被氧化为高价态。
②硝酸浓度越大,其还原产物的价态越高。还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO,很稀的硝酸还原产物也可能为N2O、N2或NH4NO3。
③硝酸与金属反应,体现硝酸的强氧化性和酸性,浓硝酸与非金属反应只体现氧化性。
④浓硝酸能使紫色石蕊溶液先变红,后褪色,该反应过程中浓硝酸表现出强酸性和强氧化性。
⑤在酸性条件下NO不能与Fe2+、I-、SO、S2-等还原性较强的离子大量共存。
⑥常温下,铁、铝遇浓硝酸能发生“钝化”,并非不反应,故浓硝酸可以用铁桶或铝桶盛放。
[题点练通]
硝酸的性质
1.判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)(2018·北京高考)热铜丝插入稀硝酸中,产生无色气体,随后变为红棕色,颜色变化与氧化还原反应无关( )
(2)(2016·全国卷Ⅰ)用向上排空气法收集铜粉与稀硝酸反应产生的NO( )
(3)(2016·全国卷Ⅰ)1 mol Fe溶于过量硝酸,电子转移数为2NA( )
(4)(2016·江苏高考)将铜丝插入稀硝酸中:Cu+4H++2NO===Cu2++2NO2↑+H2O( )
(5)(2016·海南高考)将铁屑放入稀HNO3中证明Fe比H2活泼( )
(6)(2015·全国卷Ⅱ)常温下,将浓硝酸滴加到用砂纸打磨过的铝条上,会产生红棕色气体( )
答案:(1)× (2)× (3)× (4)× (5)× (6)×
2.(2017·北京高考)下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
解析:选D ①中灼热碎玻璃起加热作用,浓硝酸受热分解生成红棕色NO2,硝酸中氮元素化合价降低,必有元素化合价升高,只能为氧元素,因此,还有O2生成,产生的气体为混合气体,A项正确;由①可知,浓硝酸受热分解可生成红棕色气体,所以②中产生的“红棕色气体”不一定是木炭与浓硝酸发生反应产生的,B项正确;③中浓硝酸挥发才能与红热木炭接触,产生的NO2是还原产物,C项正确;红热的木炭还可与空气中的O2反应生成CO2,不一定是木炭与浓硝酸发生反应生成了CO2,D项错误。
3.(2019·门头沟区模拟)室温下,某兴趣小组用如图装置在通风橱中进行如下实验:
实验
现象
试管Ⅰ中开始无现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色
试管Ⅱ中剧烈反应,迅速生成大量红棕色气体,溶液呈绿色;之后向绿色溶液中持续通入N2,溶液变为蓝色
下列说法正确的是( )
A.试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成
B.等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更多
C.换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
解析:选D 试管Ⅰ中浅红棕色气体为NO2,是由硝酸还原生成的NO与空气中O2反应生成,故A错误;依据Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O可知,等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更少,故B错误;换成Fe之后重复实验,铁与浓硝酸发生钝化生成致密氧化膜,阻止反应进行,故C错误;铜与浓硝酸反应生成红棕色NO2,试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2,持续通入N2后,溶液变为蓝色,是因为N2把NO2从溶液中带出,故D正确。
4.某化学兴趣小组设计了如图所示的浓HNO3 与Cu反应的微型实验。下列说法中错误的是( )
A.挤压塑料瓶使浓HNO3进入干燥管就可引发反应
B.将装置口向上竖起就可停止反应
C.蘸碱液的棉花可起到吸收NO2的作用
D.该装置适用于木炭与浓硝酸或浓硫酸的反应实验
解析:选D 挤压塑料瓶能使浓硝酸进入干燥管与铜接触,引发反应,故A正确;只需将装置口向上竖起,浓硝酸回流到塑料瓶,而铜片不能进入塑料瓶,可以停止反应,故B正确;二氧化氮与碱反应生成亚硝酸盐和硝酸盐,所以蘸碱液的棉花可起到吸收NO2的作用,故C正确;该装置适用于块状固体和液体反应,且不需要加热的气体的制备,而木炭与浓硫酸和浓硝酸都要加热才反应,故D错误。
5.(2019·尖山区模拟)在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3。铜粉溶解的是( )
A.只有①或② B.只有②或④
C.只有①或②或③ D.①②③④中任意一种
解析:选D ①Cu能和FeCl3反应生成FeCl2和CuCl2,所以Cu能在FeCl3溶液中溶解,正确; ②Fe2O3能与稀H2SO4反应:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu===2FeSO4+CuSO4,所以铜粉溶解,正确;③加入Cu(NO3)2后,溶液中含有H+和NO,所以相当于溶液中含有HNO3,HNO3能和Cu反应,3Cu+8H++2NO===3Cu2++2NO↑+4H2O,所以铜粉溶解,正确;④依据③的分析可知,加入KNO3,相当于加入NO,也与硫酸中的H+构成HNO3致使Cu溶解,正确。
硝酸与金属的反应
6.(2019·福州模拟)将19.2 g的铜和某浓度的硝酸反应,生成8.96 L(标准状况)的气体,则参加反应的硝酸为______mol,将这8.96 L的气体和标准状况下________L的氧气混合,再通入水中没有气体剩余。
解析:因N原子守恒,所以参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=2n(Cu)+n(NO)+n(NO2)=×2+=1 mol;因产生的气体和氧气最终变为硝酸,在上述两个过程中只有两种元素铜、氧的化合价发生变化,根据电子得失守恒,则n(O2)×4=n(Cu)×2,即n(O2)=n(Cu)×=×=0.15 mol,体积为3.36 L。
答案:1 3.36
7.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是______________。
(3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为____________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水____________g。
解析:(1)n(Cu)==0.51 mol,设混合气体中NO的物质的量为x,NO2的物质的量为y。根据气体的总体积为11.2 L,有:x+y=0.5 mol。根据得失电子守恒,有:3x+y=(0.51×2)mol。解方程组得:x=0.26 mol,y=0.24 mol。则:V(NO)=0.26 mol×22.4 L·mol-1=5.824 L, V(NO2)=11.2 L-5.824 L=5.376 L。(2)参加反应的HNO3分两部分:一部分没有被还原,显酸性,生成Cu(NO3)2;另一部分被还原成NO2和NO,所以参加反应的HNO3的物质的量为0.51 mol×2+0.5 mol=1.52 mol。(3)HNO3在反应中一部分变成气体,一部分以NO的形式留在溶液中。变成气体的HNO3的物质的量为0.5 mol。加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aV mol,也就是以NO形式留在溶液中的HNO3的物质的量为10-3aV mol。所以,c(HNO3)= mol·L-1。(4)由得失电子守恒得:2×n(Cu)=2×n(H2O2),×2=n(H2O2)×2,n(H2O2)=0.51 mol,则m(H2O2)=17.34 g。需30%的双氧水:17.34 g÷30%=57.8 g。
答案:(1)5.824 5.376 (2)1.52 mol
(3) (4)57.8
硝酸与金属反应的计算方法
(1)原子守恒法
HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂,转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
(2)得失电子守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
(3)电荷守恒法
HNO3过量时反应后溶液中(不考虑OH-)有:
c(NO)=c(H+)+nc(Mn+)(Mn+代表金属离子)。
(4)离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO进行相关计算,且溶液中要符合电荷守恒。
考点(四) 磷及其化合物 【精讲精练快冲关】
[知能学通]
1.磷单质
(1)磷的同素异形体
白磷不溶于水,易溶于CS2,分子式为P4,为正四面体结构(),与红磷(赤磷)是同素异形体。
(2)单质磷的化学性质
①与氧气反应:P4+5O22P2O5(五氧化二磷)。
②与卤素单质反应:
P4+6Cl24PCl3(白雾),P4+10Cl24PCl5(白烟)。
③与稀硝酸反应:
3P+5HNO3+2H2O3H3PO4+5NO↑。
2.五氧化二磷和磷化氢
五氧化二磷是磷酸的酸酐,有很强的吸水性,是一种干燥剂。磷化氢的化学式为PH3,碱性比氨气弱得多,强还原剂。
3.磷酸
磷酸易溶于水、难挥发,属于三元非氧化性中强酸(可当作弱酸对待),具有酸的通性。
(1)电离方程式
H3PO4H++H2PO,H2POH++HPO,HPOH++PO。
(2)与碱反应
NaOH+H3PO4===NaH2PO4+H2O(生成磷酸二氢盐),
2NaOH+H3PO4===Na2HPO4+2H2O(生成磷酸氢盐),
3NaOH+H3PO4===Na3PO4+3H2O(生成正盐)。
[题点练通]
1.(2019·黄冈模拟)砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是( )
A.黄砷中共价键键能大于白磷
B.黄砷的熔点高于白磷
C.黄砷易溶于水
D.分子中共价键键角均为109.5°
解析:选B 原子半径:As>P,键长越大键能越小,则黄砷中共价键键能小于白磷,故A错误;相对分子质量越大,分子间作用力越强,熔点越高,则黄砷的熔点高于白磷,故B正确;黄砷为非极性分子,水为极性溶剂,根据相似相溶原理,黄砷不易溶于水,故C错误;P4、As4都为正四面体结构,As、P原子位于正四面体的顶点上,分子中共价键键角均为60°,故D错误。
2.PH3是一种无色剧毒气体。下列判断错误的是( )
A.PH3分子是非极性分子
B.PH3分子中有一对孤电子对
C.PH3分子形状为三角锥形
D.PH3分子稳定性低于 NH3分子
解析:选A PH3分子结构是三角锥形,正负电荷重心不重合,为极性分子,故A错误,C正确;PH3分子结构和 NH3相似,中心原子都含有一个孤电子对,故B正确;共价键键长越短,键能越大,分子越稳定,P的原子半径比N大,则N—H键键长更短、键能更高,所以PH3分子稳定性低于NH3分子,故D正确。
3.磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(1 550 ℃)下通过下面三个反应共熔得到。
a.4Ca3(PO4)2(s)+10C(s)===12CaO(s)+2P4(s)+10CO2(g)
b.CaO(s)+SiO2(s)===CaSiO3(s)
c.CO2(g)+C(s)===2CO(g)
已知:CaSiO3的熔点(1 546 ℃)比SiO2低。
①写出由Ca3(PO4)2、焦炭和SiO2在电炉中高温(1 550 ℃)制取白磷总的化学反应方程式________________________________________________________________________
________________________________________________________________________。
②白磷(P4)是正四面体结构,请画出白磷(P4)的结构式_____________,并指出1 mol白磷(P4)含有P—P键的数目_____________。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体____________(写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在_________之间 (已知磷酸的各级电离常数为K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 ,lg 7.1≈0.9 lg 6.3≈0.8 lg 4.2≈0.6)。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是__________________________________________________(用离子方程式表示)。
解析:(1)①根据已知反应,结合热化学方程式和盖斯定律得到总反应的化学方程式为2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4+10CO。②白磷(P4)是正四面体结构,P—P间形成共价键,白磷(P4)的结构式为,1 mol白磷(P4)含有P—P键的数目为6NA。(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体,磷元素升高为次磷酸盐,磷元素化合价为+1价,降低的只能为负价,则为氢化物PH3。(3)为获得尽可能纯的NaH2PO4,需配制磷酸、磷酸二氢钠的缓冲溶液,当溶液全部为磷酸溶液时,磷酸以第一步电离为主,所以H3PO4H++H2PO K1=7.1×10-3;pH=-lg c(H+)=3-lg 7.1≈2.1,当溶液全部为NaH2PO4溶液时,H2POH++HPO K2=6.3×10-8,所以pH=-lg c(H+)=8-lg 6.3≈7.2,所以pH应控制介于2.1~7.2之间;HPO既能发生电离又能发生水解,电离反应式为HPOPO+H+,水解反应式为HPO+H2OH2PO+OH-,溶液呈碱性,说明水解程度大于电离程度;由于HPO和Ca2+反应生成沉淀:3Ca2++2HPO===Ca3(PO4)2↓+2H+,促进HPO的电离,溶液则显酸性。
答案:(1)①2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4+10CO
② 6NA
(2)PH3
(3)2.1~7.2 3Ca2++2HPO===Ca3(PO4 )2↓+2H+
考点(五) 常见无机物的转化关系 【多角探明无盲点】
无机推断题作为一种传统的高考题型,重点考查学生对元素及其化合物主干知识的掌握情况,题目结构紧凑,文字表述少,但转化关系中包含信息多,综合性强,难度较大。解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
抓住“物质颜色”作为突破口
有色固体
①红色:Cu、Cu2O、Fe2O3;
②红褐色:Fe(OH)3;
③黄色:AgI;
④淡黄色:S、Na2O2、AgBr;
⑤蓝色:Cu(OH)2;
⑥黑色:炭粉、CuO、MnO2、FeS、CuS;
⑦紫黑色:KMnO4、I2;
⑧白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3
有色溶液
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO(紫红色)、Fe3+遇 SCN-(血红色)、I2遇淀粉(蓝色)、Fe3+遇苯酚(紫色)等
有色气体
Cl2(黄绿色)、Br2(g)、NO2(红棕色)、I2(g)(紫色)、O3(淡蓝色)等
火焰颜色
①焰色反应:Na+(黄色)、K+(紫色,透过蓝色钴玻璃)等;
②蓝色:CO在空气中燃烧;
③淡蓝色:S、H2、CH4等在空气中燃烧;
④苍白色:H2在Cl2中燃烧
[对点练]
1.有一化合物X,其水溶液为浅绿色,可发生如图的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。
请回答下列问题:
(1)B的电子式为____________。
(2)画出元素M的原子结构示意图____________________________________________。
(3)物质X的化学式为____________。
(4)电解混合液时阳极反应式为________________________________________________。
(5)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应:___________________________________________________;
②含有L元素的置换反应:___________________________________________________。
解析:由颜色可知C为Fe(OH)3,则A为Fe(OH)2、H为Fe2O3,由M、L为常见的金属单质,可知M、L分别为Al、Fe;X与NaOH反应生成气体B,B一定是NH3;在混合液中加入BaCl2溶液有不溶于盐酸的沉淀生成,可知含有SO,所以X为(NH4)2Fe(SO4)2,混合液为NaOH和Na2SO4溶液,电解生成H2、O2,D、E分别为O2、H2,F为NO,G为HNO3。
答案:(1) (2)
(3)(NH4)2Fe(SO4)2
(4)4OH--4e-===O2↑+2H2O
(5)①4Fe(OH)2+O2+2H2O===4Fe(OH)3
②Fe2O3+2Al2Fe+Al2O3
抓住“物质特性”作为突破口
(1)能使品红溶液褪色的气体
SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。
(2)沉淀发生特殊的颜色变化
Fe(OH)2Fe(OH)3(白色沉淀先变灰绿色,再变红褐色)。
(3)在空气中变为红棕色
NO(无色)NO2(红棕色)。
(4)能使澄清石灰水变浑浊的气体:CO2、SO2。
(5)通入CO2气体变浑浊的溶液:澄清石灰水(过量则变澄清)、Na2SiO3溶液、饱和Na2CO3溶液。
(6)使湿润的红色石蕊试纸变蓝的气体:NH3。
(7)使湿润的淀粉KI试纸变蓝的物质:NO2、Cl2、Br2、FeCl3等。
(8)常温下能溶解SiO2固体的物质:氢氟酸和NaOH溶液。
(9)烟雾现象
棕(黄)色的烟
Cu或Fe在Cl2中燃烧
白烟
Na在Cl2中燃烧;NH3遇到浓盐酸或浓硝酸
白雾
由HX等极易溶于水的气体产生
(10)钝化现象:常温下Fe、Al遇到浓硫酸或浓硝酸会生成一层致密的氧化膜,从而保护金属不再发生反应。
[对点练]
2.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如图实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图______,写出气体甲的电子式____________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_______________________________________________________
________________________________________________________________________,
并设计实验方案验证该反应的产物___________________________________________
________________________________________________________________________
________________________________________________________________________。
解析:从框图可知,气体甲为CO2;由溶液1转变为白色沉淀1,白色沉淀1又能溶解在CO2水溶液中,可推断白色沉淀1为CaCO3;从固体2的转化过程可知,白色沉淀2为Fe(OH)2,最终的红褐色沉淀为Fe(OH)3;由上述推断可初步确定X为含有Ca、Fe元素的碳酸盐,且其中铁元素的化合价为+2,故可推断其为CaFe(CO3)2,分解得到的固体1为CaO与FeO的混合物,应用题给数据可以进一步确认上述判断的正确性。(1)白色沉淀1中的金属元素为钙,其原子结构示意图为,气体甲为CO2,其电子式为。(2)X的化学式为CaFe(CO3)2;在惰性气流中加热X至完全分解的化学反应方程式为CaFe(CO3)2CaO+FeO+2CO2↑。(3)白色沉淀2在空气中变成红褐色沉淀是因为Fe(OH)2被氧化成Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。(4)CO2气体与固体1中的FeO可能发生氧化还原反应,反应方程式为2FeO+CO2Fe2O3+CO;检验产物的方法:取反应所得固体物质,加稀盐酸溶解,然后加入KSCN溶液,若溶液呈红色,说明反应产物中有Fe(Ⅲ)。将生成的气体通过灼热CuO,若黑色固体变为红色,证明生成的气体中含有CO。
答案:(1)
(2)CaFe(CO3)2 CaFe(CO3)2CaO+FeO+2CO2↑
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)2FeO+CO2Fe2O3+CO 检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变为红色
抓住“特殊反应条件”作为突破口
反应条件
反应方程式
高温
①CaCO3CaO+CO2↑;
②SiO2+CaCO3CaSiO3+CO2↑;
③SiO2+Na2CO3Na2SiO3+CO2↑;
④SiO2+CaOCaSiO3;
⑤SiO2+2CSi+2CO↑;
⑥C+H2O(g)CO+H2;
⑦CO+H2O(g)CO2+H2;
⑧3Fe+4H2O(g)Fe3O4+4H2;
⑨2Al+Fe2O32Fe+Al2O3
高温、高压
和催化剂
N2+3H22NH3
加热、
催化剂
①4NH3+5O24NO+6H2O;
②2SO2+O22SO3
电解
①2NaCl+2H2O2NaOH+H2↑+Cl2↑;
②2H2O2H2↑+O2↑;
③2Al2O3(熔融)4Al+3O2↑
[对点练]
3.如图所示为A、B、C、D、E五种含氮物质之间的相互转化关系。
(1)写出各物质的化学式:
B_________,C_________,D_________,E_________。
(2)写出各步反应的化学方程式。
①D→C:____________________________________________________________。
②B→E:_____________________________________________________________。
③E→C:(写离子方程式)________________________________________。
解析:(1)A与氢气在高温、高压、催化剂作用下发生反应合成氨气,A为氮气,氮气在放电的条件下可以和氧气发生反应生成一氧化氮,一氧化氮能和氧气化合为红棕色的二氧化氮气体,氨气的催化氧化产物是一氧化氮和水,二氧化氮可以和水发生反应生成硝酸和一氧化氮,金属铜可以和稀硝酸发生反应生成硝酸铜、一氧化氮和水。所以A、B、C、D、E分别是N2、NO2、NO、NH3、HNO3。(2)①D→C是氨气的催化氧化,产物是一氧化氮和水,即4NH3+5O24NO+6H2O。②B→E是二氧化氮和水反应生成硝酸和一氧化氮,即3NO2+H2O===2HNO3+NO。③E→C是铜和稀硝酸反应生成一氧化氮、硝酸铜和水,反应的离子方程式为3Cu+8H++2NO===3Cu2++2NO↑+4H2O。
答案:(1)NO2 NO NH3 HNO3
(2)①4NH3+5O24NO+6H2O
②3NO2+H2O===2HNO3+NO
③3Cu+8H++2NO===3Cu2++2NO↑+4H2O
抓住“特殊数据”作为突破口
(1)常见10电子微粒及相互转化关系
分子
Ne、HF、H2O、NH3、CH4
阳离子
Na+、Mg2+、Al3+、NH、H3O+
阴离子
F-、O2-、N3-、OH-、NH
其相互转化关系为NH+OH-NH3↑+H2O;H3O++OH-===2H2O
(2)常见18电子微粒
分子
Ar、HCl、H2S、PH3、SiH4、H2O2、N2H4、F2
阳离子
K+、Ca2+
阴离子
Cl-、S2-、P3-、O
有机物
CH3OH、CH3NH2、CH3F、CH3CH3
(3)常见物质的相对分子质量
相对分子质量
物质
28
CO、N2、C2H4
26
C2H2
32
S、O2
78
Na2S、Na2O2、Al(OH)3
100
CaCO3、KHCO3、Mg3N2
[对点练]
4.如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是( )
A.常温下,单质a呈气态
B.单质c具有强氧化性
C.稳定性:d>e
D.f受热易分解为d和e
解析:选C a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,则b一定是H2。分子中所含原子个数:d>e,f为离子化合物,因此f一定是铵盐,则a是N2,c是F2,d是NH3,e是HF,f是NH4F。常温下N2是气体,A正确;F是最活泼的非金属元素,因此单质氟具有强氧化性,B正确;非金属性是F强于N元素,故氢化物稳定性是HF强于NH3,C不正确;铵盐受热易分解,因此NH4F受热分解生成NH3和HF,D正确。
抓住“特殊转化关系”作为突破口
(1)直线型转化关系
①金属碱性氧化物碱盐型,
满足此关系的有 K、Na、Ca、Ba等。
②非金属酸性氧化物酸盐型,
满足此关系的有C、N、S等。
③ABC(酸或碱)型,
满足此关系的有NH3、N2、S、H2S、C、Na等。
(2)交叉型转化关系
(3)三角型转化关系
(4)置换反应型反应关系
化合物A+单质B―→化合物C+单质D
这类反应主要有:
CO2+2Mg2MgO+C;
Fe2O3+3H22Fe+3H2O;
Fe+2HCl===FeCl2+H2↑;
C+H2O(g)CO+H2;
3Fe+4H2O(g)Fe3O4+4H2。
[对点练]
5.表中各组物质之间不可以通过一步反应实现如图所示转化关系的是( )
选项
X
Y
Z
箭头旁所标数字代表的反应条件
A
Na2O2
NaOH
NaCl
①常温遇水
B
Al2O3
NaAlO2
Al(OH)3
②通入CO2
C
NO
NO2
HNO3
④加入铜粉
D
Cl2
NaClO
HClO
③加浓盐酸
解析:选A 氯化钠不能通过一步反应得到过氧化钠,故A符合题意;氧化铝与氢氧化钠溶液反应生成偏铝酸钠,向偏铝酸钠溶液中通入二氧化碳,二者反应生成氢氧化铝,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠,氢氧化铝受热分解生成氧化铝,各物质之间通过一步反应可以实现转化,故B不符合题意;一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,稀硝酸与铜反应生成一氧化氮,浓硝酸与铜反应生成二氧化氮,各物质之间通过一步反应可以实现转化,故C不符合题意;氯气与氢氧化钠溶液反应生成次氯酸钠,次氯酸钠与碳酸反应生成次氯酸,次氯酸与氢氧化钠溶液反应生成次氯酸钠,次氯酸与浓盐酸反应生成氯气,各物质之间通过一步反应可以实现转化,故D不符合题意。
氮及其化合物
1.了解氮元素单质及其重要化合物的制备方法,掌握其主要性质及其应用。
2.了解氮元素单质及其重要化合物对环境的影响。
3.掌握氨气的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
4.了解化学与生活、材料、能源、环境、生命、信息技术等的关系。
5.了解“绿色化学”的重要性。
考点(一) 氮及其氧化物 【点多面广精细研】
1.氮气的结构与性质
(1)氮元素的存在与氮的固定
(2)N2的物理性质
无色、无味气体,密度比空气略小,难溶于水。
(3)N2的化学性质
①与氧气反应:N2+O22NO。
②与氢气反应:N2+3H22NH3。
③与镁反应:3Mg+N2Mg3N2。
2.氮的氧化物的种类与性质
(1)氮有多种价态的氧化物
如N2O、NO、NO2、N2O4、N2O3、N2O5等。其中属于硝酸酸酐的是N2O5。
(2)NO与NO2性质的比较
NO
NO2
氮的价态
+2价
+4价
物理性质
无色、不溶于水的气体
红棕色、有刺激性气味的气体,易液化,易溶于水
化
学
性
质
与O2
反应
2NO+O2===2NO2
不反应
与H2O反应
不反应
3NO2+H2O===2HNO3+NO
与H2O、
O2反应
4NO+2H2O+3O2===4HNO3
4NO2+2H2O+O2===4HNO3
氧化性
有氧化性,但通常情况下表现出还原性
强氧化性,在溶液中能氧化S2-、I-、Fe2+等离子
对环境
的影响
有毒,大气污染物之一
有毒,大气污染物之一
实验室制取原理及收集方法
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O(排水法收集)
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O(向上排空气法收集)
(3)氮氧化物对环境的污染
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中,与水反应生成HNO3和HNO2,随雨雪降到地面。
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化( )
(2)汽车尾气中的氮氧化合物是由游离态氮转化来的( )
(3)氮元素有负化合价、正化合价和零价,因而常温下,N2既能与氧气反应,又能与H2反应( )
(4)在实验室里,NO和NO2均用排水法收集( )
(5)可用NO2与水反应制取硝酸,故NO2是酸性氧化物( )
(6)通过灼热的镁粉,可除去N2中的少量氧气( )
(7)NO2溶于水时,NO2是氧化剂,水是还原剂( )
(8)溴蒸气和NO2都是红棕色气体,不能用湿润的淀粉KI试纸和NaOH溶液鉴别,可用AgNO3溶液或蒸馏水或CCl4鉴别( )
(9)(2016·全国卷Ⅰ)用向上排空气法收集铜粉与稀硝酸反应产生的NO( )
(10)(2015·全国卷Ⅰ)密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA( )
答案:(1)√ (2)√ (3)× (4)× (5)× (6)× (7)× (8)√ (9)× (10)×
[学霸微提醒]
(1)氮的氧化物都有毒,其中NO2与N2O4存在下列平衡:2NO2N2O4,因此实验测得NO2的平均相对分子质量总大于46。
(2)验证某无色气体为NO的方法是向无色气体中通入O2(或空气),无色气体变为红棕色。
NOx的污染治理
1.(2018·全国卷Ⅱ)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是( )
A.雾和霾的分散剂相同
B.雾霾中含有硝酸铵和硫酸铵
C.NH3是形成无机颗粒物的催化剂
D.雾霾的形成与过度施用氮肥有关
解析:选C 雾和霾的分散剂都是空气,A项正确;雾霾中的无机颗粒物含有硝酸铵和硫酸铵,B项正确;NH3参与反应生成铵盐,是反应物,不是催化剂,C项错误;过度施用氮肥会增加大气中氨的含量,D项正确。
2.(2018·天津高考)烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140 ℃;
③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用为________________。
(2)C中填充的干燥剂是(填标号)________。
a.碱石灰 B.无水CuSO4 c.P2O5
(3)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。
(4)采样步骤②加热烟道气的目的是_________________
________________________。
Ⅱ.NOx含量的测定
将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化成NO,加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L-1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2 mL。
(5)NO被H2O2氧化为NO的离子方程式为______________________________________
________________________________________________________________________。
(6)滴定操作使用的玻璃仪器主要有________________。
(7)滴定过程中发生下列反应:
3Fe2++NO+4H+===NO↑+3Fe3++2H2O
Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O
则气样中NOx折合成NO2的含量为__________ mg·m-3。
(8)判断下列情况对NOx含量测定结果的影响(填“偏高”“偏低”或“无影响”)。
若缺少采样步骤③,会使测定结果________。
若FeSO4标准溶液部分变质,会使测定结果________。
解析:(1)装置A是过滤器,装有无碱玻璃棉的作用是过滤除去粉尘。(2)C中填充的是干燥剂,除去H2O且不能与NOx反应,所以应选有酸性、干燥能力强的P2O5。(3)D装置中装有碱液,用于除去NOx,作用与实验室中的洗气瓶相同,该装置的示意图见答案。(4)烟道气中有水,采样步骤②加热器将烟道气加热至140 ℃的目的是防止NOx溶于冷凝水。(5)NO被H2O2氧化为NO,H2O2的还原产物为H2O,离子方程式为2NO+3H2O2===2H++2NO+2H2O。(6)滴定操作使用的玻璃仪器主要有锥形瓶、滴定管,因为该滴定液呈酸性,所以选用酸式滴定管。(7)滴定过程中发生反应:3Fe2++NO+4H+===NO↑+3Fe3++2H2O、Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,与Cr2O反应的Fe2+的物质的量为6c2v2×10-3 mol,标准液中Fe2+的物质的量为c1v1×10-3 mol,则与NO反应的Fe2+的物质的量为(c1v1-6c2v2)×10-3mol,NO的物质的量为 mol,则v L气样中折合成NO2的含量为 mol×46 g·mol-1××1 000 mg·g-1×1 000 L·m-3=×104 mg·m-3。(8)若缺少采样步骤③,系统内存在空气,会使收集的气样中NOx偏少,测定结果偏低。若FeSO4标准溶液部分变质,溶液中的Fe2+浓度减小,消耗的K2Cr2O7标准溶液体积减小,使测定结果偏高。
答案:(1)除尘 (2)c
(3) (4)防止NOx溶于冷凝水
(5)2NO+3H2O2===2H++2NO+2H2O
(6)锥形瓶、酸式滴定管 (7)×104
(8)偏低 偏高
[方法规律] NOx尾气的处理
(1)碱液吸收法
2NO2+2NaOH===NaNO3+NaNO2+H2O,
NO2+NO+2NaOH===2NaNO2+H2O,
NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。一般适合工业尾气中NOx的处理。
(2)催化转化法
在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2)或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。反应方程式为
①4NH3+6NO5N2+6H2O;
②8NH3+6NO27N2+12H2O;
③2NO+2CON2+2CO2;
④2NO2+4CON2+4CO2。
氮的氧化物与O2、H2O反应的计算
3.在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( )
①1.2 mL ②2.4 mL ③3 mL ④4 mL
A.①② B.②③
C.③④ D.①④
解析:选D 混合气体通入水中,涉及的反应有①4NO2+O2+2H2O===4HNO3,②3NO2+H2O===2HNO3+NO。若12 mL全部为NO2,发生反应②,剩余气体4 mL大于实际剩余气体2 mL,故剩余气体为NO或O2。若剩余的气体是O2,则V(NO2)=×(12-2)mL=8 mL,V(O2)=12 mL-8 mL=4 mL。若剩余的气体是NO(2 mL)⇒6 mL NO2,则V(O2)=×(12-6)mL=1.2 mL。
4.(2019·石家庄二中模拟)将充有m mol NO和n mol NO2气体的试管倒立于水槽中,然后通入m mol O2,若已知n>m,则充分反应后,试管中的气体在同温同压下的体积为( )
A. B.
C. D.3(n-m)
解析:选B 根据3NO2+H2O===2HNO3+NO知,n mol NO2气体反应后生成 mol NO气体,再根据4NO+3O2+2H2O===4HNO3得∶m>4∶3,则知NO过量,故剩余的体积为-=。
5.氮氧化合物(用NOx表示)是大气污染的重要因素,根据NOx的性质特点,开发出多种化学治理氮氧化合物污染的方法。
(1)用氨可将氮氧化物转化为无毒气体。已知:4NH3+6NO5N2+6H2O,8NH3+6NO27N2+12H2O。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积之比是__________。
(2)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:____________________________________________________________________。
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是___________________________________________________。
解析:(1)设NO的体积为V(NO),NO2的体积为V(NO2),依据方程式知,处理NO需NH3:V(NO),处理NO2需NH3:V(NO2),则,解得V(NO)=0.75 L,V(NO2)=2.25 L,V(NO)∶V(NO2)=1∶3。(2)①生成两种钠盐,必然是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。②NO中氮的化合价为+2价,NO2中氮的化合价为+4价,二者1∶1 混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。
答案:(1)1∶3 (2)①2NO2+2NaOH===NaNO3+NaNO2+H2O ②NaNO2
[方法规律]
氮的氧化物与O2、H2O反应的3种计算方法
1.关系式法
(1)NO和O2混合气体通入水中
由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3。
(2)NO2和O2混合气体通入水中
由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3。
(3)NO、NO2和O2三种混合气体通入水中
先按3NO2+H2O===2HNO3+NO计算出生成的NO体积,然后加上原来混合气体中NO体积,再按①计算。
2.电子守恒法
当NOx转化为硝酸时要失去电子,如果是NOx与O2混合,则反应中O2得到的电子数与NOx失去的电子数相等。
3.原子守恒法
4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O===2HNO3等效。当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
1.我国“神舟 11 号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体成分有 CO2、H2O、N2、NO 等,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量“红烟”,产生“红烟”的原因是( )
A.“红烟”是 Fe2O3
B.NO 与 H2O 反应生成
C.CO2 与 NO 反应生成 NO2
D.NO 遇空气生成 NO2
巧用平衡思想理解NO2气体存在形式
2NO2N2O4 ΔH<0
①NO2能使湿润的淀粉KI试纸变蓝。
②1 mol NO2在标准状况下的体积应小于22.4 L。
③标准状况下,22.4 L NO2的质量大于46 g。
解析:选D 引燃后的高温气体成分有CO2、H2O、N2、NO等无色气体中,NO容易被O2氧化为NO2,NO2是红棕色气体。
2.如图所示,将相同条件下的m体积NO和n体积O2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留 体积的气体,该气体与空气接触后立即变为红棕色。则m与n的比值为( )
A.3∶2 B.2∶3
C.8∶3 D.3∶8
掌握氮的氧化物的相关计算
①计算剩余气体体积。
②溶液的浓度,在计算时一般设容器的体积为V L,通过反应方程式计算剩余气体体积、溶液的浓度。
解析:选C 该过程中涉及的反应有2NO+O2===2NO2、3NO2+H2O===2HNO3+NO,可将两个方程式“合并”为4NO+3O2+2H2O===4HNO3。剩余气体与空气接触立即变为红棕色,说明剩余气体为NO。则可知 体积的NO气体与n体积的O2恰好完全反应。
4NO+3O2+2H2O===4HNO3
4 3
n
4∶=3∶n,解得m∶n=8∶3。
考点(二) 氨和铵盐 【点多面广精细研】
1.氨的物理性质与喷泉实验
(1)物理性质
无色有刺激性气味的气体,密度比空气小,易液化。极易溶于水(1∶700),可由喷泉实验证明。
(2)喷泉实验
①喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,大气压将烧杯中的水压入烧瓶而形成喷泉。
②常见的能形成喷泉实验的气体和吸收剂如表:
气体
HCl
NH3
CO2、SO2、Cl2、H2S
NO2+O2
吸收剂
水或NaOH溶液
水或盐酸
浓NaOH溶液
水
2.氨的化学性质
(1)与水反应
反应原理为NH3+H2ONH3·H2ONH+OH-。氨气溶于水得氨水,氨水中含有的粒子有:NH3·H2O、H2O、NH3、NH、OH-、H+。NH3·H2O为可溶性一元弱碱,不稳定,易分解,化学方程式为NH3·H2ONH3↑+H2O。
(2)氨气与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为有白烟生成,将浓盐酸改为浓硝酸,也会出现相同的现象。化学方程式为HCl+NH3===NH4Cl、NH3+HNO3===NH4NO3。
(3)与盐溶液的反应
过量氨水与AlCl3溶液反应的离子方程式:
Al3++3NH3·H2O===Al(OH)3↓+3NH。
(4)氨气的还原性
①催化氧化:4NH3+5O24NO+6H2O。
②被CuO氧化:2NH3+3CuO3Cu+N2+3H2O。
③被氯气氧化:2NH3+3Cl2===N2+6HCl或8NH3+3Cl2===N2+6NH4Cl。
(5)氨的用途
①液氨汽化时吸收大量的热,故用作制冷剂。
②制氮肥、硝酸、铵盐、纯碱等。
3.氨气的实验室制法
4.铵盐及NH的检验
(1)铵盐的物理性质
铵盐都是白色固体,均易溶于水。
(2)铵盐的化学性质
(3)NH的检验
未知液产生使湿润的红色石蕊试纸变蓝色的气体,则证明含NH。
[小题练微点]
判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)氨易液化,因此可用来作制冷剂( )
(2)氨溶解于水显弱碱性,因此可使酚酞溶液变为红色( )
(3)氨气遇到浓盐酸、硫酸都会发生反应,产生白烟( )
(4)实验室可用浓氨水与生石灰制取氨气( )
(5)加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华( )
(6)氨水中含氮微粒中最多的微粒是NH( )
(7)铵盐都易溶于水,其水溶液均呈酸性( )
(8)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效( )
(9)向某无色溶液中加入稀NaOH溶液,把湿润的红色石蕊试纸放在试管口,不变蓝,则原溶液中不含NH( )
(10)NH4H的结构与NH4Cl相似,NH4H固体与少量H2O反应可有两种气体生成( )
(11)用浓NH4Cl溶液处理过的舞台幕布不易着火是因为NH4Cl隔绝了空气( )
(12)现有1 mol·L-1的氨水,则该溶液中NH3·H2O的浓度是1 mol·L-1( )
答案:(1)√ (2)√ (3)× (4)√ (5)× (6)× (7)×
(8)√ (9)× (10)√ (11)× (12)×
[学霸微提醒]
(1)极易溶于水的气体有NH3(1∶700)、HCl(1∶500)。
(2)NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,可在推断题中作为解题突破口。
(3)氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
氨气的制备和性质
1.判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)(2018·江苏高考)NH4Cl与Ca(OH)2混合加热可生成NH3( )
(2)(2017·全国卷Ⅱ)加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝,说明NH4HCO3显碱性( )
(3)(2017·天津高考)用烧碱处理含高浓度NH的废水并回收利用氨( )
(4)(2017·北京高考)氨气使AlCl3溶液产生白色沉淀,氨气发生还原反应( )
(5)(2017·江苏高考)利用NH3易溶于水的性质,可用作制冷剂( )
(6)(2016·江苏高考)下列物质间的转化能够实现N2NH3NH4Cl(aq)( )
(7)(2016·上海高考)用生石灰与浓氨水制得的气体能使湿润的红色石蕊试纸变蓝,说明NH3为碱性气体( )
(8)(2015·重庆高考)实验室用如图所示装置制取氨( )
答案:(1)√ (2)× (3)√ (4)× (5)× (6)√ (7)√ (8)×
2.(2016·全国卷Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备
①氨气的发生装置可以选择上图中的________,反应的化学方程式为________________________________________________________________________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
操作步骤
实验现象
解释原因
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中
①Y管中_______________________________________________
②反应的化学方程式_______________________________________________
将注射器活塞退回原处并固定,待装置恢复到室温
Y管中有少量水珠
生成的气态水凝聚
打开K2
③________________________________________________
④________________________________________________
解析:(1)①图中给出了两种气体制备装置,一种是固固加热制气装置,一种是固液加热制气装置。如果选择A装置制取氨气,则反应的化学方程式为2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;如果选择B装置制取氨气,则反应的化学方程式为NH3·H2ONH3↑+H2O。②欲收集一瓶干燥的氨气,首先要除去杂质,制备氨气的杂质只有水蒸气,由于氨气溶于水显碱性,因此要选用碱石灰作干燥剂,干燥管的进出口方向为粗进细出,因此先接d后接c;其次要收集氨气,由于氨气的密度小于空气,要从短管进气,因此先接f再接e;最后要进行尾气处理,由于氨气极易溶于水,因此可以选择水吸收尾气,还要注意防倒吸,所以接i。(2)由题干内容“工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2”,结合实验条件可知反应为8NH3+6NO27N2+12H2O,NO2为红棕色气体,发生反应后变成无色气体,因此现象为红棕色气体逐渐变浅。反应后气体分子数减少,Y管中的压强小于外压,因此产生倒吸现象。
答案:(1)①A 2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O(或B NH3·H2ONH3↑+H2O) ②dcfei
(2)①红棕色气体慢慢变浅 ②8NH3+6NO27N2+12H2O ③Z中NaOH溶液产生倒吸现象
④反应后气体分子数减少,Y管中压强小于外压
[易错提醒] 实验室制氨气的注意事项
(1)制氨时铵盐不选(NH4)2CO3、NH4HCO3、NH4NO3等,因为它们受热易分解,使产生的NH3中混有较多的杂质气体,另外NH4NO3易爆炸;选碱时,用Ca(OH)2而不用NaOH或KOH,因为NaOH、KOH具有吸湿性,易结块,不利于产生氨,且在高温下均能腐蚀玻璃。
(2)干燥氨气不能用浓硫酸,也不能用无水CaCl2(8NH3+CaCl2===CaCl2·8NH3),通常用碱石灰干燥氨气。
(3)实验室制取NH3的简易方法
方法
化学方程式(或原理)
发生装置
加热浓氨水
NH3·H2ONH3↑+H2O
浓氨水+
固体NaOH
NaOH溶于水放热,促使NH3·H2O分解,且OH-浓度的增大有利于NH3的生成
浓氨水+
固体CaO
CaO与水反应,使溶剂(水)减少;反应放热,促使NH3·H2O分解。化学方程式:NH3·H2O+CaO===NH3↑+Ca(OH)2
喷泉实验的原理
3.(2019·南京师大附中检测)
利用如图所示的装置,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅱ中产生“喷泉”现象,烧瓶Ⅰ中不产生“喷泉”现象,其操作方法是________________________________________________________________________
________________________________________________________________________。
(2)若先打开a、c活塞,再挤压胶头滴管,在烧瓶中可观察到的现象是
________________________________________________________________________。
(3)通过挤压胶头滴管和控制活塞的开关,在烧瓶Ⅰ中产生“喷泉”现象,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是___________________________________________。
若要在该装置中产生双喷泉现象,其操作方法是______________________________
________________________________________________________________________。
解析:(1)打开a、b活塞,再将胶头滴管中的水挤入烧瓶Ⅱ中,由于NH3极易溶于水,使烧瓶内气体压强迅速减小,烧杯中的水迅速进入烧瓶Ⅱ中,形成喷泉。(2)先打开a、c活塞,再将胶头滴管中的水挤入烧瓶Ⅱ中,烧瓶Ⅱ中的气压迅速减小,烧瓶Ⅰ中的HCl气体会流向烧瓶Ⅱ中,且与NH3化合生成NH4Cl而产生白烟。(3)在(2)基础上,若关闭a活塞,打开b活塞,烧杯中的水会迅速进入烧瓶Ⅰ中,形成喷泉;若打开b活塞,不关闭a活塞,烧瓶中的水便会同时进入烧瓶Ⅰ和Ⅱ中,形成双喷泉。
答案:(1)先打开a、b活塞,再挤压胶头滴管(或先挤压胶头滴管,再打开a、b活塞)
(2)烧瓶Ⅱ中导管口处产生白烟
(3)先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,关闭a活塞,然后打开b活塞 先打开a、c活塞,再挤压胶头滴管(或先打开a活塞,挤压胶头滴管,再打开c活塞),片刻后,打开b活塞
4.(2017·全国卷Ⅰ节选)凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3===NH3·H3BO3;NH3·H3BO3+HCl===NH4Cl+H3BO3。
回答下列问题:
(1)a的作用是________________。
(2)b中放入少量碎瓷片的目的是_____________________________________________。
f的名称是________。
(3)清洗仪器:g中加蒸馏水;打开k1,关闭k2、k3,加热b,蒸气充满管路;停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是___________________________________________;
打开k2放掉水。重复操作2~3次。
解析:(1)导管a与大气相通,其作用是避免烧瓶内气压过大,发生危险。(2)加热液体时加入碎瓷片,其作用是防止液体暴沸。冷凝管有直形冷凝管和球形冷凝管、蛇形冷凝管,要指明。(3)停止加热,瓶内水蒸气冷凝,气体压强减小,会引起g中液体倒吸入c中,利用蒸馏水倒吸来洗涤仪器e、f。
答案:(1)避免b中压强过大 (2)防止暴沸 直形冷凝管
(3)c中温度下降,管路中形成负压
归纳拓展
1.喷泉实验的原理分析
(1)形成喷泉的原因
形成喷泉最根本的原因是烧瓶内外存在压强差。当烧瓶内气体溶于液体或与之反应时,瓶内气体大量减少,压强降低,外界的大气压将液体压入烧瓶内,如此持续,最后液体将充满烧瓶。
(2)影响喷泉实验成功的因素
①盛气体的烧瓶必须干燥。②气体要充满烧瓶。③烧瓶不能漏气(实验前应先检查装置的气密性)。④所用气体能大量溶于所用液体或气体与液体可以快速反应。
2.喷泉实验的发散装置及操作方法
喷泉实验是中学化学的重要实验,其本质是形成压强差而引发液体上喷,以教材中的装置(发散源)可设计如图所示的多种不同的装置和采用不同的操作(如使气体溶于水、热敷或冷敷、生成气体等)来形成喷泉。
设计说明:装置(Ⅰ)改变了胶头滴管的位置,胶头滴管挤入少量水于试剂瓶中,即可使少量溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。装置(Ⅱ)向导管中通入一定量的H2S和SO2,现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液上喷形成喷泉。装置(Ⅲ)打开①处的止水夹并向烧瓶中缓慢通入等体积的HCl气体后关闭该止水夹,等充分反应后再打开②处的止水夹,观察到先有白烟产生,后产生喷泉。装置(Ⅳ)挤压胶头滴管,然后打开导管上部的两个活塞,则在右面烧瓶出现喷烟现象,再打开导管下部活塞,则可产生双喷泉。
1.如图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。表中对实验现象所做的解释正确的是( )
选项
实验现象
解释
A
浓盐酸附近产生白烟
NH3与浓盐酸反应产生了NH4Cl固体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝
NH3是一种可溶性碱
解析:选A B项,NH3与浓硫酸反应;C项,AlCl3、MgCl2等氯化物溶液均可与NH3反应使溶液变浑浊;D项,NH3·H2O是碱,NH3不属于碱。
2.如图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
理清喷泉实验原理
烧瓶中气压减小,形成喷泉,类型是极易溶于水的气体,如NO2、NH3,或者气体与溶液极易反应,如Cl2~NaOH溶液,CO2~NaOH溶液。
解析:选B H2难溶于NaOH溶液,不能形成较大压强差,不能引发“喷泉”现象。
3.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列说法正确的是( )
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质都属于正盐
点拨:NH3中N的化合价为-3价,NO2中N的化合价为+4 价。
解析:选C NaHCO3不是化肥,故A错误;NH4Cl、HNO3受热时都易分解,Na2CO3性质稳定,受热不分解,故B错误;NH3和NO2中氮元素存在中间价态,一定条件下可发生氧化还原反应,故C正确;NaHCO3为酸式盐,故D错误。
4.下列说法中正确的是( )
A.所有铵盐受热均可以分解,产物均有NH3
B.硝酸铵受热易分解爆炸,实验室常用加热氯化铵与氢氧化钙的固体混合物制备氨气
C.在盛有硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液的试管中,滴加少量NaOH溶液,在试管口用湿润的红色石蕊试纸检验,试纸变蓝
D.铵盐都易溶于水,其水溶液均呈酸性
解析:选B 铵盐分解不一定产生NH3,如NH4NO3在400 ℃以上分解生成N2、NO2和H2O,A项错;Fe2+比NH更易结合OH-,因而加入少量NaOH,不会产生NH3,C项错;NH4HCO3、(NH4)2S溶液等均呈碱性,D项错。
5.NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为________。
(2)按如图装置进行NH3性质实验。
①先打开旋塞1,B瓶中的现象是____________________,原因是_____________________
_____________________________________________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是______________________________________________。
解析:(1)制备氨气时,加热固体的试管口应略向下倾斜,所以制备装置应选取装置A;氨气的密度比空气的小,因此应用向下排空气法收集,所以收集装置应选取装置C;氨气极易溶于水,应防止发生倒吸,因此尾气处理装置应选取装置G。(2)A瓶的压强大于B瓶的,因此A瓶中的氯化氢进入B瓶中,与氨气反应生成氯化铵,可以看到B瓶中有白烟生成。由于氯化氢和氨气反应导致B瓶中的压强降低,且B瓶中的氯化氢相对过量,因此当打开旋塞2时,石蕊水溶液会被倒吸入B瓶中,遇氯化氢溶液变红色。
答案:(1)A、C、G
(2)①有白烟生成 A瓶中的氯化氢移动到B瓶中,与B瓶中的氨气反应生成氯化铵,能看到白烟
②液体进入B瓶中,溶液的颜色变红
考点(三) 硝酸 【精讲精练快冲关】
[知能学通]
1.物理性质
硝酸是无色易挥发的液体,有刺激性气味。
2.化学性质
(1)不稳定性
反应的化学方程式:
4HNO32H2O+4NO2↑+O2↑。
(2)强氧化性
浓、稀硝酸均具有强氧化性,浓度越大,氧化性越强,其还原产物的价态越高。还原产物一般为HNO3(浓)―→NO2,HNO3(稀)―→NO。
与金属
反应
稀硝酸与铜反应的化学方程式:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
浓硝酸与铜反应的化学方程式:
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
与非金
属反应
浓硝酸与C反应的化学方程式:
C+4HNO3(浓)CO2↑+4NO2↑+2H2O
与还原
性化合
物反应
硝酸可氧化Fe2+、H2S、SO2、Na2SO3、HI等还原性物质。如稀硝酸与FeSO4溶液反应的离子方程式: 3Fe2++4H++NO===3Fe3++NO↑+2H2O
(3)与有机物反应
①硝化反应(与苯反应):
。
②颜色反应:含苯基的蛋白质遇到浓硝酸时变黄色。
3.硝酸工业制法的反应原理
(1)NH3在催化剂作用下与O2反应生成NO:
4NH3+5O24NO+6H2O。
(2)NO进一步氧化生成NO2:2NO+O2===2NO2。
(3)用水吸收NO2生成HNO3:
3NO2+H2O===2HNO3+NO。
[注意] ①硝酸与变价金属反应,金属被氧化为高价态。
②硝酸浓度越大,其还原产物的价态越高。还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO,很稀的硝酸还原产物也可能为N2O、N2或NH4NO3。
③硝酸与金属反应,体现硝酸的强氧化性和酸性,浓硝酸与非金属反应只体现氧化性。
④浓硝酸能使紫色石蕊溶液先变红,后褪色,该反应过程中浓硝酸表现出强酸性和强氧化性。
⑤在酸性条件下NO不能与Fe2+、I-、SO、S2-等还原性较强的离子大量共存。
⑥常温下,铁、铝遇浓硝酸能发生“钝化”,并非不反应,故浓硝酸可以用铁桶或铝桶盛放。
[题点练通]
硝酸的性质
1.判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)(2018·北京高考)热铜丝插入稀硝酸中,产生无色气体,随后变为红棕色,颜色变化与氧化还原反应无关( )
(2)(2016·全国卷Ⅰ)用向上排空气法收集铜粉与稀硝酸反应产生的NO( )
(3)(2016·全国卷Ⅰ)1 mol Fe溶于过量硝酸,电子转移数为2NA( )
(4)(2016·江苏高考)将铜丝插入稀硝酸中:Cu+4H++2NO===Cu2++2NO2↑+H2O( )
(5)(2016·海南高考)将铁屑放入稀HNO3中证明Fe比H2活泼( )
(6)(2015·全国卷Ⅱ)常温下,将浓硝酸滴加到用砂纸打磨过的铝条上,会产生红棕色气体( )
答案:(1)× (2)× (3)× (4)× (5)× (6)×
2.(2017·北京高考)下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
解析:选D ①中灼热碎玻璃起加热作用,浓硝酸受热分解生成红棕色NO2,硝酸中氮元素化合价降低,必有元素化合价升高,只能为氧元素,因此,还有O2生成,产生的气体为混合气体,A项正确;由①可知,浓硝酸受热分解可生成红棕色气体,所以②中产生的“红棕色气体”不一定是木炭与浓硝酸发生反应产生的,B项正确;③中浓硝酸挥发才能与红热木炭接触,产生的NO2是还原产物,C项正确;红热的木炭还可与空气中的O2反应生成CO2,不一定是木炭与浓硝酸发生反应生成了CO2,D项错误。
3.(2019·门头沟区模拟)室温下,某兴趣小组用如图装置在通风橱中进行如下实验:
实验
现象
试管Ⅰ中开始无现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色
试管Ⅱ中剧烈反应,迅速生成大量红棕色气体,溶液呈绿色;之后向绿色溶液中持续通入N2,溶液变为蓝色
下列说法正确的是( )
A.试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成
B.等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更多
C.换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D.试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
解析:选D 试管Ⅰ中浅红棕色气体为NO2,是由硝酸还原生成的NO与空气中O2反应生成,故A错误;依据Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O可知,等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更少,故B错误;换成Fe之后重复实验,铁与浓硝酸发生钝化生成致密氧化膜,阻止反应进行,故C错误;铜与浓硝酸反应生成红棕色NO2,试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2,持续通入N2后,溶液变为蓝色,是因为N2把NO2从溶液中带出,故D正确。
4.某化学兴趣小组设计了如图所示的浓HNO3 与Cu反应的微型实验。下列说法中错误的是( )
A.挤压塑料瓶使浓HNO3进入干燥管就可引发反应
B.将装置口向上竖起就可停止反应
C.蘸碱液的棉花可起到吸收NO2的作用
D.该装置适用于木炭与浓硝酸或浓硫酸的反应实验
解析:选D 挤压塑料瓶能使浓硝酸进入干燥管与铜接触,引发反应,故A正确;只需将装置口向上竖起,浓硝酸回流到塑料瓶,而铜片不能进入塑料瓶,可以停止反应,故B正确;二氧化氮与碱反应生成亚硝酸盐和硝酸盐,所以蘸碱液的棉花可起到吸收NO2的作用,故C正确;该装置适用于块状固体和液体反应,且不需要加热的气体的制备,而木炭与浓硫酸和浓硝酸都要加热才反应,故D错误。
5.(2019·尖山区模拟)在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3 ②Fe2O3 ③Cu(NO3)2 ④KNO3。铜粉溶解的是( )
A.只有①或② B.只有②或④
C.只有①或②或③ D.①②③④中任意一种
解析:选D ①Cu能和FeCl3反应生成FeCl2和CuCl2,所以Cu能在FeCl3溶液中溶解,正确; ②Fe2O3能与稀H2SO4反应:Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,Fe2(SO4)3能与铜粉反应:Fe2(SO4)3+Cu===2FeSO4+CuSO4,所以铜粉溶解,正确;③加入Cu(NO3)2后,溶液中含有H+和NO,所以相当于溶液中含有HNO3,HNO3能和Cu反应,3Cu+8H++2NO===3Cu2++2NO↑+4H2O,所以铜粉溶解,正确;④依据③的分析可知,加入KNO3,相当于加入NO,也与硫酸中的H+构成HNO3致使Cu溶解,正确。
硝酸与金属的反应
6.(2019·福州模拟)将19.2 g的铜和某浓度的硝酸反应,生成8.96 L(标准状况)的气体,则参加反应的硝酸为______mol,将这8.96 L的气体和标准状况下________L的氧气混合,再通入水中没有气体剩余。
解析:因N原子守恒,所以参加反应的硝酸n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=2n(Cu)+n(NO)+n(NO2)=×2+=1 mol;因产生的气体和氧气最终变为硝酸,在上述两个过程中只有两种元素铜、氧的化合价发生变化,根据电子得失守恒,则n(O2)×4=n(Cu)×2,即n(O2)=n(Cu)×=×=0.15 mol,体积为3.36 L。
答案:1 3.36
7.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是______________。
(3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为____________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水____________g。
解析:(1)n(Cu)==0.51 mol,设混合气体中NO的物质的量为x,NO2的物质的量为y。根据气体的总体积为11.2 L,有:x+y=0.5 mol。根据得失电子守恒,有:3x+y=(0.51×2)mol。解方程组得:x=0.26 mol,y=0.24 mol。则:V(NO)=0.26 mol×22.4 L·mol-1=5.824 L, V(NO2)=11.2 L-5.824 L=5.376 L。(2)参加反应的HNO3分两部分:一部分没有被还原,显酸性,生成Cu(NO3)2;另一部分被还原成NO2和NO,所以参加反应的HNO3的物质的量为0.51 mol×2+0.5 mol=1.52 mol。(3)HNO3在反应中一部分变成气体,一部分以NO的形式留在溶液中。变成气体的HNO3的物质的量为0.5 mol。加入NaOH溶液至正好使溶液中Cu2+全部转化为沉淀,则溶液中只有NaNO3,其物质的量为10-3aV mol,也就是以NO形式留在溶液中的HNO3的物质的量为10-3aV mol。所以,c(HNO3)= mol·L-1。(4)由得失电子守恒得:2×n(Cu)=2×n(H2O2),×2=n(H2O2)×2,n(H2O2)=0.51 mol,则m(H2O2)=17.34 g。需30%的双氧水:17.34 g÷30%=57.8 g。
答案:(1)5.824 5.376 (2)1.52 mol
(3) (4)57.8
硝酸与金属反应的计算方法
(1)原子守恒法
HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂,转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
(2)得失电子守恒法
HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得电子的物质的量等于金属失电子的物质的量。
(3)电荷守恒法
HNO3过量时反应后溶液中(不考虑OH-)有:
c(NO)=c(H+)+nc(Mn+)(Mn+代表金属离子)。
(4)离子方程式计算法
金属与H2SO4、HNO3的混合酸反应时,由于硝酸盐中NO在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO进行相关计算,且溶液中要符合电荷守恒。
考点(四) 磷及其化合物 【精讲精练快冲关】
[知能学通]
1.磷单质
(1)磷的同素异形体
白磷不溶于水,易溶于CS2,分子式为P4,为正四面体结构(),与红磷(赤磷)是同素异形体。
(2)单质磷的化学性质
①与氧气反应:P4+5O22P2O5(五氧化二磷)。
②与卤素单质反应:
P4+6Cl24PCl3(白雾),P4+10Cl24PCl5(白烟)。
③与稀硝酸反应:
3P+5HNO3+2H2O3H3PO4+5NO↑。
2.五氧化二磷和磷化氢
五氧化二磷是磷酸的酸酐,有很强的吸水性,是一种干燥剂。磷化氢的化学式为PH3,碱性比氨气弱得多,强还原剂。
3.磷酸
磷酸易溶于水、难挥发,属于三元非氧化性中强酸(可当作弱酸对待),具有酸的通性。
(1)电离方程式
H3PO4H++H2PO,H2POH++HPO,HPOH++PO。
(2)与碱反应
NaOH+H3PO4===NaH2PO4+H2O(生成磷酸二氢盐),
2NaOH+H3PO4===Na2HPO4+2H2O(生成磷酸氢盐),
3NaOH+H3PO4===Na3PO4+3H2O(生成正盐)。
[题点练通]
1.(2019·黄冈模拟)砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是( )
A.黄砷中共价键键能大于白磷
B.黄砷的熔点高于白磷
C.黄砷易溶于水
D.分子中共价键键角均为109.5°
解析:选B 原子半径:As>P,键长越大键能越小,则黄砷中共价键键能小于白磷,故A错误;相对分子质量越大,分子间作用力越强,熔点越高,则黄砷的熔点高于白磷,故B正确;黄砷为非极性分子,水为极性溶剂,根据相似相溶原理,黄砷不易溶于水,故C错误;P4、As4都为正四面体结构,As、P原子位于正四面体的顶点上,分子中共价键键角均为60°,故D错误。
2.PH3是一种无色剧毒气体。下列判断错误的是( )
A.PH3分子是非极性分子
B.PH3分子中有一对孤电子对
C.PH3分子形状为三角锥形
D.PH3分子稳定性低于 NH3分子
解析:选A PH3分子结构是三角锥形,正负电荷重心不重合,为极性分子,故A错误,C正确;PH3分子结构和 NH3相似,中心原子都含有一个孤电子对,故B正确;共价键键长越短,键能越大,分子越稳定,P的原子半径比N大,则N—H键键长更短、键能更高,所以PH3分子稳定性低于NH3分子,故D正确。
3.磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(1 550 ℃)下通过下面三个反应共熔得到。
a.4Ca3(PO4)2(s)+10C(s)===12CaO(s)+2P4(s)+10CO2(g)
b.CaO(s)+SiO2(s)===CaSiO3(s)
c.CO2(g)+C(s)===2CO(g)
已知:CaSiO3的熔点(1 546 ℃)比SiO2低。
①写出由Ca3(PO4)2、焦炭和SiO2在电炉中高温(1 550 ℃)制取白磷总的化学反应方程式________________________________________________________________________
________________________________________________________________________。
②白磷(P4)是正四面体结构,请画出白磷(P4)的结构式_____________,并指出1 mol白磷(P4)含有P—P键的数目_____________。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体____________(写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在_________之间 (已知磷酸的各级电离常数为K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 ,lg 7.1≈0.9 lg 6.3≈0.8 lg 4.2≈0.6)。Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是__________________________________________________(用离子方程式表示)。
解析:(1)①根据已知反应,结合热化学方程式和盖斯定律得到总反应的化学方程式为2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4+10CO。②白磷(P4)是正四面体结构,P—P间形成共价键,白磷(P4)的结构式为,1 mol白磷(P4)含有P—P键的数目为6NA。(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体,磷元素升高为次磷酸盐,磷元素化合价为+1价,降低的只能为负价,则为氢化物PH3。(3)为获得尽可能纯的NaH2PO4,需配制磷酸、磷酸二氢钠的缓冲溶液,当溶液全部为磷酸溶液时,磷酸以第一步电离为主,所以H3PO4H++H2PO K1=7.1×10-3;pH=-lg c(H+)=3-lg 7.1≈2.1,当溶液全部为NaH2PO4溶液时,H2POH++HPO K2=6.3×10-8,所以pH=-lg c(H+)=8-lg 6.3≈7.2,所以pH应控制介于2.1~7.2之间;HPO既能发生电离又能发生水解,电离反应式为HPOPO+H+,水解反应式为HPO+H2OH2PO+OH-,溶液呈碱性,说明水解程度大于电离程度;由于HPO和Ca2+反应生成沉淀:3Ca2++2HPO===Ca3(PO4)2↓+2H+,促进HPO的电离,溶液则显酸性。
答案:(1)①2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4+10CO
② 6NA
(2)PH3
(3)2.1~7.2 3Ca2++2HPO===Ca3(PO4 )2↓+2H+
考点(五) 常见无机物的转化关系 【多角探明无盲点】
无机推断题作为一种传统的高考题型,重点考查学生对元素及其化合物主干知识的掌握情况,题目结构紧凑,文字表述少,但转化关系中包含信息多,综合性强,难度较大。解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。
抓住“物质颜色”作为突破口
有色固体
①红色:Cu、Cu2O、Fe2O3;
②红褐色:Fe(OH)3;
③黄色:AgI;
④淡黄色:S、Na2O2、AgBr;
⑤蓝色:Cu(OH)2;
⑥黑色:炭粉、CuO、MnO2、FeS、CuS;
⑦紫黑色:KMnO4、I2;
⑧白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3
有色溶液
Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO(紫红色)、Fe3+遇 SCN-(血红色)、I2遇淀粉(蓝色)、Fe3+遇苯酚(紫色)等
有色气体
Cl2(黄绿色)、Br2(g)、NO2(红棕色)、I2(g)(紫色)、O3(淡蓝色)等
火焰颜色
①焰色反应:Na+(黄色)、K+(紫色,透过蓝色钴玻璃)等;
②蓝色:CO在空气中燃烧;
③淡蓝色:S、H2、CH4等在空气中燃烧;
④苍白色:H2在Cl2中燃烧
[对点练]
1.有一化合物X,其水溶液为浅绿色,可发生如图的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。
请回答下列问题:
(1)B的电子式为____________。
(2)画出元素M的原子结构示意图____________________________________________。
(3)物质X的化学式为____________。
(4)电解混合液时阳极反应式为________________________________________________。
(5)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应:___________________________________________________;
②含有L元素的置换反应:___________________________________________________。
解析:由颜色可知C为Fe(OH)3,则A为Fe(OH)2、H为Fe2O3,由M、L为常见的金属单质,可知M、L分别为Al、Fe;X与NaOH反应生成气体B,B一定是NH3;在混合液中加入BaCl2溶液有不溶于盐酸的沉淀生成,可知含有SO,所以X为(NH4)2Fe(SO4)2,混合液为NaOH和Na2SO4溶液,电解生成H2、O2,D、E分别为O2、H2,F为NO,G为HNO3。
答案:(1) (2)
(3)(NH4)2Fe(SO4)2
(4)4OH--4e-===O2↑+2H2O
(5)①4Fe(OH)2+O2+2H2O===4Fe(OH)3
②Fe2O3+2Al2Fe+Al2O3
抓住“物质特性”作为突破口
(1)能使品红溶液褪色的气体
SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)。
(2)沉淀发生特殊的颜色变化
Fe(OH)2Fe(OH)3(白色沉淀先变灰绿色,再变红褐色)。
(3)在空气中变为红棕色
NO(无色)NO2(红棕色)。
(4)能使澄清石灰水变浑浊的气体:CO2、SO2。
(5)通入CO2气体变浑浊的溶液:澄清石灰水(过量则变澄清)、Na2SiO3溶液、饱和Na2CO3溶液。
(6)使湿润的红色石蕊试纸变蓝的气体:NH3。
(7)使湿润的淀粉KI试纸变蓝的物质:NO2、Cl2、Br2、FeCl3等。
(8)常温下能溶解SiO2固体的物质:氢氟酸和NaOH溶液。
(9)烟雾现象
棕(黄)色的烟
Cu或Fe在Cl2中燃烧
白烟
Na在Cl2中燃烧;NH3遇到浓盐酸或浓硝酸
白雾
由HX等极易溶于水的气体产生
(10)钝化现象:常温下Fe、Al遇到浓硫酸或浓硝酸会生成一层致密的氧化膜,从而保护金属不再发生反应。
[对点练]
2.某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如图实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图______,写出气体甲的电子式____________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学反应方程式为________________________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_______________________________________________________
________________________________________________________________________,
并设计实验方案验证该反应的产物___________________________________________
________________________________________________________________________
________________________________________________________________________。
解析:从框图可知,气体甲为CO2;由溶液1转变为白色沉淀1,白色沉淀1又能溶解在CO2水溶液中,可推断白色沉淀1为CaCO3;从固体2的转化过程可知,白色沉淀2为Fe(OH)2,最终的红褐色沉淀为Fe(OH)3;由上述推断可初步确定X为含有Ca、Fe元素的碳酸盐,且其中铁元素的化合价为+2,故可推断其为CaFe(CO3)2,分解得到的固体1为CaO与FeO的混合物,应用题给数据可以进一步确认上述判断的正确性。(1)白色沉淀1中的金属元素为钙,其原子结构示意图为,气体甲为CO2,其电子式为。(2)X的化学式为CaFe(CO3)2;在惰性气流中加热X至完全分解的化学反应方程式为CaFe(CO3)2CaO+FeO+2CO2↑。(3)白色沉淀2在空气中变成红褐色沉淀是因为Fe(OH)2被氧化成Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3。(4)CO2气体与固体1中的FeO可能发生氧化还原反应,反应方程式为2FeO+CO2Fe2O3+CO;检验产物的方法:取反应所得固体物质,加稀盐酸溶解,然后加入KSCN溶液,若溶液呈红色,说明反应产物中有Fe(Ⅲ)。将生成的气体通过灼热CuO,若黑色固体变为红色,证明生成的气体中含有CO。
答案:(1)
(2)CaFe(CO3)2 CaFe(CO3)2CaO+FeO+2CO2↑
(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4)2FeO+CO2Fe2O3+CO 检测Fe2O3:将固体用稀盐酸溶解,加入KSCN溶液若显红色,表明产物中有Fe(Ⅲ);检测CO:将气体通过灼热CuO,黑色固体变为红色
抓住“特殊反应条件”作为突破口
反应条件
反应方程式
高温
①CaCO3CaO+CO2↑;
②SiO2+CaCO3CaSiO3+CO2↑;
③SiO2+Na2CO3Na2SiO3+CO2↑;
④SiO2+CaOCaSiO3;
⑤SiO2+2CSi+2CO↑;
⑥C+H2O(g)CO+H2;
⑦CO+H2O(g)CO2+H2;
⑧3Fe+4H2O(g)Fe3O4+4H2;
⑨2Al+Fe2O32Fe+Al2O3
高温、高压
和催化剂
N2+3H22NH3
加热、
催化剂
①4NH3+5O24NO+6H2O;
②2SO2+O22SO3
电解
①2NaCl+2H2O2NaOH+H2↑+Cl2↑;
②2H2O2H2↑+O2↑;
③2Al2O3(熔融)4Al+3O2↑
[对点练]
3.如图所示为A、B、C、D、E五种含氮物质之间的相互转化关系。
(1)写出各物质的化学式:
B_________,C_________,D_________,E_________。
(2)写出各步反应的化学方程式。
①D→C:____________________________________________________________。
②B→E:_____________________________________________________________。
③E→C:(写离子方程式)________________________________________。
解析:(1)A与氢气在高温、高压、催化剂作用下发生反应合成氨气,A为氮气,氮气在放电的条件下可以和氧气发生反应生成一氧化氮,一氧化氮能和氧气化合为红棕色的二氧化氮气体,氨气的催化氧化产物是一氧化氮和水,二氧化氮可以和水发生反应生成硝酸和一氧化氮,金属铜可以和稀硝酸发生反应生成硝酸铜、一氧化氮和水。所以A、B、C、D、E分别是N2、NO2、NO、NH3、HNO3。(2)①D→C是氨气的催化氧化,产物是一氧化氮和水,即4NH3+5O24NO+6H2O。②B→E是二氧化氮和水反应生成硝酸和一氧化氮,即3NO2+H2O===2HNO3+NO。③E→C是铜和稀硝酸反应生成一氧化氮、硝酸铜和水,反应的离子方程式为3Cu+8H++2NO===3Cu2++2NO↑+4H2O。
答案:(1)NO2 NO NH3 HNO3
(2)①4NH3+5O24NO+6H2O
②3NO2+H2O===2HNO3+NO
③3Cu+8H++2NO===3Cu2++2NO↑+4H2O
抓住“特殊数据”作为突破口
(1)常见10电子微粒及相互转化关系
分子
Ne、HF、H2O、NH3、CH4
阳离子
Na+、Mg2+、Al3+、NH、H3O+
阴离子
F-、O2-、N3-、OH-、NH
其相互转化关系为NH+OH-NH3↑+H2O;H3O++OH-===2H2O
(2)常见18电子微粒
分子
Ar、HCl、H2S、PH3、SiH4、H2O2、N2H4、F2
阳离子
K+、Ca2+
阴离子
Cl-、S2-、P3-、O
有机物
CH3OH、CH3NH2、CH3F、CH3CH3
(3)常见物质的相对分子质量
相对分子质量
物质
28
CO、N2、C2H4
26
C2H2
32
S、O2
78
Na2S、Na2O2、Al(OH)3
100
CaCO3、KHCO3、Mg3N2
[对点练]
4.如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是( )
A.常温下,单质a呈气态
B.单质c具有强氧化性
C.稳定性:d>e
D.f受热易分解为d和e
解析:选C a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,则b一定是H2。分子中所含原子个数:d>e,f为离子化合物,因此f一定是铵盐,则a是N2,c是F2,d是NH3,e是HF,f是NH4F。常温下N2是气体,A正确;F是最活泼的非金属元素,因此单质氟具有强氧化性,B正确;非金属性是F强于N元素,故氢化物稳定性是HF强于NH3,C不正确;铵盐受热易分解,因此NH4F受热分解生成NH3和HF,D正确。
抓住“特殊转化关系”作为突破口
(1)直线型转化关系
①金属碱性氧化物碱盐型,
满足此关系的有 K、Na、Ca、Ba等。
②非金属酸性氧化物酸盐型,
满足此关系的有C、N、S等。
③ABC(酸或碱)型,
满足此关系的有NH3、N2、S、H2S、C、Na等。
(2)交叉型转化关系
(3)三角型转化关系
(4)置换反应型反应关系
化合物A+单质B―→化合物C+单质D
这类反应主要有:
CO2+2Mg2MgO+C;
Fe2O3+3H22Fe+3H2O;
Fe+2HCl===FeCl2+H2↑;
C+H2O(g)CO+H2;
3Fe+4H2O(g)Fe3O4+4H2。
[对点练]
5.表中各组物质之间不可以通过一步反应实现如图所示转化关系的是( )
选项
X
Y
Z
箭头旁所标数字代表的反应条件
A
Na2O2
NaOH
NaCl
①常温遇水
B
Al2O3
NaAlO2
Al(OH)3
②通入CO2
C
NO
NO2
HNO3
④加入铜粉
D
Cl2
NaClO
HClO
③加浓盐酸
解析:选A 氯化钠不能通过一步反应得到过氧化钠,故A符合题意;氧化铝与氢氧化钠溶液反应生成偏铝酸钠,向偏铝酸钠溶液中通入二氧化碳,二者反应生成氢氧化铝,氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠,氢氧化铝受热分解生成氧化铝,各物质之间通过一步反应可以实现转化,故B不符合题意;一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,稀硝酸与铜反应生成一氧化氮,浓硝酸与铜反应生成二氧化氮,各物质之间通过一步反应可以实现转化,故C不符合题意;氯气与氢氧化钠溶液反应生成次氯酸钠,次氯酸钠与碳酸反应生成次氯酸,次氯酸与氢氧化钠溶液反应生成次氯酸钠,次氯酸与浓盐酸反应生成氯气,各物质之间通过一步反应可以实现转化,故D不符合题意。
相关资料
更多








