
还剩15页未读,
继续阅读
所属成套资源:2020高考苏教版化学一轮复习讲义(部分缺失)
成套系列资料,整套一键下载
2020版新一线高考化学(苏教版)一轮复习讲义:第1部分专题6第2单元原电池化学电源
展开
第二单元 原电池 化学电源
考纲定位
核心素养
1.理解原电池的构成、工作原理及应用,能写出电极反应和总反应方程式。
2.了解常见化学电源的种类及其工作原理。
1.变化观念——认识原电池的本质是氧化还原反应。能多角度、动态地分析原电池中物质的变化及能量的转换。
2.模型认知——能利用典型的原电池装置,分析原电池原理,建立解答原电池问题的思维模型,并利用模型揭示其本质及规律。
3.科学态度——探究新型化学电源及绿色环保化学电源,并评价化学电源的优劣。
考点一| 原电池及其工作原理
1.概念
原电池是把化学能转化为电能的装置。
2.构成条件
反应
能发生自发进行的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)
电极
一般是活泼性不同的两电极(金属或石墨)
闭合
回路
①电解质溶液
②两电极直接或间接接触
③两电极插入电解质溶液中
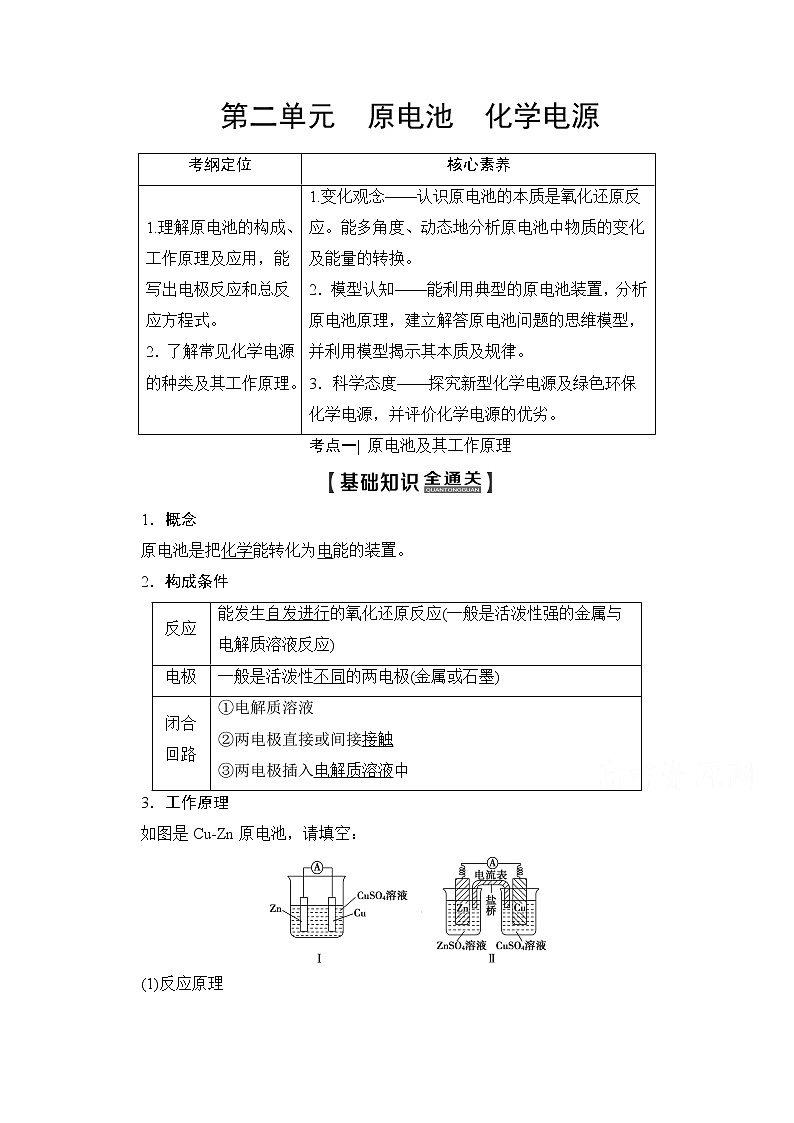
3.工作原理
如图是CuZn原电池,请填空:
(1)反应原理
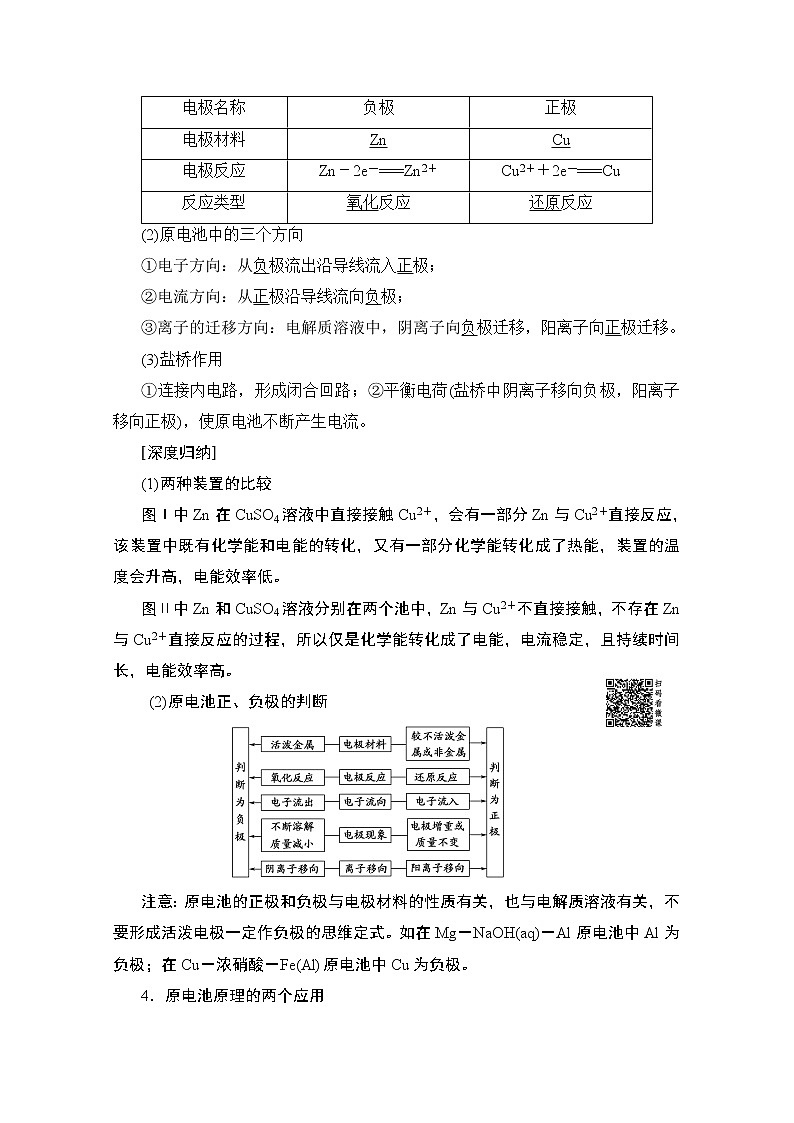
电极名称
负极
正极
电极材料
Zn
Cu
电极反应
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
氧化反应
还原反应
(2)原电池中的三个方向
①电子方向:从负极流出沿导线流入正极;
②电流方向:从正极沿导线流向负极;
③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)盐桥作用
①连接内电路,形成闭合回路;②平衡电荷(盐桥中阴离子移向负极,阳离子移向正极),使原电池不断产生电流。
[深度归纳]
(1)两种装置的比较
图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高,电能效率低。
图Ⅱ中Zn和CuSO4溶液分别在两个池中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长,电能效率高。
(2)原电池正、负极的判断
注意:原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼电极一定作负极的思维定式。如在Mg-NaOH(aq)-Al原电池中Al为负极;在Cu-浓硝酸-Fe(Al)原电池中Cu为负极。
4.原电池原理的两个应用
(1)比较金属活动性强弱
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(2)加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反应速率加快。例如,在Zn与稀硫酸反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
1.正误判断(正确的打“√”,错误的打“×”)
(1)在化学反应中,所有自发的放热反应均可以设计成原电池。( )
(2)在Mg-NaOH(aq)-Al电池中负极反应为Al-3e-+4OH-===AlO+2H2O。( )
(3)相同情况下,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长。 ( )
(4)原电池反应时,电子从负极流出经导线流入正极,然后通过溶液流回负极。( )
答案:(1)× (2)√ (3)√ (4)×
2.在如图所示的5个装置中,不能形成原电池的是____________(填序号)。
③装置发生的电极反应式为________________________________
_______________________________________________________。
答案:②④ 负极:Fe-2e-===Fe2+,正极:2H++2e-===H2↑
考法1 原电池的原理
1.(2018·潍坊一模)根据光合作用原理,设计如图原电池装置。下列说法正确的是( )
A.a电极为原电池的正极
B.外电路电流方向是a→b
C.b电极的电极反应式为O2+2e-+2H+===H2O2
D.a电极上每生成1 mol O2,通过质子交换膜的H+为2 mol
C [根据图示可知,a电极上H2O转化为H+和O2,发生氧化反应,则a电极为原电池的负极,A项错误;a电极为负极,b电极为正极,外电路电流方向应从正极到负极,即b→a,B项错误;根据图示可知,b电极上O2得电子转化为H2O2,电极反应式为O2+2e-+2H+===H2O2,C项正确;a电极上每生成1 mol O2,转移4 mol电子,则通过质子交换膜的
H+为4 mol,D项错误。]
2.(2019·厦门模拟)将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。
下列说法不正确的是 ( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
D [A项,甲池中石墨电极为正极,乙池中石墨电极为负极,盐桥中阳离子向正极移动,所以向FeCl3溶液迁移,正确;B项,反应开始时,乙中I-失去电子,发生氧化反应,正确;C项,当电流计读数为零时,说明没有电子发生转移,反应达到平衡,正确;D项,当加入
Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,错误。]
考法2 原电池原理的应用
3.M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是 ( )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
A [由①知,金属活动性:M>N;M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出,说明M作原电池的正极,故金属活动性:P>M;N、E构成的原电池中,N作负极,故金属活动性:N>E。]
4.设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)负极反应式:_________________________________________。
(2)正极反应式:_________________________________________。
(3)电池总反应方程式:___________________________________。
(4)在框中画出装置图,指出电极材料和电解质溶液:
①不含盐桥
②含盐桥
答案:(1)Cu-2e-===Cu2+
(2)2Fe3++2e-===2Fe2+
(3)2Fe3++Cu===2Fe2++Cu2+
(4)① ②
(1)正、负极材料的选择:根据氧化还原关系找出正、负极材料,一般选择活泼性较强的金属作为负极;活泼性较弱的金属或可导电的非金属(如石墨等)作为正极。
(2)电解质溶液的选择:电解质溶液一般要能够与负极发生反应,或者电解质溶液中溶解的其他物质能与负极发生反应(如溶解于溶液中的空气)。但如果氧化反应和还原反应分别在两个容器中进行(中间连接盐桥),则两个容器中的电解质溶液选择与电极材料相同的阳离子。
(3)画装置图:注明电极材料与电解质溶液。但应注意盐桥不能画成导线,要形成闭合回路。
考点二| 常见化学电源的分类及其工作原理
一次电池
1.银锌钮扣电池
银锌钮扣电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极反应如下:
负极:Zn+2OH--2e-===Zn(OH)2
正极:Ag2O+H2O+2e-===2Ag+2OH-
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
2.碱性锌锰电池
碱性锌锰电池的负极是Zn,正极是MnO2,电解质是KOH,其电极反应如下:
负极:Zn+2OH--2e-===Zn(OH)2
正极:2MnO2+2H2O+2e-===2MnOOH+2OH-
总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
二次电池
铅蓄电池
总反应式为
Pb+PbO2+2H2SO42PbSO4+2H2O
提醒:(1)二次电池充电时的电极连接
即正极接正极,负极接负极。
(2)充电时的电极反应与放电时的电极反应过程相反,充电时的阳极反应与放电时的正极反应相反,充电时的阴极反应与放电时的负极反应相反。
燃料电池
燃料电池中的常见燃料有氢气、烃(CH4、C2H6)、烃的衍生物(甲醇、乙醇)、CO、金属(Al、Li等),燃料在电池中的负极发生反应。
1.氢氧燃料电池
介质
酸性
碱性
负极反应式
2H2-4e-===4H+
2H2+4OH--4e-===4H2O
正极反应式
O2+4H++4e-===2H2O
O2+2H2O+4e-===4OH-
电池总反应式
2H2+O2===2H2O
注:①燃料电池的电极不参加电极反应,通入的燃料发生负极反应,O2发生正极反应。
②书写电极反应式时,注意介质参与的反应。
[深度归纳] 化学电源中电极反应书写的一般方法思路
(1)明确两极的反应物;
(2)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物;
(3)确定最终产物:根据介质环境和共存原则,找出参与的介质粒子,确定最终产物;
(4)配平:根据电荷守恒、原子守恒配平电极反应式。
注意:①H+在碱性环境中不存在;②O2-在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境结合H2O,生成OH-;③若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
2.以甲醇为燃料,写出下列介质中的电极反应和总反应
(3)固体氧化物(O2-可移动
1.正误判断(正确的打“√”,错误的打“×”)
(1)太阳能电池不属于原电池。( )
(2)碱性锌锰电池的负极附近的介质的碱性增强。( )
(3)铅蓄电池的两极在电池工作时质量均增加。( )
(4)氢氧燃料电池的正极反应式均为O2+4e-+4H+===2H2O。( )
答案:(1)√ (2)× (3)√ (4)×
2.CO为燃料,O2为氧化剂,碱性溶液作电解质溶液,电池工作时负极反应式为________________,正极反应式为________________,总反应式为___________________________________________________。
答案:CO-2e-+4OH-===CO+2H2O O2+2e-+H2O===
2OH- 2CO+O2+4OH-===2CO+2H2O
考法1 一次电池与二次电极
1.(2019·兰州模拟)被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当0.1 mol Zn完全溶解时,流经电解液的电子个数约为
1.204×1023
D.电池正极反应式为MnO2+e-+H2O===MnOOH+OH-
D [A项,由电池反应知,Zn元素化合价由0变为+2,Zn失电子作负极,错误;B项,该电池中二氧化锰参加反应且作氧化剂,错误;C项,电子不进入电解质溶液,电解质溶液导电是通过离子定向移动形成电流,错误;D项,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O===MnOOH+OH-,正确。]
2.(2019·湖南湘东五校联考)高铁电池具有比能量高、无污染的特点,用如图装置模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )
A.放电时,电子由正极通过外电路流向负极
B.放电时,负极上的电极反应式为Zn-2e-+2H2O===Zn(OH)2+2H+
C.充电时,电源的正极连接高铁电池的Zn极
D.充电时,阳极上的电极反应式为Fe(OH)3-3e-+5OH-===FeO+4H2O
D [放电时,电子由负极通过外电路流向正极,A项错误;放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2,B项错误;充电时,电源的正极应连接石墨电极,C项错误;充电时,阳极上Fe(OH)3转化为FeO,发生氧化反应:Fe(OH)3-3e-+5OH-===FeO+4H2O,D项正确。]
3.(2019·郑州模拟)如图是一种正投入生产的大型蓄电系统。放电前被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
A.放电时,负极反应为3NaBr-2e-===NaBr3+2Na+
B.充电时,阳极反应为2Na2S2-2e-===Na2S4+2Na+
C.放电时,Na+经过离子交换膜,由b池移向a池
D.用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40 g Na2S4
C [根据放电后Na2S2转化为Na2S4,S元素化合价升高,知Na2S2被氧化,故负极反应为2Na2S2-2e-===Na2S4+2Na+,A项错误;充电时阳极上发生氧化反应,NaBr转化为NaBr3,电极反应为3NaBr-2e-===NaBr3+2Na+,B项错误;放电时,阳离子向正极移动,故Na+经过离子交换膜,由b池移向a池,C项正确;放电时b池为负极区域,发生氧化反应:2Na2S2-2e-===Na2S4+2Na+,用该电池电解饱和食盐水,产生标准状况下2.24 L H2时转移0.2 mol电子,生成0.1 mol Na2S4,其质量为17.40 g,D项错误。]
考法2 形形色色的燃料电池
4.(2019·哈尔滨模拟)新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
A.电极B材料中含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应:BH+8OH--8e-===BO+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1 L 6 mol·L-1 H2O2溶液,理论上流过电路中的电子数为6NA
B [A项,电极B采用MnO2,为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,错误;B项,负极发生氧化反应,电极反应式为BH+8OH--8e-===BO+6H2O,正确;C项,放电时,Na+向正极移动,错误;D项,在电池反应中,每消耗1 L 6 mol·L-1 H2O2溶液,理论上流过电路中的电子数为
6 mol·L-1×1 L×2×NA/mol=12NA,错误。]
5.(2019·西安八校联考)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( )
A.HS-在硫氧化菌作用下转化为SO的反应为HS-+4H2O-8e-===SO+9H+
B.电子从电极b流出,经外电路流向电极a
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4 mol电子发生转移,则有0.5 mol H+通过质子交换膜
A [本题中微生物燃料电池的工作原理包括两个阶段:①引发反应,有机物+SOCO2↑+HS-;②电池反应,负极反应为HS-+4H2O-8e-===SO+9H+,正极反应为2O2+8H++8e-===4
H2O。根据题图知,在硫氧化菌作用下HS-转化为SO,发生氧化反应:HS-+4H2O-8e-===SO+9H+,A项正确;电子从电极a流出,经外电路流向电极b,B项错误;如果将反应物直接燃烧,有部分化学能转化为热能和光能,能量的利用率降低,C项错误;若该电池电路中有0.4 mol电子发生转移,则有0.4 mol H+通过质子交换膜,D项错误。]
6.(2019·贵阳模拟)一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )
A.b电极是负极
B.a电极的电极反应式:N2H4+4OH-+4e-===N2↑+4H2O
C.放电时,电子从a电极经过负载流向b电极
D.电池工作时,K+从正极移向负极
C [燃料电池中正极上通入空气,故b电极为正极,A项错误;a电极为负极,负极上N2H4发生氧化反应:N2H4-4e-+4OH-===N2↑+4H2O,B项错误;放电时,电子从负极(a电极)经过负载流向正极(b电极),C项正确;该装置交换膜为阴离子交换膜,电池工作时,OH-从正极移向负极,D项错误。]
(1)首先写出正极反应式
①酸性电解质溶液环境下电极反应式:
O2+4H++4e-===2H2O;
②碱性电解质溶液环境下电极反应式:
O2+2H2O+4e-===4OH-;
③固体氧化物电解质(高温下能传导O2-)环境下电极反应式:O2+4e-===2O2-;
④熔融碳酸盐(如熔融K2CO3)环境下电极反应式:
O2+2CO2+4e-===2CO。
(2)根据总反应式减去正极反应式确定负极反应式。
专项突破(十三) 新型化学电源试题的解答突破
1.命题分析
命题人常常根据新型化学电池的装置特点,以新介质、新燃料、轻金属为背景,涉及下列命题角度。
(1)电极的判断及其电极反应式的书写或判断。
(2)两极产物及两极反应类型的判断。
(3)两极附近溶液的pH变化或计算。
(4)电子、电流、离子移动方向,交换膜的判断。
(5)电子守恒的相关计算。
2.常考新型电源的原理分析
(1)镍氢电池(KOH溶液):NiOOH+MHNi(OH)2+M
负极反应式:MH-e-+OH-===M+H2O;
正极反应式:NiOOH+e-+H2O===Ni(OH)2+OH-。
(2)锂离子电池总反应式为xLi+Li1-xMn2O4LiMn2O4
负极反应式:xLi-xe-===xLi+;
正极反应式:Li1-xMn2O4+xe-+xLi+===LiMn2O4。
(3)研究人员研制出一种可快速充放电的超性能铝离子电池,Al、Cn为电极,有机阳离子与阴离子(AlCl、Al2Cl)组成的离子液体为电解质,如图为该电池放电过程示意图。
负极反应式:Al-3e-+7AlCl===4Al2Cl;
正极反应式:3Cn[AlCl4]+3e-===3Cn+3AlCl。
[典例导航]
(2017·全国卷Ⅲ,T11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+xS8===8Li2Sx(2≤x≤8)。下列说法错误的是( )
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
[思路点拨] (1)16Li+xS8===8Li2Sx(2≤x≤8)
⇓
Li作负极,电极反应式为16Li-16e-===16Li+
S8作正极,电极反应式为xS8+16e-+16Li+===8Li2Sx
⇓放电时
电极a作正极,放电时间越长,Li2Sx中x越小
⇓充电时
电极a作阳极,充电时间越长,Li2Sx中x越大
(2)负极Li生成Li+移向正极,减重×7 g·mol-1=0.14 g
答案:D
(1)放电时负极反应式为______________,正极反应式(当x=6时)为___________,放电过程中Li2S8―→Li2S6的正极反应式为__________。
(2)充电时,阳极反应式(Li2S2―→Li2S4)____________________。
答案:(1)Li-e-===Li+ 6S8+16e-+16Li+===8Li2S6 3Li2S8+2e-+2Li+===4Li2S6
(2)2Li2S2-2e-===Li2S4+2Li+
[综合体验]
1.(2019·山西八校联考)硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时发生的反应为4VB2+11O2===4B2O3+2V2O5。下列说法不正确的是( )
A.电极a为电池正极
B.图中选择性透过膜为阴离子透过膜
C.电池工作过程中,电极a附近区域pH减小
D.VB2极发生的电极反应为2VB2+22OH--22e-===V2O5+2B2O3+11H2O
C [根据电池反应,O2发生还原反应,故通入空气的电极a为正极,电极反应式为O2+2H2O+4e-===4OH-,A项正确;根据电池反应,VB2发生氧化反应转化为V2O5、B2O3,VB2极的电极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O,D项正确;根据负极反应和正极反应可知,正极上生成OH-,负极上消耗OH-,故该选择性透过膜为阴离子透过膜,B项正确;由正极反应式可知,电池工作过程中,电极a附近c(OH-)增大,pH增大,C项错误。]
2.(2019·石家庄联考)某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应式为Li1-xCoO2+LixC6
===LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Co元素的化合价升高
B.放电时,正极的电极反应式为Li1-xCoO2+xe-+xLi+===LiCoO2
C.充电时,Li+在电解液中由阳极向阴极迁移
D.充电时,阴极的电极反应式为C6+xLi++xe-===LixC6
A [由放电时电池的总反应式可知,放电时Co的化合价降低,A项错误;放电时正极的电极反应式为Li1-xCoO2+xe-+xLi+===LiCoO2,B项正确;充电时阳离子由阳极向阴极迁移,C项正确;充电时阴极反应与放电时负极反应互为逆反应,阴极反应式为C6+xLi++xe-===LixC6,D项正确。]
3.(2019·日照质检)一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。
下列说法不正确的是( )
A.放电时,Mg(液)层的质量减小
B.放电时,正极反应为Mg2++2e-===Mg
C.该电池充电时,Mg-Sb(液)层发生还原反应
D.该电池充电时,Cl-向下层移动
C [根据电流方向(由正极流向负极)可知,镁(液)层为原电池的负极,放电时,Mg(液)层的质量减小,A项正确;根据题意知,正极反应为熔融的Mg2+得电子发生还原反应,电极反应式为Mg2++2e-===
Mg,B项正确;充电时镁(液)层为阴极,Mg-Sb(液)层为阳极,则Mg-Sb(液)层发生氧化反应,C项错误;充电时阴离子向阳极移动,即Cl-向下层移动,D项正确。]
课堂反馈 真题体验
1.(2018·全国卷Ⅱ,T12)我国科学家研发了一种室温下“可呼吸”的NaCO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2Na2CO3+C。下列说法错误的是 ( )
A.放电时,ClO向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-===2CO+C
D.充电时,正极反应为Na++e-===Na
D [结合总反应式和题图可知,该电池放电时Na为负极,Ni为正极。NaCO2二次电池放电时为原电池,充电时为电解池。
电池放电时,ClO向负极移动,A项正确;结合总反应可知放电时需吸收CO2,而充电时释放出CO2,B项正确;放电时,正极CO2得电子被还原生成单质C,即电极反应式为3CO2+4e-===2CO+C,C项正确;充电时阳极发生氧化反应,即C被氧化生成CO2,D项错误。]
2.(2018·全国卷Ⅲ,T11)一种可充电锂—空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向多孔碳材料区迁移
D.充电时,电池总反应为Li2O2-x===2Li+O2
D [根据电池工作原理,多孔碳材料吸附O2,O2在此获得电子,所以多孔碳材料电极为电池的正极,A项错误;放电时电子从负极(锂电极)流出,通过外电路流向正极(多孔碳材料电极),B项错误;Li+带正电荷,充电时,应该向电解池的阴极(锂电极)迁移,C项错误;充电时,电池总反应为===2Li+O2,D项正确。]
3.(2016·全国卷Ⅱ,T11)MgAgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-===Mg2+
B.正极反应式为Ag++e-===Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
B [根据题意,Mg海水AgCl电池总反应式为Mg+2AgCl===MgCl2+2Ag。A项,负极反应式为Mg-2e-===Mg2+,正确;B项,正极反应式为2AgCl+2e-===2Cl-+ 2Ag,错误;C
项,对原电池来说,阴离子由正极移向负极,正确;D项,由于镁是活泼金属,则负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑,正确。]
4.(2015·全国卷Ⅰ,T11)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
A [图示所给出的是原电池装置。A.有氧气反应的一极为正极,发生还原反应,因为有质子通过,故正极电极反应式为O2+4e-+4H+===2H2O,C6H12O6在微生物的作用下发生氧化反应,电极反应式为C6H12O6-24e-+6H2O===6CO2+24H+,负极上有CO2产生,故A不正确。B.微生物电池是指在微生物作用下将化学能转化为电能的装置,所以微生物促进了反应中电子的转移,故B正确。C.质子是阳离子,阳离子由负极区移向正极区,故C正确。D.正极的电极反应式为6O2+24e-+24H+===12H2O,负极的电极反应式为C6H12O6-24e-+6H2O===6CO2+24H+,两式相加得电池总反应为C6H12O6+6O2===6CO2+6H2O,故D正确。]
第二单元 原电池 化学电源
考纲定位
核心素养
1.理解原电池的构成、工作原理及应用,能写出电极反应和总反应方程式。
2.了解常见化学电源的种类及其工作原理。
1.变化观念——认识原电池的本质是氧化还原反应。能多角度、动态地分析原电池中物质的变化及能量的转换。
2.模型认知——能利用典型的原电池装置,分析原电池原理,建立解答原电池问题的思维模型,并利用模型揭示其本质及规律。
3.科学态度——探究新型化学电源及绿色环保化学电源,并评价化学电源的优劣。
考点一| 原电池及其工作原理
1.概念
原电池是把化学能转化为电能的装置。
2.构成条件
反应
能发生自发进行的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)
电极
一般是活泼性不同的两电极(金属或石墨)
闭合
回路
①电解质溶液
②两电极直接或间接接触
③两电极插入电解质溶液中
3.工作原理
如图是CuZn原电池,请填空:
(1)反应原理
电极名称
负极
正极
电极材料
Zn
Cu
电极反应
Zn-2e-===Zn2+
Cu2++2e-===Cu
反应类型
氧化反应
还原反应
(2)原电池中的三个方向
①电子方向:从负极流出沿导线流入正极;
②电流方向:从正极沿导线流向负极;
③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)盐桥作用
①连接内电路,形成闭合回路;②平衡电荷(盐桥中阴离子移向负极,阳离子移向正极),使原电池不断产生电流。
[深度归纳]
(1)两种装置的比较
图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高,电能效率低。
图Ⅱ中Zn和CuSO4溶液分别在两个池中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长,电能效率高。
(2)原电池正、负极的判断
注意:原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼电极一定作负极的思维定式。如在Mg-NaOH(aq)-Al原电池中Al为负极;在Cu-浓硝酸-Fe(Al)原电池中Cu为负极。
4.原电池原理的两个应用
(1)比较金属活动性强弱
两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(2)加快氧化还原反应的速率
一个自发进行的氧化还原反应,设计成原电池时反应速率加快。例如,在Zn与稀硫酸反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
1.正误判断(正确的打“√”,错误的打“×”)
(1)在化学反应中,所有自发的放热反应均可以设计成原电池。( )
(2)在Mg-NaOH(aq)-Al电池中负极反应为Al-3e-+4OH-===AlO+2H2O。( )
(3)相同情况下,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长。 ( )
(4)原电池反应时,电子从负极流出经导线流入正极,然后通过溶液流回负极。( )
答案:(1)× (2)√ (3)√ (4)×
2.在如图所示的5个装置中,不能形成原电池的是____________(填序号)。
③装置发生的电极反应式为________________________________
_______________________________________________________。
答案:②④ 负极:Fe-2e-===Fe2+,正极:2H++2e-===H2↑
考法1 原电池的原理
1.(2018·潍坊一模)根据光合作用原理,设计如图原电池装置。下列说法正确的是( )
A.a电极为原电池的正极
B.外电路电流方向是a→b
C.b电极的电极反应式为O2+2e-+2H+===H2O2
D.a电极上每生成1 mol O2,通过质子交换膜的H+为2 mol
C [根据图示可知,a电极上H2O转化为H+和O2,发生氧化反应,则a电极为原电池的负极,A项错误;a电极为负极,b电极为正极,外电路电流方向应从正极到负极,即b→a,B项错误;根据图示可知,b电极上O2得电子转化为H2O2,电极反应式为O2+2e-+2H+===H2O2,C项正确;a电极上每生成1 mol O2,转移4 mol电子,则通过质子交换膜的
H+为4 mol,D项错误。]
2.(2019·厦门模拟)将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。
下列说法不正确的是 ( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
D [A项,甲池中石墨电极为正极,乙池中石墨电极为负极,盐桥中阳离子向正极移动,所以向FeCl3溶液迁移,正确;B项,反应开始时,乙中I-失去电子,发生氧化反应,正确;C项,当电流计读数为零时,说明没有电子发生转移,反应达到平衡,正确;D项,当加入
Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,错误。]
考法2 原电池原理的应用
3.M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。则这四种金属的还原性由强到弱的顺序是 ( )
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
A [由①知,金属活动性:M>N;M、P用导线连接放入NaHSO4溶液中,M表面有大量气泡逸出,说明M作原电池的正极,故金属活动性:P>M;N、E构成的原电池中,N作负极,故金属活动性:N>E。]
4.设计原电池装置证明Fe3+的氧化性比Cu2+强。
(1)负极反应式:_________________________________________。
(2)正极反应式:_________________________________________。
(3)电池总反应方程式:___________________________________。
(4)在框中画出装置图,指出电极材料和电解质溶液:
①不含盐桥
②含盐桥
答案:(1)Cu-2e-===Cu2+
(2)2Fe3++2e-===2Fe2+
(3)2Fe3++Cu===2Fe2++Cu2+
(4)① ②
(1)正、负极材料的选择:根据氧化还原关系找出正、负极材料,一般选择活泼性较强的金属作为负极;活泼性较弱的金属或可导电的非金属(如石墨等)作为正极。
(2)电解质溶液的选择:电解质溶液一般要能够与负极发生反应,或者电解质溶液中溶解的其他物质能与负极发生反应(如溶解于溶液中的空气)。但如果氧化反应和还原反应分别在两个容器中进行(中间连接盐桥),则两个容器中的电解质溶液选择与电极材料相同的阳离子。
(3)画装置图:注明电极材料与电解质溶液。但应注意盐桥不能画成导线,要形成闭合回路。
考点二| 常见化学电源的分类及其工作原理
一次电池
1.银锌钮扣电池
银锌钮扣电池的负极是Zn,正极是Ag2O,电解质是KOH,其电极反应如下:
负极:Zn+2OH--2e-===Zn(OH)2
正极:Ag2O+H2O+2e-===2Ag+2OH-
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
2.碱性锌锰电池
碱性锌锰电池的负极是Zn,正极是MnO2,电解质是KOH,其电极反应如下:
负极:Zn+2OH--2e-===Zn(OH)2
正极:2MnO2+2H2O+2e-===2MnOOH+2OH-
总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
二次电池
铅蓄电池
总反应式为
Pb+PbO2+2H2SO42PbSO4+2H2O
提醒:(1)二次电池充电时的电极连接
即正极接正极,负极接负极。
(2)充电时的电极反应与放电时的电极反应过程相反,充电时的阳极反应与放电时的正极反应相反,充电时的阴极反应与放电时的负极反应相反。
燃料电池
燃料电池中的常见燃料有氢气、烃(CH4、C2H6)、烃的衍生物(甲醇、乙醇)、CO、金属(Al、Li等),燃料在电池中的负极发生反应。
1.氢氧燃料电池
介质
酸性
碱性
负极反应式
2H2-4e-===4H+
2H2+4OH--4e-===4H2O
正极反应式
O2+4H++4e-===2H2O
O2+2H2O+4e-===4OH-
电池总反应式
2H2+O2===2H2O
注:①燃料电池的电极不参加电极反应,通入的燃料发生负极反应,O2发生正极反应。
②书写电极反应式时,注意介质参与的反应。
[深度归纳] 化学电源中电极反应书写的一般方法思路
(1)明确两极的反应物;
(2)明确直接产物:根据负极氧化、正极还原,明确两极的直接产物;
(3)确定最终产物:根据介质环境和共存原则,找出参与的介质粒子,确定最终产物;
(4)配平:根据电荷守恒、原子守恒配平电极反应式。
注意:①H+在碱性环境中不存在;②O2-在水溶液中不存在,在酸性环境中结合H+,生成H2O,在中性或碱性环境结合H2O,生成OH-;③若已知总反应式时,可先写出较易书写的一极的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的一极的电极反应式,即得到较难写出的另一极的电极反应式。
2.以甲醇为燃料,写出下列介质中的电极反应和总反应
(3)固体氧化物(O2-可移动
1.正误判断(正确的打“√”,错误的打“×”)
(1)太阳能电池不属于原电池。( )
(2)碱性锌锰电池的负极附近的介质的碱性增强。( )
(3)铅蓄电池的两极在电池工作时质量均增加。( )
(4)氢氧燃料电池的正极反应式均为O2+4e-+4H+===2H2O。( )
答案:(1)√ (2)× (3)√ (4)×
2.CO为燃料,O2为氧化剂,碱性溶液作电解质溶液,电池工作时负极反应式为________________,正极反应式为________________,总反应式为___________________________________________________。
答案:CO-2e-+4OH-===CO+2H2O O2+2e-+H2O===
2OH- 2CO+O2+4OH-===2CO+2H2O
考法1 一次电池与二次电极
1.(2019·兰州模拟)被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O===ZnO+2MnOOH。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当0.1 mol Zn完全溶解时,流经电解液的电子个数约为
1.204×1023
D.电池正极反应式为MnO2+e-+H2O===MnOOH+OH-
D [A项,由电池反应知,Zn元素化合价由0变为+2,Zn失电子作负极,错误;B项,该电池中二氧化锰参加反应且作氧化剂,错误;C项,电子不进入电解质溶液,电解质溶液导电是通过离子定向移动形成电流,错误;D项,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O===MnOOH+OH-,正确。]
2.(2019·湖南湘东五校联考)高铁电池具有比能量高、无污染的特点,用如图装置模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )
A.放电时,电子由正极通过外电路流向负极
B.放电时,负极上的电极反应式为Zn-2e-+2H2O===Zn(OH)2+2H+
C.充电时,电源的正极连接高铁电池的Zn极
D.充电时,阳极上的电极反应式为Fe(OH)3-3e-+5OH-===FeO+4H2O
D [放电时,电子由负极通过外电路流向正极,A项错误;放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2,B项错误;充电时,电源的正极应连接石墨电极,C项错误;充电时,阳极上Fe(OH)3转化为FeO,发生氧化反应:Fe(OH)3-3e-+5OH-===FeO+4H2O,D项正确。]
3.(2019·郑州模拟)如图是一种正投入生产的大型蓄电系统。放电前被膜隔开的电解质为Na2S2和NaBr3,放电后分别变为Na2S4和NaBr。下列叙述正确的是( )
A.放电时,负极反应为3NaBr-2e-===NaBr3+2Na+
B.充电时,阳极反应为2Na2S2-2e-===Na2S4+2Na+
C.放电时,Na+经过离子交换膜,由b池移向a池
D.用该电池电解饱和食盐水,产生2.24 L H2时,b池生成17.40 g Na2S4
C [根据放电后Na2S2转化为Na2S4,S元素化合价升高,知Na2S2被氧化,故负极反应为2Na2S2-2e-===Na2S4+2Na+,A项错误;充电时阳极上发生氧化反应,NaBr转化为NaBr3,电极反应为3NaBr-2e-===NaBr3+2Na+,B项错误;放电时,阳离子向正极移动,故Na+经过离子交换膜,由b池移向a池,C项正确;放电时b池为负极区域,发生氧化反应:2Na2S2-2e-===Na2S4+2Na+,用该电池电解饱和食盐水,产生标准状况下2.24 L H2时转移0.2 mol电子,生成0.1 mol Na2S4,其质量为17.40 g,D项错误。]
考法2 形形色色的燃料电池
4.(2019·哈尔滨模拟)新型NaBH4/H2O2燃料电池(DBFC)的结构如图所示,(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )
A.电极B材料中含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应:BH+8OH--8e-===BO+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1 L 6 mol·L-1 H2O2溶液,理论上流过电路中的电子数为6NA
B [A项,电极B采用MnO2,为正极,H2O2发生还原反应,得到电子被还原生成OH-,MnO2既作电极材料又有催化作用,错误;B项,负极发生氧化反应,电极反应式为BH+8OH--8e-===BO+6H2O,正确;C项,放电时,Na+向正极移动,错误;D项,在电池反应中,每消耗1 L 6 mol·L-1 H2O2溶液,理论上流过电路中的电子数为
6 mol·L-1×1 L×2×NA/mol=12NA,错误。]
5.(2019·西安八校联考)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是( )
A.HS-在硫氧化菌作用下转化为SO的反应为HS-+4H2O-8e-===SO+9H+
B.电子从电极b流出,经外电路流向电极a
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4 mol电子发生转移,则有0.5 mol H+通过质子交换膜
A [本题中微生物燃料电池的工作原理包括两个阶段:①引发反应,有机物+SOCO2↑+HS-;②电池反应,负极反应为HS-+4H2O-8e-===SO+9H+,正极反应为2O2+8H++8e-===4
H2O。根据题图知,在硫氧化菌作用下HS-转化为SO,发生氧化反应:HS-+4H2O-8e-===SO+9H+,A项正确;电子从电极a流出,经外电路流向电极b,B项错误;如果将反应物直接燃烧,有部分化学能转化为热能和光能,能量的利用率降低,C项错误;若该电池电路中有0.4 mol电子发生转移,则有0.4 mol H+通过质子交换膜,D项错误。]
6.(2019·贵阳模拟)一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )
A.b电极是负极
B.a电极的电极反应式:N2H4+4OH-+4e-===N2↑+4H2O
C.放电时,电子从a电极经过负载流向b电极
D.电池工作时,K+从正极移向负极
C [燃料电池中正极上通入空气,故b电极为正极,A项错误;a电极为负极,负极上N2H4发生氧化反应:N2H4-4e-+4OH-===N2↑+4H2O,B项错误;放电时,电子从负极(a电极)经过负载流向正极(b电极),C项正确;该装置交换膜为阴离子交换膜,电池工作时,OH-从正极移向负极,D项错误。]
(1)首先写出正极反应式
①酸性电解质溶液环境下电极反应式:
O2+4H++4e-===2H2O;
②碱性电解质溶液环境下电极反应式:
O2+2H2O+4e-===4OH-;
③固体氧化物电解质(高温下能传导O2-)环境下电极反应式:O2+4e-===2O2-;
④熔融碳酸盐(如熔融K2CO3)环境下电极反应式:
O2+2CO2+4e-===2CO。
(2)根据总反应式减去正极反应式确定负极反应式。
专项突破(十三) 新型化学电源试题的解答突破
1.命题分析
命题人常常根据新型化学电池的装置特点,以新介质、新燃料、轻金属为背景,涉及下列命题角度。
(1)电极的判断及其电极反应式的书写或判断。
(2)两极产物及两极反应类型的判断。
(3)两极附近溶液的pH变化或计算。
(4)电子、电流、离子移动方向,交换膜的判断。
(5)电子守恒的相关计算。
2.常考新型电源的原理分析
(1)镍氢电池(KOH溶液):NiOOH+MHNi(OH)2+M
负极反应式:MH-e-+OH-===M+H2O;
正极反应式:NiOOH+e-+H2O===Ni(OH)2+OH-。
(2)锂离子电池总反应式为xLi+Li1-xMn2O4LiMn2O4
负极反应式:xLi-xe-===xLi+;
正极反应式:Li1-xMn2O4+xe-+xLi+===LiMn2O4。
(3)研究人员研制出一种可快速充放电的超性能铝离子电池,Al、Cn为电极,有机阳离子与阴离子(AlCl、Al2Cl)组成的离子液体为电解质,如图为该电池放电过程示意图。
负极反应式:Al-3e-+7AlCl===4Al2Cl;
正极反应式:3Cn[AlCl4]+3e-===3Cn+3AlCl。
[典例导航]
(2017·全国卷Ⅲ,T11)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为16Li+xS8===8Li2Sx(2≤x≤8)。下列说法错误的是( )
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-===3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
[思路点拨] (1)16Li+xS8===8Li2Sx(2≤x≤8)
⇓
Li作负极,电极反应式为16Li-16e-===16Li+
S8作正极,电极反应式为xS8+16e-+16Li+===8Li2Sx
⇓放电时
电极a作正极,放电时间越长,Li2Sx中x越小
⇓充电时
电极a作阳极,充电时间越长,Li2Sx中x越大
(2)负极Li生成Li+移向正极,减重×7 g·mol-1=0.14 g
答案:D
(1)放电时负极反应式为______________,正极反应式(当x=6时)为___________,放电过程中Li2S8―→Li2S6的正极反应式为__________。
(2)充电时,阳极反应式(Li2S2―→Li2S4)____________________。
答案:(1)Li-e-===Li+ 6S8+16e-+16Li+===8Li2S6 3Li2S8+2e-+2Li+===4Li2S6
(2)2Li2S2-2e-===Li2S4+2Li+
[综合体验]
1.(2019·山西八校联考)硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时发生的反应为4VB2+11O2===4B2O3+2V2O5。下列说法不正确的是( )
A.电极a为电池正极
B.图中选择性透过膜为阴离子透过膜
C.电池工作过程中,电极a附近区域pH减小
D.VB2极发生的电极反应为2VB2+22OH--22e-===V2O5+2B2O3+11H2O
C [根据电池反应,O2发生还原反应,故通入空气的电极a为正极,电极反应式为O2+2H2O+4e-===4OH-,A项正确;根据电池反应,VB2发生氧化反应转化为V2O5、B2O3,VB2极的电极反应式为2VB2+22OH--22e-===V2O5+2B2O3+11H2O,D项正确;根据负极反应和正极反应可知,正极上生成OH-,负极上消耗OH-,故该选择性透过膜为阴离子透过膜,B项正确;由正极反应式可知,电池工作过程中,电极a附近c(OH-)增大,pH增大,C项错误。]
2.(2019·石家庄联考)某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应式为Li1-xCoO2+LixC6
===LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Co元素的化合价升高
B.放电时,正极的电极反应式为Li1-xCoO2+xe-+xLi+===LiCoO2
C.充电时,Li+在电解液中由阳极向阴极迁移
D.充电时,阴极的电极反应式为C6+xLi++xe-===LixC6
A [由放电时电池的总反应式可知,放电时Co的化合价降低,A项错误;放电时正极的电极反应式为Li1-xCoO2+xe-+xLi+===LiCoO2,B项正确;充电时阳离子由阳极向阴极迁移,C项正确;充电时阴极反应与放电时负极反应互为逆反应,阴极反应式为C6+xLi++xe-===LixC6,D项正确。]
3.(2019·日照质检)一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。
下列说法不正确的是( )
A.放电时,Mg(液)层的质量减小
B.放电时,正极反应为Mg2++2e-===Mg
C.该电池充电时,Mg-Sb(液)层发生还原反应
D.该电池充电时,Cl-向下层移动
C [根据电流方向(由正极流向负极)可知,镁(液)层为原电池的负极,放电时,Mg(液)层的质量减小,A项正确;根据题意知,正极反应为熔融的Mg2+得电子发生还原反应,电极反应式为Mg2++2e-===
Mg,B项正确;充电时镁(液)层为阴极,Mg-Sb(液)层为阳极,则Mg-Sb(液)层发生氧化反应,C项错误;充电时阴离子向阳极移动,即Cl-向下层移动,D项正确。]
课堂反馈 真题体验
1.(2018·全国卷Ⅱ,T12)我国科学家研发了一种室温下“可呼吸”的NaCO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na2Na2CO3+C。下列说法错误的是 ( )
A.放电时,ClO向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-===2CO+C
D.充电时,正极反应为Na++e-===Na
D [结合总反应式和题图可知,该电池放电时Na为负极,Ni为正极。NaCO2二次电池放电时为原电池,充电时为电解池。
电池放电时,ClO向负极移动,A项正确;结合总反应可知放电时需吸收CO2,而充电时释放出CO2,B项正确;放电时,正极CO2得电子被还原生成单质C,即电极反应式为3CO2+4e-===2CO+C,C项正确;充电时阳极发生氧化反应,即C被氧化生成CO2,D项错误。]
2.(2018·全国卷Ⅲ,T11)一种可充电锂—空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.充电时,电解质溶液中Li+向多孔碳材料区迁移
D.充电时,电池总反应为Li2O2-x===2Li+O2
D [根据电池工作原理,多孔碳材料吸附O2,O2在此获得电子,所以多孔碳材料电极为电池的正极,A项错误;放电时电子从负极(锂电极)流出,通过外电路流向正极(多孔碳材料电极),B项错误;Li+带正电荷,充电时,应该向电解池的阴极(锂电极)迁移,C项错误;充电时,电池总反应为===2Li+O2,D项正确。]
3.(2016·全国卷Ⅱ,T11)MgAgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A.负极反应式为Mg-2e-===Mg2+
B.正极反应式为Ag++e-===Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑
B [根据题意,Mg海水AgCl电池总反应式为Mg+2AgCl===MgCl2+2Ag。A项,负极反应式为Mg-2e-===Mg2+,正确;B项,正极反应式为2AgCl+2e-===2Cl-+ 2Ag,错误;C
项,对原电池来说,阴离子由正极移向负极,正确;D项,由于镁是活泼金属,则负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑,正确。]
4.(2015·全国卷Ⅰ,T11)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为C6H12O6+6O2===6CO2+6H2O
A [图示所给出的是原电池装置。A.有氧气反应的一极为正极,发生还原反应,因为有质子通过,故正极电极反应式为O2+4e-+4H+===2H2O,C6H12O6在微生物的作用下发生氧化反应,电极反应式为C6H12O6-24e-+6H2O===6CO2+24H+,负极上有CO2产生,故A不正确。B.微生物电池是指在微生物作用下将化学能转化为电能的装置,所以微生物促进了反应中电子的转移,故B正确。C.质子是阳离子,阳离子由负极区移向正极区,故C正确。D.正极的电极反应式为6O2+24e-+24H+===12H2O,负极的电极反应式为C6H12O6-24e-+6H2O===6CO2+24H+,两式相加得电池总反应为C6H12O6+6O2===6CO2+6H2O,故D正确。]
相关资料
更多








