
还剩11页未读,
继续阅读
所属成套资源:2020高考苏教版化学一轮复习讲义(部分缺失)
成套系列资料,整套一键下载
2020版新一线高考化学(苏教版)一轮复习讲义:第1部分专题5第3单元微粒之间的相互作用与物质的多样性
展开
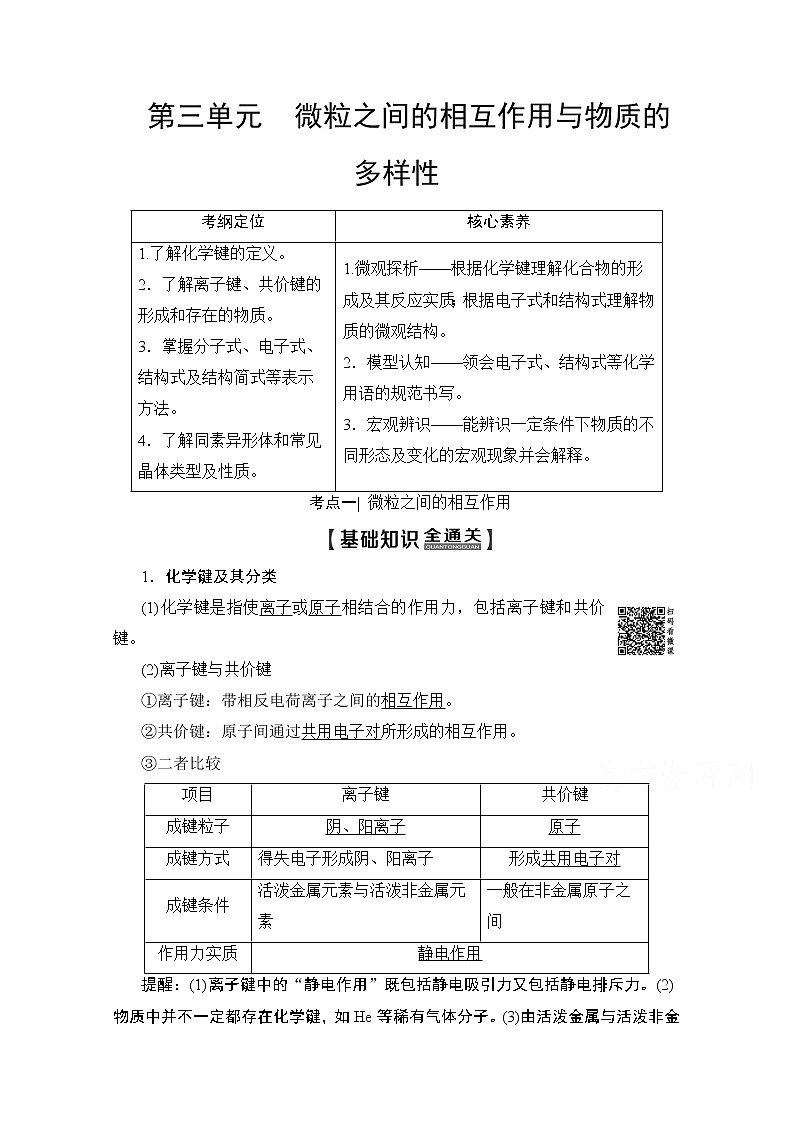
第三单元 微粒之间的相互作用与物质的多样性
考纲定位
核心素养
1.了解化学键的定义。
2.了解离子键、共价键的形成和存在的物质。
3.掌握分子式、电子式、结构式及结构简式等表示方法。
4.了解同素异形体和常见晶体类型及性质。
1.微观探析——根据化学键理解化合物的形成及其反应实质;根据电子式和结构式理解物质的微观结构。
2.模型认知——领会电子式、结构式等化学用语的规范书写。
3.宏观辨识——能辨识一定条件下物质的不同形态及变化的宏观现象并会解释。
考点一| 微粒之间的相互作用
1.化学键及其分类
(1)化学键是指使离子或原子相结合的作用力,包括离子键和共价键。
(2)离子键与共价键
①离子键:带相反电荷离子之间的相互作用。
②共价键:原子间通过共用电子对所形成的相互作用。
③二者比较
项目
离子键
共价键
成键粒子
阴、阳离子
原子
成键方式
得失电子形成阴、阳离子
形成共用电子对
成键条件
活泼金属元素与活泼非金属元素
一般在非金属原子之间
作用力实质
静电作用
提醒:(1)离子键中的“静电作用”既包括静电吸引力又包括静电排斥力。(2)物质中并不一定都存在化学键,如He等稀有气体分子。(3)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl3中Al—Cl键为共价键。(4)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键,如NH4Cl等。
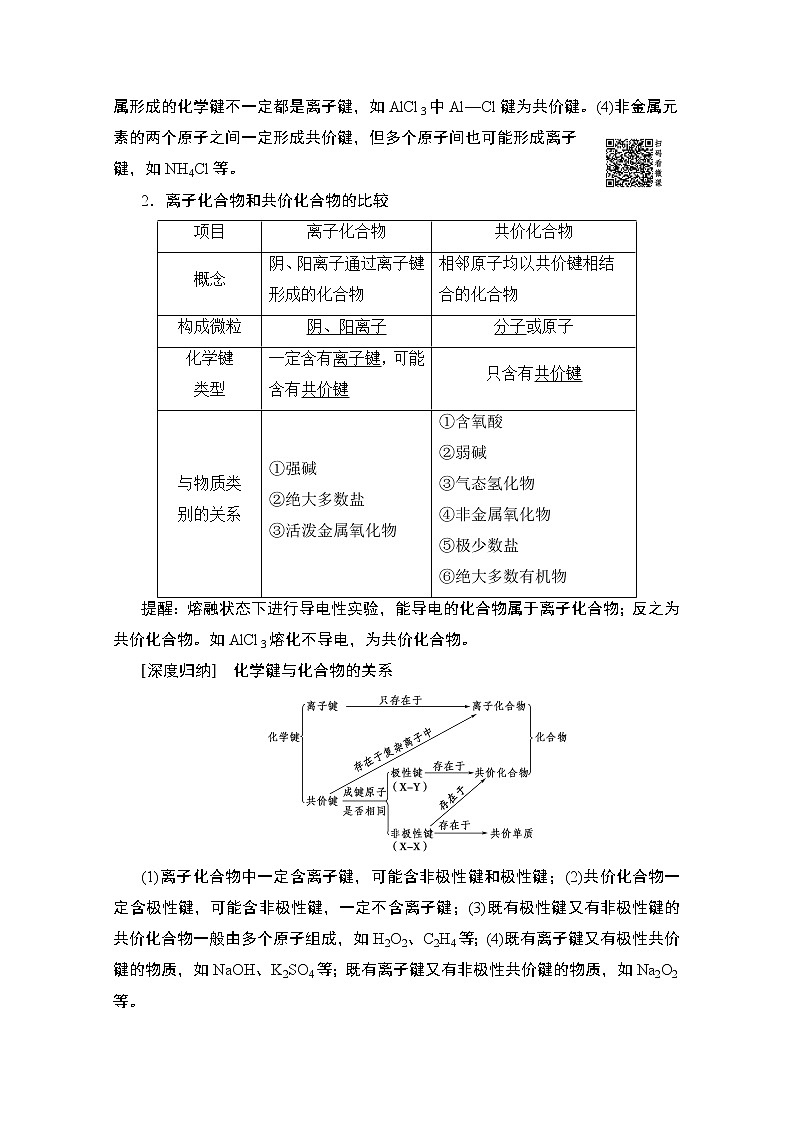
2.离子化合物和共价化合物的比较
项目
离子化合物
共价化合物
概念
阴、阳离子通过离子键形成的化合物
相邻原子均以共价键相结合的化合物
构成微粒
阴、阳离子
分子或原子
化学键
类型
一定含有离子键,可能含有共价键
只含有共价键
与物质类
别的关系
①强碱
②绝大多数盐
③活泼金属氧化物
①含氧酸
②弱碱
③气态氢化物
④非金属氧化物
⑤极少数盐
⑥绝大多数有机物
提醒:熔融状态下进行导电性实验,能导电的化合物属于离子化合物;反之为共价化合物。如AlCl3熔化不导电,为共价化合物。
[深度归纳] 化学键与化合物的关系
(1)离子化合物中一定含离子键,可能含非极性键和极性键;(2)共价化合物一定含极性键,可能含非极性键,一定不含离子键;(3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等;(4)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
3.分子间作用力——范德华力与氢键
(1)定义:把分子聚集在一起的作用力,又称范德华力。
(2)特点
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质、微粒之间不存在分子间作用力。
(3)变化规律
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。例如,熔、沸点:I2>Br2>Cl2>F2。
(4)氢键:分子间存在氢键的物质(如H2O、HF、NH3)在同族氢化物中熔、沸点反常的高,如H2O>H2S,HF>HCl。
4.化学键对物质性质的影响
(1)对物理性质的影响
①金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。
②NaCl等部分离子化合物,也有很强的离子键,故熔点也较高。
(2)对化学性质的影响
①N2分子中有很强的共价键,故在通常状况下,N2性质很稳定。
②H2S、HI等分子中的共价键较弱,故它们受热时易分解。
正误判断(正确的打“√”,错误的打“×”)
(1)由活泼金属元素与活泼非金属元素形成的化学键都是离子键。
( )
(2)Na2O2中只存在Na+与O间的离子键。( )
(3)H2O的沸点比H2S的高,说明H—O键比H—S键强。( )
(4)NaHSO4熔化电离方程式为NaHSO4===Na++HSO。( )
(5)SiO2的熔点比CO2(干冰)的高的理由是因为二者中化学键强弱不同。
( )
(6)H2O2、C2H4、N2H4分子中均既含极性键又含非极性键。( )
答案:(1)× (2)× (3)× (4)√ (5)× (6)√
考法1 化学键与化合物类型的判断
1.(2019·滨州模拟)X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是
( )
A.只含极性键的共价化合物
B.含非极性键的共价化合物
C.阴阳离子个数之比为1∶1的离子化合物
D.含非极性键的离子化合物
C [由题意可知,X可能为H、Li、Na,Y可能为O、S,故X、Y形成的化合物有H2O、H2O2、H2S、Na2O2、Na2O、Na2S等。]
2.(2019·日照模拟)2017年1月,南京理工大学胡炳成教授团队成功合成世界上首个全氮阴离子盐,全氮阴离子化学式为N。下列关于全氮阴离子盐的说法不正确的是( )
A.每个N含有36个电子
B.全氮阴离子盐为离子化合物
C.全氮阴离子盐既含离子键又含共价键
D.全氮阴离子盐可能属于电解质,也可能属于非电解质
D [全氮阴离子盐为离子化合物,不可能属于非电解质。]
3.现有以下物质:
①NaCl ②Na2O ③Na2O2 ④NaOH ⑤H2SO4
⑥H2O ⑦N2 ⑧(NH4)2CO3 ⑨CO2 ⑩H2O2
⑪Ne ⑫C2H4
(1)只含离子键的物质有________,只含共价键的物质有________,不含化学键的有________。
(2)属于离子化合物的有________;其中含有非极性键的是________,其中含有极性键的是________。
(3)属于共价化合物的有________;其中含有非极性键的是________。
答案:(1)①② ⑤⑥⑦⑨⑩⑫ ⑪
(2)①②③④⑧ ③ ④⑧
(3)⑤⑥⑨⑩⑫ ⑩⑫
考法2 物质变化与化学键变化的关系
4.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O===4NaOH+O2↑
B.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
C.Cl2+H2O===HClO+HCl
D.NH4Cl+NaOH===NaCl+NH3↑+H2O
A [A项,反应中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,正确;B项,该反应中没有非极性键的断裂和形成,错误;C项,该反应中没有离子键的断裂和形成,也没有非极性键的形成,错误;D项,该反应中没有非极性键的断裂和形成,错误。]
5.实现下列变化,需克服相同类型作用力的是( )
A.金刚石和氯化钠分别受热熔化
B.冰的融化和水的分解
C.NH4Cl和HCl溶于水
D.干冰和碘的升华
D [A项,金刚石熔化克服共价键而NaCl熔化克服离子键;B项,冰融化克服分子间作用力而水分解克服共价键;C项,NH4Cl溶于水克服离子键而HCl溶于水克服共价键;D项,干冰和碘升华均克服分子间作用力。]
6.下列熔、沸点大小比较正确的是________(填序号)。
①Cl2>H2 ②干冰>SiO2 ③金刚石>钠 ④二氧化硅>二氧化碳 ⑤金刚石H2Se ⑦I2>Br2 ⑧HCl>HBr ⑨NH3>PH3 ⑩HF<HCl
⑪H2O<SO2 ⑫正丁烷>异丁烷
答案:①③④⑥⑦⑨⑫
[拓展链接] 物质熔化、溶解时化学键的变化
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离出自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③有些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
考点二| 电子式与结构式
1.电子式
在元素符号周围用“·”或“×”来代表原子的最外层电子的式子。
2.用电子式表示化合物的形成过程
(1)离子化合物:左边是原子的电子式相同原子电子式可以合并,右边是离子化合物的电子式,中间用“―→”连接。
如NaCl:。
(2)共价化合物:左边是原子的电子式相同原子电子式可合并,右边是共价化合物的电子式,中间用“―→”连接。
如NH3:。
3.结构式:对于共价分子,将共用电子对改为短线,未成键电子省略。如―→N≡N。
[深度归纳] 电子式书写“六项”注意
(1)同一原子的电子式最好不要既用“·”又用“”表示;在化合物中“·”或“”最好也不要混用(若特殊需要可标记),可将电子全部标成“·”或“”。
(2)单一原子形成的简单阳离子,其离子符号就是该阳离子的电子式,如Al3+就可以表示铝离子的电子式。“[ ]”在所有的阴离子、复杂的阳离子中出现。
(3)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是相隔的,即不能将两个阴离子或两个阳离子写在一起。如:CaF2要写成[]-Ca2+[]-,不能写成Ca2+[],也不能写成Ca2+[]-[]-。
(4)不要漏写未成键的电子,如N2写成N⋮⋮N是错误的。
(5)不要弄错原子间的连接,如HClO分子中H与O相连。
(6)在用电子式表示物质形成的过程时,由于不是化学方程式,所以不能出现“===”。“―→”前是原子的电子式,“―→”后是物质的电子式。
考法1 电子式的书写
1.书写下列粒子的电子式:
(1)Mg________,S________。
(2)Na+________,Cl-________,NH________,H3O+________,OH-________,—OH________,—NH2________。
(3)Cl2________,N2________。
(4)Na2S________,Na2O2________,NaOH________,NH4Cl________,NaH________。
(5)NH3________,CO2________,CCl4________,H2O2________,C2H4________,HClO______。
答案:(1)Mg
2.用电子式表示下列物质的形成过程:
(1)MgBr2:__________________________________________。
(2)H2O:____________________________________________。
(3)H2:______________________________________________。
(4)Na3N:____________________________________________。
答案:(1)
3.下列粒子中所有原子的最外层都达到8电子稳定结构的是________(填序号)。
①BF3 ②NCl3 ③H3O+ ④SiCl4 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧XeF4 ⑨SO2 ⑩HClO ⑪N2 ⑫N2H4 ⑬CO2
答案:②④⑤⑪⑬
(1)最外层电子数+|化合价|=8的原子均达到8e-稳定结构。
(2)含氢化合物中的氢原子一定不是8e-稳定结构。
考法2 共价分子的结构式及结构简式和空间构型
4.(1)CH4、NH3、H2O2、N2H4的结构式分别为
________________、________________、________________、________________。
(2)乙酸的结构式为____________________,结构简式为________________;次氯酸的结构式为__________________________。
(3)乙烯、乙醇的结构简式分别为__________________、______________。
(4)苯、硝基苯的结构简式分别为_____________ 、___________。
(5)葡萄糖的分子式为____________,结构简式为___________。
(6)CO2、H2O、CH4、NH3的空间构型分别为__________、______________、______________、______________。
答案:(1)
(3)CH2===CH2 C2H5OH (4)
(5)C6H12O6 CH2OH(CHOH)4CHO (6)直线形 V形 正四面体型 三角锥型
考点三| 物质的多样性——同素异形体与晶体类型
1.同素异形现象
(1)同素异形现象指同一种元素能够形成几种不同单质的现象,这些单质互称为该元素的同素异形体。
(2)碳元素的同素异形体
①金刚石:晶体中每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构。
②石墨:晶体为层状结构,层内碳原子间以共价键结合,层内形成平面六边形排列的平面网状结构,层间碳原子间存在分子间作用力。
③C60:分子是由60个碳原子形成的封闭笼状结构分子,人们称为“足球烯”。
(3)常见的同素异形体:①O2与O3;②白磷与红磷等。
2.不同类型的晶体
(1)晶体:具有规则的几何外形,是其内部构成微粒有规则排列的结果。
(2)构成晶体的微粒可以是分子、离子、原子。
(3)分类:晶体分为分子晶体、原子晶体、离子晶体和金属晶体。
(4)四种晶体类型的比较
晶体
类型
离子晶体
原子
晶体
分子晶体
金属晶体
晶体构
成微粒
阴、阳离子
原子
分子
金属阳离子、自由电子
熔沸点
较高
很高
很低
一般较高 ,少部分低
硬度
较硬
很硬
一般很软
一般较硬,少部分软
溶解性
易溶于极
性溶剂
难溶解
相似相溶
难溶(Na等与水反应)
提醒:晶体的导电性分析
(1)分子晶体不导电、熔化不导电,但溶于水可能导电,如NH3。
(2)离子晶体不导电,熔化或溶于水导电。
(3)原子晶体一般不导电,熔化不导电。
(4)金属晶体导电,熔化也导电。
考法1 同素异形体的判断
1.据有关媒体报道,最近意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了一种新型氧分子,并用质谱仪探测到了它的存在,这种新型氧分子是由4个氧原子构成的。下列有关这种新型氧分子的叙述正确的是 ( )
A.在相同条件下,该气体的密度与O3相同
B.等质量时所含的氧原子数比O3的多
C.是除O2、O3外的又一种氧的同素异形体
D.该分子转化为O3或O2的变化为物理变化
【答案】 C
2.(2019·贵阳模拟)随着科学技术的发展,科学家在宇宙深处发现了H3分子,同时在其他领域合成了如N5、O4、C60等新物质。关于上述物质的有关说法中,正确的是( )
A.O2与O4属于同位素
B.C60的摩尔质量为720
C.H2与H3属于同素异形体
D.多数时候N5带有正电荷,以N的形式存在,N中含有36个电子
C [A项,O2、O4属于同素异形体,错误;B项,摩尔质量有单位,错误;D项,该微粒为N5失去电子形成的阳离子,所以含电子数为34,错误。]
考法2 不同晶体的判断与性质比较
3.共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体:①Na2O2 ②SiO2 ③NH4Cl ④金刚石
⑤NaCl ⑥白磷中,含有两种作用力的是 ( )
A.①②③ B.①③⑥
C.②④⑥ D.①②③⑥
B [过氧化钠中含Na+和过氧根之间形成的离子键,而过氧根内部是共价键;SiO2中只含有极性共价键;NH4Cl中铵根和Cl-间形成的是离子键,NH内部是共价键;金刚石中只含有非极性共价键;NaCl中只含有离子键;白磷为P4分子,P原子间存在非极性共价键,分子间存在范德华力。含有两种作用力的有三种:Na2O2、NH4Cl和白磷。]
4.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是 ( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C [离子晶体中含有离子键,离子键在熔融状态下能够被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的实验依据。]
5.比较下列各组熔点大小(用“>”“<”表示)
(1)干冰________二氧化硅。
(2)H2O________H2Se。
(3)金刚石________NaCl。
(4)Cl2________F2。
(5)NH3________PH3。
【答案】 (1)< (2)> (3)> (4)> (5)>
[思维建模] 晶体类型的判断方法
(1)依据物质的分类判断
①金属氧化物(如K2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。
③常见的原子晶体单质有金刚石、晶体硅、晶体硼等;化合物有碳化硅、二氧化硅等。
④金属单质(除汞外)与合金是金属晶体。
(2)依据晶体的物理性质不同进行判断
①离子晶体一般熔沸点较高,硬度较大,其水溶液或熔化时能导电。
②原子晶体一般熔沸点较高,硬度更大,一般不导电,但也有例外,如晶体硅。
③分子晶体一般熔沸点低,硬度小,一般不导电,但也有部分(如酸和部分气态氢化物)溶于水导电。
④金属晶体一般熔沸点较高(Hg除外),硬度较大,能导电。
课堂反馈 真题体验
1.下列说法正确的是________(填序号)。
(1)(2018·全国卷Ⅱ)常温常压下,124 g P4中所含P—P键数目为4NA
(2)(2018·全国卷Ⅲ)1 mol乙烷和1 mol乙烯中,化学键数相同
(3)(2015·全国卷Ⅱ)60 g丙醇中存在的共价键总数为10NA
(4)(2015·全国卷Ⅰ)N和P不能存在于同一离子化合物中
(5)(2015·全国卷Ⅱ)氢与硫、氯、钾3种元素均能形成共价化合物
(6)(2015·全国卷Ⅱ)钾与氢、硫、氯3种元素均能形成离子化合物
答案:(6)
2.(1)(2016·全国卷Ⅱ)联氨(N2H4)的电子式为________________,其中氮的化合价为________。
(2)(2015·全国卷Ⅰ)硼氢化钠(NaBH4)的电子式为________________________。
(3)(2014·全国卷)光气的化学组成为COCl2,每个原子均达到8电子稳定结构,其电子式为________。
答案:(1) (2)
(3)
3.(2018·全国卷Ⅱ,T10)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
A [根据W与X可生成一种红棕色有刺激性气味的气体,可知该气体为NO2,因原子序数递增可知W和X分别为N元素和O元素;结合Y的周期数是族序数的3倍,且Y为短周期元素,则Y只能为Na元素;根据Z原子最外层的电子数与W原子的电子总数相同,且Z为短周期元素可知Z为Cl元素。
O能与N形成NO、NO2、N2O5等化合物,O与Na能形成Na2O和Na2O2,O与Cl能形成ClO2、Cl2O7等化合物,A项正确;Na与N、Cl形成的化合物只含离子键,而Na与O形成的Na2O2中既含离子键又含共价键,B项错误;N3-、O2-、Na+均含10个电子,而Cl-含18个电子,C项错误;N元素的最高价氧化物对应的水化物HNO3为强酸,而该选项中没有指明是N元素的最高价氧化物对应的水化物,D项错误。]
第三单元 微粒之间的相互作用与物质的多样性
考纲定位
核心素养
1.了解化学键的定义。
2.了解离子键、共价键的形成和存在的物质。
3.掌握分子式、电子式、结构式及结构简式等表示方法。
4.了解同素异形体和常见晶体类型及性质。
1.微观探析——根据化学键理解化合物的形成及其反应实质;根据电子式和结构式理解物质的微观结构。
2.模型认知——领会电子式、结构式等化学用语的规范书写。
3.宏观辨识——能辨识一定条件下物质的不同形态及变化的宏观现象并会解释。
考点一| 微粒之间的相互作用
1.化学键及其分类
(1)化学键是指使离子或原子相结合的作用力,包括离子键和共价键。
(2)离子键与共价键
①离子键:带相反电荷离子之间的相互作用。
②共价键:原子间通过共用电子对所形成的相互作用。
③二者比较
项目
离子键
共价键
成键粒子
阴、阳离子
原子
成键方式
得失电子形成阴、阳离子
形成共用电子对
成键条件
活泼金属元素与活泼非金属元素
一般在非金属原子之间
作用力实质
静电作用
提醒:(1)离子键中的“静电作用”既包括静电吸引力又包括静电排斥力。(2)物质中并不一定都存在化学键,如He等稀有气体分子。(3)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl3中Al—Cl键为共价键。(4)非金属元素的两个原子之间一定形成共价键,但多个原子间也可能形成离子键,如NH4Cl等。
2.离子化合物和共价化合物的比较
项目
离子化合物
共价化合物
概念
阴、阳离子通过离子键形成的化合物
相邻原子均以共价键相结合的化合物
构成微粒
阴、阳离子
分子或原子
化学键
类型
一定含有离子键,可能含有共价键
只含有共价键
与物质类
别的关系
①强碱
②绝大多数盐
③活泼金属氧化物
①含氧酸
②弱碱
③气态氢化物
④非金属氧化物
⑤极少数盐
⑥绝大多数有机物
提醒:熔融状态下进行导电性实验,能导电的化合物属于离子化合物;反之为共价化合物。如AlCl3熔化不导电,为共价化合物。
[深度归纳] 化学键与化合物的关系
(1)离子化合物中一定含离子键,可能含非极性键和极性键;(2)共价化合物一定含极性键,可能含非极性键,一定不含离子键;(3)既有极性键又有非极性键的共价化合物一般由多个原子组成,如H2O2、C2H4等;(4)既有离子键又有极性共价键的物质,如NaOH、K2SO4等;既有离子键又有非极性共价键的物质,如Na2O2等。
3.分子间作用力——范德华力与氢键
(1)定义:把分子聚集在一起的作用力,又称范德华力。
(2)特点
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力存在于由共价键形成的多数共价化合物和绝大多数气态、液态、固态非金属单质分子之间。但像二氧化硅、金刚石等由共价键形成的物质、微粒之间不存在分子间作用力。
(3)变化规律
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点也越高。例如,熔、沸点:I2>Br2>Cl2>F2。
(4)氢键:分子间存在氢键的物质(如H2O、HF、NH3)在同族氢化物中熔、沸点反常的高,如H2O>H2S,HF>HCl。
4.化学键对物质性质的影响
(1)对物理性质的影响
①金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。
②NaCl等部分离子化合物,也有很强的离子键,故熔点也较高。
(2)对化学性质的影响
①N2分子中有很强的共价键,故在通常状况下,N2性质很稳定。
②H2S、HI等分子中的共价键较弱,故它们受热时易分解。
正误判断(正确的打“√”,错误的打“×”)
(1)由活泼金属元素与活泼非金属元素形成的化学键都是离子键。
( )
(2)Na2O2中只存在Na+与O间的离子键。( )
(3)H2O的沸点比H2S的高,说明H—O键比H—S键强。( )
(4)NaHSO4熔化电离方程式为NaHSO4===Na++HSO。( )
(5)SiO2的熔点比CO2(干冰)的高的理由是因为二者中化学键强弱不同。
( )
(6)H2O2、C2H4、N2H4分子中均既含极性键又含非极性键。( )
答案:(1)× (2)× (3)× (4)√ (5)× (6)√
考法1 化学键与化合物类型的判断
1.(2019·滨州模拟)X、Y为两种短周期元素,其原子的最外层电子数分别是1和6,则X、Y两种元素形成的常见化合物或者离子不可能是
( )
A.只含极性键的共价化合物
B.含非极性键的共价化合物
C.阴阳离子个数之比为1∶1的离子化合物
D.含非极性键的离子化合物
C [由题意可知,X可能为H、Li、Na,Y可能为O、S,故X、Y形成的化合物有H2O、H2O2、H2S、Na2O2、Na2O、Na2S等。]
2.(2019·日照模拟)2017年1月,南京理工大学胡炳成教授团队成功合成世界上首个全氮阴离子盐,全氮阴离子化学式为N。下列关于全氮阴离子盐的说法不正确的是( )
A.每个N含有36个电子
B.全氮阴离子盐为离子化合物
C.全氮阴离子盐既含离子键又含共价键
D.全氮阴离子盐可能属于电解质,也可能属于非电解质
D [全氮阴离子盐为离子化合物,不可能属于非电解质。]
3.现有以下物质:
①NaCl ②Na2O ③Na2O2 ④NaOH ⑤H2SO4
⑥H2O ⑦N2 ⑧(NH4)2CO3 ⑨CO2 ⑩H2O2
⑪Ne ⑫C2H4
(1)只含离子键的物质有________,只含共价键的物质有________,不含化学键的有________。
(2)属于离子化合物的有________;其中含有非极性键的是________,其中含有极性键的是________。
(3)属于共价化合物的有________;其中含有非极性键的是________。
答案:(1)①② ⑤⑥⑦⑨⑩⑫ ⑪
(2)①②③④⑧ ③ ④⑧
(3)⑤⑥⑨⑩⑫ ⑩⑫
考法2 物质变化与化学键变化的关系
4.下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.2Na2O2+2H2O===4NaOH+O2↑
B.Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
C.Cl2+H2O===HClO+HCl
D.NH4Cl+NaOH===NaCl+NH3↑+H2O
A [A项,反应中既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,正确;B项,该反应中没有非极性键的断裂和形成,错误;C项,该反应中没有离子键的断裂和形成,也没有非极性键的形成,错误;D项,该反应中没有非极性键的断裂和形成,错误。]
5.实现下列变化,需克服相同类型作用力的是( )
A.金刚石和氯化钠分别受热熔化
B.冰的融化和水的分解
C.NH4Cl和HCl溶于水
D.干冰和碘的升华
D [A项,金刚石熔化克服共价键而NaCl熔化克服离子键;B项,冰融化克服分子间作用力而水分解克服共价键;C项,NH4Cl溶于水克服离子键而HCl溶于水克服共价键;D项,干冰和碘升华均克服分子间作用力。]
6.下列熔、沸点大小比较正确的是________(填序号)。
①Cl2>H2 ②干冰>SiO2 ③金刚石>钠 ④二氧化硅>二氧化碳 ⑤金刚石
⑪H2O<SO2 ⑫正丁烷>异丁烷
答案:①③④⑥⑦⑨⑫
[拓展链接] 物质熔化、溶解时化学键的变化
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离出自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③有些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
考点二| 电子式与结构式
1.电子式
在元素符号周围用“·”或“×”来代表原子的最外层电子的式子。
2.用电子式表示化合物的形成过程
(1)离子化合物:左边是原子的电子式相同原子电子式可以合并,右边是离子化合物的电子式,中间用“―→”连接。
如NaCl:。
(2)共价化合物:左边是原子的电子式相同原子电子式可合并,右边是共价化合物的电子式,中间用“―→”连接。
如NH3:。
3.结构式:对于共价分子,将共用电子对改为短线,未成键电子省略。如―→N≡N。
[深度归纳] 电子式书写“六项”注意
(1)同一原子的电子式最好不要既用“·”又用“”表示;在化合物中“·”或“”最好也不要混用(若特殊需要可标记),可将电子全部标成“·”或“”。
(2)单一原子形成的简单阳离子,其离子符号就是该阳离子的电子式,如Al3+就可以表示铝离子的电子式。“[ ]”在所有的阴离子、复杂的阳离子中出现。
(3)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是相隔的,即不能将两个阴离子或两个阳离子写在一起。如:CaF2要写成[]-Ca2+[]-,不能写成Ca2+[],也不能写成Ca2+[]-[]-。
(4)不要漏写未成键的电子,如N2写成N⋮⋮N是错误的。
(5)不要弄错原子间的连接,如HClO分子中H与O相连。
(6)在用电子式表示物质形成的过程时,由于不是化学方程式,所以不能出现“===”。“―→”前是原子的电子式,“―→”后是物质的电子式。
考法1 电子式的书写
1.书写下列粒子的电子式:
(1)Mg________,S________。
(2)Na+________,Cl-________,NH________,H3O+________,OH-________,—OH________,—NH2________。
(3)Cl2________,N2________。
(4)Na2S________,Na2O2________,NaOH________,NH4Cl________,NaH________。
(5)NH3________,CO2________,CCl4________,H2O2________,C2H4________,HClO______。
答案:(1)Mg
2.用电子式表示下列物质的形成过程:
(1)MgBr2:__________________________________________。
(2)H2O:____________________________________________。
(3)H2:______________________________________________。
(4)Na3N:____________________________________________。
答案:(1)
3.下列粒子中所有原子的最外层都达到8电子稳定结构的是________(填序号)。
①BF3 ②NCl3 ③H3O+ ④SiCl4 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧XeF4 ⑨SO2 ⑩HClO ⑪N2 ⑫N2H4 ⑬CO2
答案:②④⑤⑪⑬
(1)最外层电子数+|化合价|=8的原子均达到8e-稳定结构。
(2)含氢化合物中的氢原子一定不是8e-稳定结构。
考法2 共价分子的结构式及结构简式和空间构型
4.(1)CH4、NH3、H2O2、N2H4的结构式分别为
________________、________________、________________、________________。
(2)乙酸的结构式为____________________,结构简式为________________;次氯酸的结构式为__________________________。
(3)乙烯、乙醇的结构简式分别为__________________、______________。
(4)苯、硝基苯的结构简式分别为_____________ 、___________。
(5)葡萄糖的分子式为____________,结构简式为___________。
(6)CO2、H2O、CH4、NH3的空间构型分别为__________、______________、______________、______________。
答案:(1)
(3)CH2===CH2 C2H5OH (4)
(5)C6H12O6 CH2OH(CHOH)4CHO (6)直线形 V形 正四面体型 三角锥型
考点三| 物质的多样性——同素异形体与晶体类型
1.同素异形现象
(1)同素异形现象指同一种元素能够形成几种不同单质的现象,这些单质互称为该元素的同素异形体。
(2)碳元素的同素异形体
①金刚石:晶体中每个碳原子与相邻的4个碳原子以共价键结合,形成空间网状结构。
②石墨:晶体为层状结构,层内碳原子间以共价键结合,层内形成平面六边形排列的平面网状结构,层间碳原子间存在分子间作用力。
③C60:分子是由60个碳原子形成的封闭笼状结构分子,人们称为“足球烯”。
(3)常见的同素异形体:①O2与O3;②白磷与红磷等。
2.不同类型的晶体
(1)晶体:具有规则的几何外形,是其内部构成微粒有规则排列的结果。
(2)构成晶体的微粒可以是分子、离子、原子。
(3)分类:晶体分为分子晶体、原子晶体、离子晶体和金属晶体。
(4)四种晶体类型的比较
晶体
类型
离子晶体
原子
晶体
分子晶体
金属晶体
晶体构
成微粒
阴、阳离子
原子
分子
金属阳离子、自由电子
熔沸点
较高
很高
很低
一般较高 ,少部分低
硬度
较硬
很硬
一般很软
一般较硬,少部分软
溶解性
易溶于极
性溶剂
难溶解
相似相溶
难溶(Na等与水反应)
提醒:晶体的导电性分析
(1)分子晶体不导电、熔化不导电,但溶于水可能导电,如NH3。
(2)离子晶体不导电,熔化或溶于水导电。
(3)原子晶体一般不导电,熔化不导电。
(4)金属晶体导电,熔化也导电。
考法1 同素异形体的判断
1.据有关媒体报道,最近意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了一种新型氧分子,并用质谱仪探测到了它的存在,这种新型氧分子是由4个氧原子构成的。下列有关这种新型氧分子的叙述正确的是 ( )
A.在相同条件下,该气体的密度与O3相同
B.等质量时所含的氧原子数比O3的多
C.是除O2、O3外的又一种氧的同素异形体
D.该分子转化为O3或O2的变化为物理变化
【答案】 C
2.(2019·贵阳模拟)随着科学技术的发展,科学家在宇宙深处发现了H3分子,同时在其他领域合成了如N5、O4、C60等新物质。关于上述物质的有关说法中,正确的是( )
A.O2与O4属于同位素
B.C60的摩尔质量为720
C.H2与H3属于同素异形体
D.多数时候N5带有正电荷,以N的形式存在,N中含有36个电子
C [A项,O2、O4属于同素异形体,错误;B项,摩尔质量有单位,错误;D项,该微粒为N5失去电子形成的阳离子,所以含电子数为34,错误。]
考法2 不同晶体的判断与性质比较
3.共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体:①Na2O2 ②SiO2 ③NH4Cl ④金刚石
⑤NaCl ⑥白磷中,含有两种作用力的是 ( )
A.①②③ B.①③⑥
C.②④⑥ D.①②③⑥
B [过氧化钠中含Na+和过氧根之间形成的离子键,而过氧根内部是共价键;SiO2中只含有极性共价键;NH4Cl中铵根和Cl-间形成的是离子键,NH内部是共价键;金刚石中只含有非极性共价键;NaCl中只含有离子键;白磷为P4分子,P原子间存在非极性共价键,分子间存在范德华力。含有两种作用力的有三种:Na2O2、NH4Cl和白磷。]
4.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是 ( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
C [离子晶体中含有离子键,离子键在熔融状态下能够被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的实验依据。]
5.比较下列各组熔点大小(用“>”“<”表示)
(1)干冰________二氧化硅。
(2)H2O________H2Se。
(3)金刚石________NaCl。
(4)Cl2________F2。
(5)NH3________PH3。
【答案】 (1)< (2)> (3)> (4)> (5)>
[思维建模] 晶体类型的判断方法
(1)依据物质的分类判断
①金属氧化物(如K2O等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体。
②大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)都是分子晶体。
③常见的原子晶体单质有金刚石、晶体硅、晶体硼等;化合物有碳化硅、二氧化硅等。
④金属单质(除汞外)与合金是金属晶体。
(2)依据晶体的物理性质不同进行判断
①离子晶体一般熔沸点较高,硬度较大,其水溶液或熔化时能导电。
②原子晶体一般熔沸点较高,硬度更大,一般不导电,但也有例外,如晶体硅。
③分子晶体一般熔沸点低,硬度小,一般不导电,但也有部分(如酸和部分气态氢化物)溶于水导电。
④金属晶体一般熔沸点较高(Hg除外),硬度较大,能导电。
课堂反馈 真题体验
1.下列说法正确的是________(填序号)。
(1)(2018·全国卷Ⅱ)常温常压下,124 g P4中所含P—P键数目为4NA
(2)(2018·全国卷Ⅲ)1 mol乙烷和1 mol乙烯中,化学键数相同
(3)(2015·全国卷Ⅱ)60 g丙醇中存在的共价键总数为10NA
(4)(2015·全国卷Ⅰ)N和P不能存在于同一离子化合物中
(5)(2015·全国卷Ⅱ)氢与硫、氯、钾3种元素均能形成共价化合物
(6)(2015·全国卷Ⅱ)钾与氢、硫、氯3种元素均能形成离子化合物
答案:(6)
2.(1)(2016·全国卷Ⅱ)联氨(N2H4)的电子式为________________,其中氮的化合价为________。
(2)(2015·全国卷Ⅰ)硼氢化钠(NaBH4)的电子式为________________________。
(3)(2014·全国卷)光气的化学组成为COCl2,每个原子均达到8电子稳定结构,其电子式为________。
答案:(1) (2)
(3)
3.(2018·全国卷Ⅱ,T10)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )
A.X与其他三种元素均可形成两种或两种以上的二元化合物
B.Y与其他三种元素分别形成的化合物中只含有离子键
C.四种元素的简单离子具有相同的电子层结构
D.W的氧化物对应的水化物均为强酸
A [根据W与X可生成一种红棕色有刺激性气味的气体,可知该气体为NO2,因原子序数递增可知W和X分别为N元素和O元素;结合Y的周期数是族序数的3倍,且Y为短周期元素,则Y只能为Na元素;根据Z原子最外层的电子数与W原子的电子总数相同,且Z为短周期元素可知Z为Cl元素。
O能与N形成NO、NO2、N2O5等化合物,O与Na能形成Na2O和Na2O2,O与Cl能形成ClO2、Cl2O7等化合物,A项正确;Na与N、Cl形成的化合物只含离子键,而Na与O形成的Na2O2中既含离子键又含共价键,B项错误;N3-、O2-、Na+均含10个电子,而Cl-含18个电子,C项错误;N元素的最高价氧化物对应的水化物HNO3为强酸,而该选项中没有指明是N元素的最高价氧化物对应的水化物,D项错误。]
相关资料
更多








