2011中考化学一轮专题复习:离子 1
展开离子
我夯基 我达标
1.镁原子与镁离子比较具有相同的_________,它们的不同之处有_________。
思路解析:原子得失电子变成离子,所以原子与离子之间只是电子数不同,质子数没有发生变化。
答案:质子数(核电荷数) 电子数
2.元素的化学性质主要取决于( )
A.核外电子数 B.核电荷数 C.中子数 D.最外层电子数
思路解析:原子的结构都有一个达到稳定结构的趋势,只有通过得失电子使最外层达到一个稳定结构,所以元素的化学性质主要表现在原子最外层电子的得失上。
答案:D
3.对于钠原子和钠离子两种粒子的比较,下列说法不正确的是( )
A.它们的电子数相同 B.它们的化学性质不相同
C.它们的质子数相同 D.它们都是构成物质的粒子
思路解析:钠离子是由钠原子失去最外层的一个电子而形成的,在此过程中,钠原子失去最外层的一个电子,电子数变了,化学性质也不相同,但质子数不变。
答案:A
4.1个氢原子由一个质子和一个电子构成,不含中子,当一个氢原子失去1个电子后,它不会变成( )
A.质子 B.原子核 C.阳离子 D.带负电的离子
思路解析:本题经过仔细分析不难得出,一个氢原子失去一个电子后,就变成了一个质子,带一个单位的正电荷。
答案:D
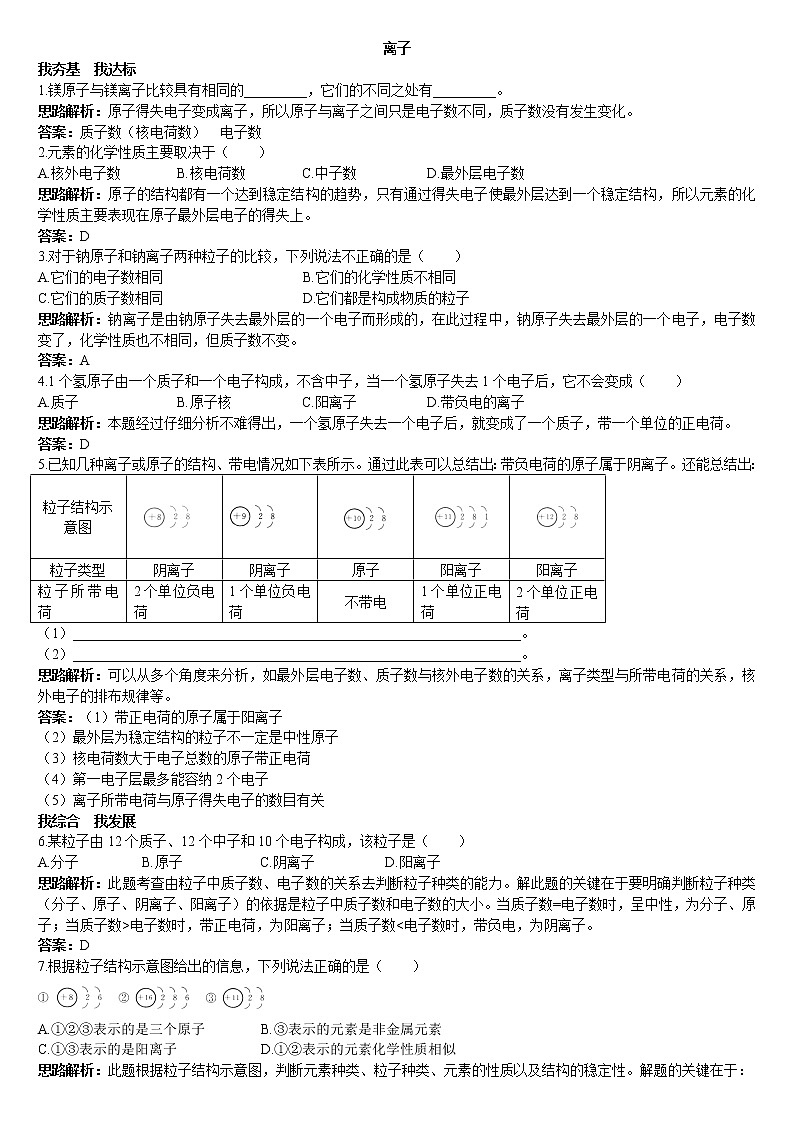
5.已知几种离子或原子的结构、带电情况如下表所示。通过此表可以总结出:带负电荷的原子属于阴离子。还能总结出:
粒子结构示意图 |
|
|
|
|
|
粒子类型 | 阴离子 | 阴离子 | 原子 | 阳离子 | 阳离子 |
粒子所带电荷 | 2个单位负电荷 | 1个单位负电荷 | 不带电 | 1个单位正电荷 | 2个单位正电荷 |
(1)________________________________________________________________。
(2)________________________________________________________________。
思路解析:可以从多个角度来分析,如最外层电子数、质子数与核外电子数的关系,离子类型与所带电荷的关系,核外电子的排布规律等。
答案:(1)带正电荷的原子属于阳离子
(2)最外层为稳定结构的粒子不一定是中性原子
(3)核电荷数大于电子总数的原子带正电荷
(4)第一电子层最多能容纳2个电子
(5)离子所带电荷与原子得失电子的数目有关
我综合 我发展
6.某粒子由12个质子、12个中子和10个电子构成,该粒子是( )
A.分子 B.原子 C.阴离子 D.阳离子
思路解析:此题考查由粒子中质子数、电子数的关系去判断粒子种类的能力。解此题的关键在于要明确判断粒子种类(分子、原子、阴离子、阳离子)的依据是粒子中质子数和电子数的大小。当质子数=电子数时,呈中性,为分子、原子;当质子数>电子数时,带正电荷,为阳离子;当质子数<电子数时,带负电,为阴离子。
答案:D
7.根据粒子结构示意图给出的信息,下列说法正确的是( )
A.①②③表示的是三个原子 B.③表示的元素是非金属元素
C.①③表示的是阳离子 D.①②表示的元素化学性质相似
思路解析:此题根据粒子结构示意图,判断元素种类、粒子种类、元素的性质以及结构的稳定性。解题的关键在于:
(1)由质子数和电子数的差值判断粒子种类(原子、阳离子、阴离子),①②为原子,而③为阳离子。
(2)由核内质子数决定元素种类,核内质子数不同,则表示不同元素。
(3)由原子最外层电子数决定元素的性质,①②为非金属元素,③为金属元素。且最外层电子数相同,性质相似,如①②元素化学性质相似。
(4)由最外层电子数决定粒子结构的稳定性。一般最外层电子数为8的结构称为“8电子稳定结构”。
答案:D
8.元素Z的核电荷数为8,阴离子Z2-与元素Y的阳离子Y3+的电子层结构相同,则元素Y的核电荷数是_________。
思路解析:离子是由原子失去或得到电子而形成的,且离子所带的电荷数等于原子形成离子时失去或得到的电子的数目,又Z2-的核外电子数为8+2=10,设Y的核电荷数为b,则Y3+核外电子数为b-3,又Z2-与Y3+电子层结构相同,则8+2=b-3,因此b=8+2+3=13。
答案:13
我创新 我超越
9.在下列示意图表示的粒子中,属于原子的有(用序号填空,下同)________,属于阴离子的有________,属于阳离子的有________,属于同种元素的有________,达到稳定结构的有________,具有相同的电子层结构的是________。
通过以上各图还可总结出,原子和离子的区别在于:
(1)________________________________________________________________。
(2)________________________________________________________________。
(3)________________________________________________________________。
思路解析:同种元素的粒子,质子数必相同。由于原子呈电中性,对阳离子而言,核电荷数必大于核外电子数。问题的关键是如何找出原子和离子的区别,可以从质子数与核外电子的关系、粒子的带电性等方面加以考虑。
答案:②⑤⑥ ③ ①④ ④⑤ ①③④⑥ ①③④
(1)原子整体上不显电性,离子显电性
(2)原子中质子数等于电子数,离子中质子数不等于电子数
(3)离子的最外层电子数一般是8电子(只有一个电子层时为2电子)的相对稳定结构,原子中除稀有气体外,其余的一般不是相对稳定结构








