






高中人教版 (2019)第四节 化学反应的调控精品课件ppt
展开工业合成氨的原理是N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·ml-1,从速率角度分析,反应需要在 (填“较高”或“较低”)温度下进行,而从提高反应物转化率的角度分析,反应需要在 (从压强和温度方面回答)条件下进行,原因是合成氨的反应为 。
正反应为气体体积减小的放热反应
一、合成氨反应条件的原理分析1.反应原理:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·ml-1。2.反应特点:
—可逆性:反应为 反应 —体积变化:正反应是气体体积 的反应 —焓变:ΔH 0
3.影响因素:(1)增大合成氨反应速率的措施:升高温度、增大压强、增大反应物浓度、使用催化剂等。(2)提高平衡混合气体中氨的含量措施:降低温度、增大压强、增大反应物浓度等。
二、实际合成氨工业中选择的生产条件1.压强:合成氨厂一般采用的压强为 。 【微思考1】合成氨时压强越大越好,为何不采用比30 MPa更大的压强?
10 MPa~30 Mpa
提示:压强越大,对材料的强度和设备的制造要求也越高,需要的动力也越大,这会加大生产投资,可能降低综合经济效益。
2.温度:一般采用的温度为400~500 ℃。【微思考2】合成氨采用低温时可提高转化率,但为何未采用更低的温度?
提示:温度太低,反应速率太小,达到平衡所需的时间变长,不经济。另外,合成氨所需的催化剂铁触媒的活性在500 ℃左右活性最大。
3.催化剂:合成氨工业普遍使用的是以铁为主体的多成分催化剂,又称铁触媒。【微思考3】合成氨工业采用迅速冷却法,使气态氨变为液氨后及时从混合物中分离出去的目的是什么?
提示:使化学平衡向生成氨的方向移动。
(1)合成氨反应在高温下能自发进行。 ( )(2)温度越高越利于合成氨反应平衡正向移动。 ( )(3)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。 ( )(4)使用催化剂能提高合成氨反应物的平衡转化率。 ( )
答案:(1)× (2)× (3)√ (4)×
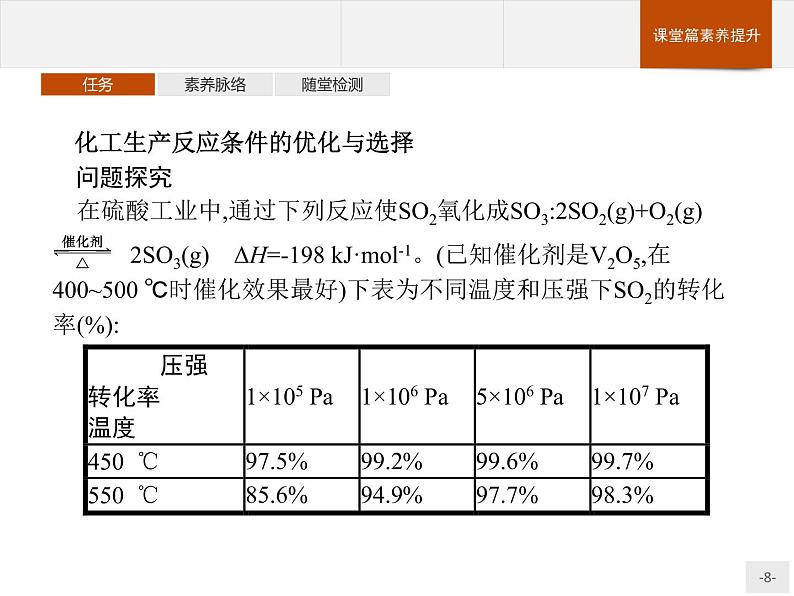
化工生产反应条件的优化与选择问题探究 在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g)
2SO3(g) ΔH=-198 kJ·ml-1。(已知催化剂是V2O5,在400~500 ℃时催化效果最好)下表为不同温度和压强下SO2的转化率(%):
1.根据化学理论和以上数据综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是什么?2.在实际生产中,选定400~500 ℃作为操作温度,其原因是什么?3.根据上表中的数据分析,制取SO3时为什么不采用高压?4.在生产中,通入过量空气的目的是什么?5.尾气中的SO2必须回收的目的是什么?
提示:常压、450 ℃、催化剂。
提示:兼顾速率和平衡,且在此温度下催化剂的活性最高。
提示:在常压下SO2的转化率就已经很高了(97.5%),若采用高压,平衡能向右移动,但效果并不明显,且采用高压时会增大设备的成本,得不偿失。
提示:增大反应物O2的浓度,提高SO2的转化率。
提示:防止污染环境;循环利用,提高原料的利用率。
深化拓展工业生产中选择适宜生产条件的原则
素能应用典例有关合成氨工业的说法中,正确的是( )A.增大H2的浓度,可提高H2的转化率B.由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
答案:B解析:A项,增大H2的浓度,H2的转化率减小;C项,温度控制在400~500 ℃主要是为了兼顾速率与平衡,且500 ℃时催化剂活性最大;D项,压强采用10 MPa~30 MPa主要是考虑对设备材料的要求。
变式训练1硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应2SO2+O2 2SO3的说法中正确的是( )A.只要选择适宜的条件,SO2和O2就能全部转化为SO3B.该反应达到平衡后,反应就完全停止了,即正、逆反应速率均为零C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
答案:D 解析:该反应为可逆反应,SO2和O2不能全部转化为SO3,A错;达到平衡后反应不停止,正、逆反应速率相等,B错;达到平衡后充入由18O原子组成的O2,平衡正向移动,SO3中18O含量增多,因为反应可逆,SO2中18O含量也增多,C错。
变式训练2有平衡体系:CO(g)+2H2(g) CH3OH(g) ΔH<0。为了增加甲醇(CH3OH)的产量,应采取的正确措施是( )A.高温,高压B.适宜温度,高压,催化剂C.低温,低压D.高温,高压,催化剂
答案:B 解析:该反应是一个气体体积减小的放热反应,为增加甲醇的产量,需使平衡正向移动,理论上可采用低温、高压的方式,但在实际生产中还需考虑反应速率、设备承受的压力及催化剂的活性等因素的影响。
1.工业上合成氨一般采用400~500 ℃的温度,其原因是 ( )①适当提高氨的合成速率 ②提高H2的转化率 ③提高氨的产率 ④催化剂在500 ℃左右活性最大A.只有① B.只有①②C.②③④ D.只有①④
2.利用原料气在合成塔中合成NH3,为提高N2的转化率所采取的措施是( )A.高温 B.高压C.使用催化剂D.增大N2的浓度
解析:合成氨反应是气体体积减小的放热反应,据勒夏特列原理可知,高压利于提高N2的转化率。
3.NH3是一种重要的工业原料。下列关于合成氨的说法中,不正确的是( )A.工艺涉及催化技术B.工艺涉及高温高压技术C.原料之一的氮气来自空气D.从合成塔出来的气体中,氨的体积分数为100%
解析:合成氨反应为可逆反应,N2和H2的转化率小于100%,则从合成塔出来的气体中,氨气的体积分数小于100%。
4.在一定条件下,可逆反应N2(g)+3H2(g) 2NH3(g)(正反应是放热反应)达到平衡,当单独改变下列条件后,有关叙述错误的是( )A.加催化剂,v(正)、v(逆)都发生变化且变化的倍数相等B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数小于v(逆)减小的倍数D.等容条件下加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
解析:等容条件下加入氩气,反应物和生成物浓度均不变,则v(正)、v(逆)均不发生变化,且v(正)=v(逆)。
高中化学人教版 (2019)选择性必修1第四节 化学反应的调控完美版ppt课件: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002422_t3/?tag_id=26" target="_blank">第四节 化学反应的调控完美版ppt课件</a>,共3页。
人教版 (2019)选择性必修1第四节 化学反应的调控精品ppt课件: 这是一份人教版 (2019)选择性必修1第四节 化学反应的调控精品ppt课件,文件包含24化学反应的调控练习解析版docx、24化学反应的调控练习原卷版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (2019)选择性必修1第四节 化学反应的调控精品ppt课件: 这是一份人教版 (2019)选择性必修1第四节 化学反应的调控精品ppt课件,文件包含人教版高中化学选择性必修一24《化学反应的调控》课件pptx、人教版高中化学选择性必修一24《化学反应的调控》学案docx等2份课件配套教学资源,其中PPT共33页, 欢迎下载使用。













