
还剩10页未读,
继续阅读
福建省永泰县第一中学2020届高三上学期期中考试 化学
展开
学校 班级 姓名 座号 准考号: .
--
-------密………封…………装…………订………线----------
. .
2019-2020学年第一学期永泰一中期中考
高中三年 化学科试卷
考试时间:8:00-9:30 完卷时间:90分钟 满分:100分
可能用到的相对原子质量: P—31 N—14 O—16 Cl—35.5 S—32 Al—27 Fe—56
Mn —55 K —39 Cu —64
一、选择题(每题只有一个正确选项,每题2分,21小题,共42分)
1.习总书记多次强调要“像对待生命一样对待生态环境”。下列说法正确的是( )[
A.赤潮是海水富营养化,藻类大量繁殖,这些藻类生长消耗大量氧气,造成水体缺氧
B.汽车尾气的大量排放是造成雾霾天气的人为因素之一
C.用施撒熟石灰的方法可改良碱性土壤
D.用明矾可消除水中Cu2+等重金属离子污染
2.化学与人类生产、生活密切相关,下列说法正确的是( )[
A. 医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
B. 铁粉和生石灰均可作食品袋内的脱氧剂
C. 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
D. 高纤维食物是富含膳食纤维的食物,在人体内都可通过水解反应提供能量
3.下列说法正确的是( )[
A.液态 HCl、固态 AgCl 均不导电,所以 HCl、AgCl 是非电解质
B.NH3、CO2 的水溶液均能导电,所以 NH3、CO2 均是电解质
C.福尔马林、水玻璃、氨水均为混合物
D.金属氧化物一定是碱性氧化物
4.设NA为阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA
B.阿伏加德罗常数的基准物是0.012kg的C
C.1L 0.1 mol.L-1的NaHCO3 溶液中HCO3- 和CO32- 离子数之和为0.1NA
D. 31克白磷含有的共价键数目为1.5 NA
5.V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是 ( )
A. 通入标准状况下的HCl气体11.2V L
B. 将溶液加热浓缩到0.5V L
C. 加入10 mol.L-1的盐酸0.1V L,再稀释至1.5V L
D. 加入V L 1.5 mol.L-1的盐酸混合均匀
6.下列实验操作规范且能达到目的的是( )[
目的
操作
A
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶
B
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D
配制浓度为0.010的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
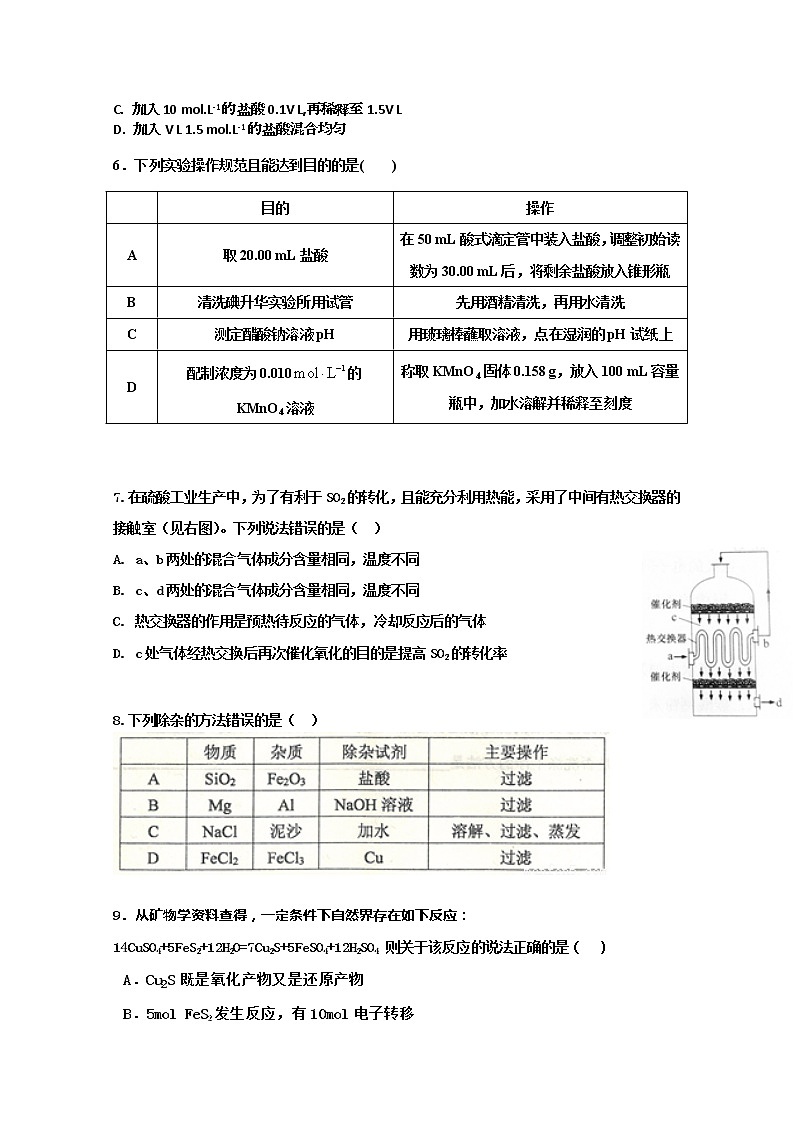
7.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是( )
A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
8.下列除杂的方法错误的是( )
9.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 则关于该反应的说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5mol FeS2发生反应,有10mol电子转移
C.FeS2只作还原剂
D.产物中的SO42- 离子有一部分是氧化产物
10.下列物质转化在给定条件下能实现的是( )
①SiO2Na2SiO3H2SiO3
②FeFe2O3Fe2(SO4)3
③BaSO4BaCO3BaCl2
( Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9 )
④AlCl3溶液AlNaAlO2
⑤HCHOHCOOHHCOOCH3
A.①②⑤ B.①③⑤ C.②④⑤ D.②③④
11.下列制Cl2并用其氧化含I-废液,回收提纯I2的装置和原理能达到实验目的的是( ) [
A. A B. B C. C D. D
12.下列离子方程式正确的是( )
A.酸性硫酸亚铁溶液在空气中被氧化: 4Fe2++O2+4H+=4Fe3++2H2O
B.硫酸铵溶液和氢氧化钡溶液反应: Ba2++SO42- = BaSO4↓
C.碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3- +Ca2++2OH﹣= CaCO3↓+CO32-+2H2O
D.酸化的NaIO3和NaI的混合溶液:I-+IO3-+6H+ = I2+3H2O
13.下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②碱性溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣
④加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥含Fe2+的溶液中:Na+、Ba2+、Cl﹣、I﹣
A.①② B.②③ C.②⑥ D. ②⑤⑥
14.用下面的方案进行某些离子的检验,其中方案设计严密的是( )[
A.检验试液中的SO42-
B.检验试液中的Fe2+
C.检验试液中的I-
D.检验试液中的CO32-
15.下列实验操作对应的现象和根据现象得出的结论均正确的是 ( )[
实验操作
现象
结论
A
向FeCl3溶液中加入浓NaOH溶液
溶液由黄色变为红棕色
生成了氢氧化铁胶体
B
向Co2O3中滴入浓盐酸加热
产生黄绿色气体
氧化性:Cl2>Co2O3
C
向某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
溶液中存在亚铁离子
D
向NaHCO3溶液中滴加NaAlO2溶液
有白色沉淀和气体产生
AlO2-与HCO3-发生了水解的相互促进
16. SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
A. Cu和浓硝酸 B. CaO和浓氨水
C. 高锰酸钾溶液和浓盐酸 D. 大理石和稀盐酸
17.生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺为:
下列说法正确的是( )
A.pH=4.1时,Ⅰ中为Na2 SO3溶液
B.Na2S2O5用作食品的抗氧化剂和SO2作漂白剂时,均表现还原性
C.工艺中加入Na2CO3固体、并再次充入SO2的目的是得到NaHSO3过饱和溶液
D.葡萄酒中Na2S2O5用作食品的漂白剂
18.海水是重要的资源,可以制备一系列物质。
下列说法正确的是( )
A.步骤②中,应先通 CO2,再通 NH3
B.步骤③中可将 MgCl2·6H2O 晶体在空气中直接加热脱水
C.除去粗盐中 SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:
NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
D.步骤④、⑤、⑥反应中,溴元素均被氧化
19.某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+ 完全氧化则x值为( )
A. 0.80 B. 0.85 C. 0.90 D. 0.93
20.已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3
H2SO3
HClO
K1=4.30×10-7
K1=1.54×10-2
K=2.95×10-8
K2=5.61×10-11
K2=1.02×10-7
下列说法正确的是( )[
A.相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B.向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度
C.NaClO 溶液中通入少量CO2 2ClO- + CO2 + H2O = 2HClO + CO3 2-
D.Na2CO3溶液中通入少量SO2 2CO32- + SO2+ H2O = 2HCO3 - + SO3 2-
21.将某稀硫酸和稀硝酸的混合溶液200 mL平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是 ( )
A.混合酸中HNO3物质的量浓度为2 mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+3Fe2+, BC段产生氢气
C.原混合酸中H2SO4物质的量为0.4 mol
D.第二份溶液中最终溶质为FeSO4
二、实验题(4小题,共58分)
22.(15分)氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭在高温下制取氮化铝。 请回答下列问题:
(1) 请写出制取氮化铝的化学方程式______________________。
制得的AlN样品仅含有Al2O3杂质,已知:AlN+NaOH+ H2O==NaAlO2+ NH3↑ 为测定AlN含量,设计如下三种实验方案。(测定过程均忽略NH3在强碱溶液中的溶解)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
实验步骤:组装好实验装置,检查装置气密性并加入实验药品,关闭K1,打开K2 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
(2)上图C装置中球形干燥管的作用是_____________。
(3)通入氮气的目的是_______________________________________。
(4)上图装置会导致测定结果__________(填“偏高”“偏低”或“无影响”)。
【方案2】用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
(5)为测定生成气体的体积,量气装置中的X液体可以是___________ (填字母)
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(6)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是__________。若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则最后测得AlN的质量分数会______(填“偏高”“偏低”或“无影响”)。
【方案3】按以下步骤测定样品中A1N的纯度:(过滤时使用无灰滤纸过滤)
(7)步骤②生成沉淀的离子方程式为___________________。
(8)样品中A1N的质量分数为 _______________ (用含m1 m2的代数式表示)。
23.(14分)乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种食用的补铁剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,受热易分解,可通过乳酸与碳酸亚铁反应制得。
CH3CH(OH)COOH+FeCO3+2H2O=[CH3CH(OH)COO]2Fe•3H2O+CO2↑
FeCO3不溶于水,易被氧化, 4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
Ⅰ.乳酸亚铁的制备:
某兴趣小组用FeCl2和NH4HCO3制备FeCO3的装置示意图如图
回答下列问题:
(1)C装置中涉及的主要反应的离子方程式 。
(2)待D 处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作
是 。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
加入少量铁粉的作用是 。
(4)反应结束后,无需过滤,除去过量铁粉的方法是 。
(5)从所得溶液中获得乳酸亚铁晶体的方法是: ,冷却结晶,过滤, 用适量乙醇洗涤,干燥.
Ⅱ.乳酸亚铁晶体纯度的测量:
(6)该兴趣小组用KMnO4滴定法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是 .
(7)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量,滴定反应如下:Ce4++Fe2+ = Ce3++Fe3+。取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500mol•L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数
滴定前读数(mL)
滴定后读数(mL)
1
0.20
19.95
2
0.10
21.65
3
0.95
20.60
则产品中乳酸亚铁的质量分数为 %.(小数点后保留一位数字)
(8)请设计实验证明你购买的乳酸亚铁补铁剂中含Fe2+: .
24.(14分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
(1)写出溶解过程中产生无色气体的化学式:_________
(2)还原过程中发生的主要反应的离子方程式:__________________________________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃ 干燥2h,冷
却密封包装。70℃, 真空干燥、密封包装的原因是:______________________________。
(4)滤液中主要成分是(NH4)2SO4,工业上用(NH4)2SO4与(AL)2(SO4)3制取铵明矾,铵明矾在食品,制革等方面有重要用途,写出铵明矾的化学式________________
(5)随着PH值减小[Cu2(OH)4-nCln]中Cu% ________。(填字母)
A. 增大 B.不变 C. 不能确定 D. 减小
(6)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃ 时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是________________________________。
(7)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:__________________________________。
25.(14分)钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
请回答下列问题:
(1)步骤I中发生反应的化学方程式________________________________________。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果______________;
若步骤II中浸出剂为硫酸,写出Co2O3与硫酸反应的化学方程式_____________________
(3)步骤Ⅲ 中 ① 的目的是除去Al3+,②的目的是除去L i + ,写出除去L i + 的离子方程式
_________________________________。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有
_____________、_____________ (填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_______、过滤、洗涤、干燥。
用75%酒精代替蒸馏水洗涤,其优点是_____________________________________。
参考答案及评分标准
一.选择题(本题包括21小题,每小题2分,共42分,每小题只有一个选项符合题意。)
1
2
3
4
5
6
7
8
9
10
11
B
C
C
D
C
B
B
D
D
B
D
12
13
14
15
16
17
18
19
20
21
A
C
C
C
D
C
C
A
D
C
(说明:方程式没有配平不得分,没写条件或沉淀符号或气标只扣1分)
二、实验题(4小题,共58分)
22.(15分)
(1)Al2O3+3C+N22AlN+3CO (2分)
(2)防倒吸 (1分)
(3)把装置中残留的氨气全部导入C装置 (2分)
(4)偏高(1分)
(5)AD (2分)
(6)41V/22400m×100% (2分) 偏低(1分)
(7)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ (2分)
(8)41(m2 - m1 )/10 m1 (2分)
23.(15分)
(1)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O (2分)
(2)关闭活塞3,打开活塞2(2分)
(3)防止Fe2+被氧化;(1分)
(4)加适量的乳酸,让铁粉反应完全;(2分)
(5)隔绝空气,低温蒸发(2分)
(6)乳酸根中羟基被高锰酸钾溶液氧化(2分)
(或者乳酸根被高锰酸钾溶液氧化;或者是晶体失去了部分结晶水)(任何一条都给分)
(7)98.5(2分)
(8)取少量乳酸亚铁补铁剂于试管中加蒸馏水溶解,滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色,证明补铁剂中含Fe2+(其他合理答案也给分)(2分)
24. (14分)
(1)NO (2分)
(2)2Cu2++SO32-+2Cl-+ H2O=2CuCl↓+SO42-+2H+(2分)
(3) 加快乙醇和水的挥发,防止CuCl在潮湿的空气中水解氧化 (2分)
(4)NH4 Al(SO4)212H2O (2分)
(5)D(2分)
(6)温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气反应 (2分) (7) Cu2++e-+Cl-=CuC l↓ (2分)
25(14分)
(1)2Al + 2NaOH+2H2O=2NaAlO2+ 3H2↑、2L i + 2H2O=2 L i OH + H2↑(各1分)
(2)产生有毒气体氯气,污染环境 (2分), 2Co2O3 +4 H2SO4=4CoSO4 + O2↑+ 4H2O(2分)
(3)L i ++F - = L i F ↓(2分)
(4)坩埚(1分) 泥三角 (1分)
(5)蒸发浓缩 (1分) 冷却结晶 (1分) 减少晶体的溶解损失,酒精挥发带走水分(2分)
学校 班级 姓名 座号 准考号: .
--
-------密………封…………装…………订………线----------
. .
2019-2020学年第一学期永泰一中期中考
高中三年 化学科试卷
考试时间:8:00-9:30 完卷时间:90分钟 满分:100分
可能用到的相对原子质量: P—31 N—14 O—16 Cl—35.5 S—32 Al—27 Fe—56
Mn —55 K —39 Cu —64
一、选择题(每题只有一个正确选项,每题2分,21小题,共42分)
1.习总书记多次强调要“像对待生命一样对待生态环境”。下列说法正确的是( )[
A.赤潮是海水富营养化,藻类大量繁殖,这些藻类生长消耗大量氧气,造成水体缺氧
B.汽车尾气的大量排放是造成雾霾天气的人为因素之一
C.用施撒熟石灰的方法可改良碱性土壤
D.用明矾可消除水中Cu2+等重金属离子污染
2.化学与人类生产、生活密切相关,下列说法正确的是( )[
A. 医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
B. 铁粉和生石灰均可作食品袋内的脱氧剂
C. 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
D. 高纤维食物是富含膳食纤维的食物,在人体内都可通过水解反应提供能量
3.下列说法正确的是( )[
A.液态 HCl、固态 AgCl 均不导电,所以 HCl、AgCl 是非电解质
B.NH3、CO2 的水溶液均能导电,所以 NH3、CO2 均是电解质
C.福尔马林、水玻璃、氨水均为混合物
D.金属氧化物一定是碱性氧化物
4.设NA为阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA
B.阿伏加德罗常数的基准物是0.012kg的C
C.1L 0.1 mol.L-1的NaHCO3 溶液中HCO3- 和CO32- 离子数之和为0.1NA
D. 31克白磷含有的共价键数目为1.5 NA
5.V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是 ( )
A. 通入标准状况下的HCl气体11.2V L
B. 将溶液加热浓缩到0.5V L
C. 加入10 mol.L-1的盐酸0.1V L,再稀释至1.5V L
D. 加入V L 1.5 mol.L-1的盐酸混合均匀
6.下列实验操作规范且能达到目的的是( )[
目的
操作
A
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶
B
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D
配制浓度为0.010的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
7.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是( )
A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
8.下列除杂的方法错误的是( )
9.从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 则关于该反应的说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5mol FeS2发生反应,有10mol电子转移
C.FeS2只作还原剂
D.产物中的SO42- 离子有一部分是氧化产物
10.下列物质转化在给定条件下能实现的是( )
①SiO2Na2SiO3H2SiO3
②FeFe2O3Fe2(SO4)3
③BaSO4BaCO3BaCl2
( Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9 )
④AlCl3溶液AlNaAlO2
⑤HCHOHCOOHHCOOCH3
A.①②⑤ B.①③⑤ C.②④⑤ D.②③④
11.下列制Cl2并用其氧化含I-废液,回收提纯I2的装置和原理能达到实验目的的是( ) [
A. A B. B C. C D. D
12.下列离子方程式正确的是( )
A.酸性硫酸亚铁溶液在空气中被氧化: 4Fe2++O2+4H+=4Fe3++2H2O
B.硫酸铵溶液和氢氧化钡溶液反应: Ba2++SO42- = BaSO4↓
C.碳酸氢钠溶液和过量的澄清石灰水混合:2HCO3- +Ca2++2OH﹣= CaCO3↓+CO32-+2H2O
D.酸化的NaIO3和NaI的混合溶液:I-+IO3-+6H+ = I2+3H2O
13.下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②碱性溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣
④加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥含Fe2+的溶液中:Na+、Ba2+、Cl﹣、I﹣
A.①② B.②③ C.②⑥ D. ②⑤⑥
14.用下面的方案进行某些离子的检验,其中方案设计严密的是( )[
A.检验试液中的SO42-
B.检验试液中的Fe2+
C.检验试液中的I-
D.检验试液中的CO32-
15.下列实验操作对应的现象和根据现象得出的结论均正确的是 ( )[
实验操作
现象
结论
A
向FeCl3溶液中加入浓NaOH溶液
溶液由黄色变为红棕色
生成了氢氧化铁胶体
B
向Co2O3中滴入浓盐酸加热
产生黄绿色气体
氧化性:Cl2>Co2O3
C
向某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
溶液中存在亚铁离子
D
向NaHCO3溶液中滴加NaAlO2溶液
有白色沉淀和气体产生
AlO2-与HCO3-发生了水解的相互促进
16. SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
A. Cu和浓硝酸 B. CaO和浓氨水
C. 高锰酸钾溶液和浓盐酸 D. 大理石和稀盐酸
17.生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。利用烟道气中的SO2生产Na2S2O5的工艺为:
下列说法正确的是( )
A.pH=4.1时,Ⅰ中为Na2 SO3溶液
B.Na2S2O5用作食品的抗氧化剂和SO2作漂白剂时,均表现还原性
C.工艺中加入Na2CO3固体、并再次充入SO2的目的是得到NaHSO3过饱和溶液
D.葡萄酒中Na2S2O5用作食品的漂白剂
18.海水是重要的资源,可以制备一系列物质。
下列说法正确的是( )
A.步骤②中,应先通 CO2,再通 NH3
B.步骤③中可将 MgCl2·6H2O 晶体在空气中直接加热脱水
C.除去粗盐中 SO42-、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:
NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
D.步骤④、⑤、⑥反应中,溴元素均被氧化
19.某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mlCl2,恰好将Fe2+ 完全氧化则x值为( )
A. 0.80 B. 0.85 C. 0.90 D. 0.93
20.已知常温下碳酸、亚硫酸、次氯酸的电离平衡常数如下表:
H2CO3
H2SO3
HClO
K1=4.30×10-7
K1=1.54×10-2
K=2.95×10-8
K2=5.61×10-11
K2=1.02×10-7
下列说法正确的是( )[
A.相同条件下,同浓度的 H2SO3溶液和 H2CO3溶液的酸性, 后者更强
B.向氯水中分别加入等浓度的 NaHCO3 和 NaHSO3溶液,均可提高氯水中 HClO 的浓度
C.NaClO 溶液中通入少量CO2 2ClO- + CO2 + H2O = 2HClO + CO3 2-
D.Na2CO3溶液中通入少量SO2 2CO32- + SO2+ H2O = 2HCO3 - + SO3 2-
21.将某稀硫酸和稀硝酸的混合溶液200 mL平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是 ( )
A.混合酸中HNO3物质的量浓度为2 mol·L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+3Fe2+, BC段产生氢气
C.原混合酸中H2SO4物质的量为0.4 mol
D.第二份溶液中最终溶质为FeSO4
二、实验题(4小题,共58分)
22.(15分)氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭在高温下制取氮化铝。 请回答下列问题:
(1) 请写出制取氮化铝的化学方程式______________________。
制得的AlN样品仅含有Al2O3杂质,已知:AlN+NaOH+ H2O==NaAlO2+ NH3↑ 为测定AlN含量,设计如下三种实验方案。(测定过程均忽略NH3在强碱溶液中的溶解)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
实验步骤:组装好实验装置,检查装置气密性并加入实验药品,关闭K1,打开K2 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。
(2)上图C装置中球形干燥管的作用是_____________。
(3)通入氮气的目的是_______________________________________。
(4)上图装置会导致测定结果__________(填“偏高”“偏低”或“无影响”)。
【方案2】用下图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
(5)为测定生成气体的体积,量气装置中的X液体可以是___________ (填字母)
A.CCl4 B.H2O C.NH4Cl溶液 D.苯
(6)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AlN的质量分数是__________。若其他操作均正确,但反应结束后读数时,右侧量气管中液面高于左侧球型管中液面,则最后测得AlN的质量分数会______(填“偏高”“偏低”或“无影响”)。
【方案3】按以下步骤测定样品中A1N的纯度:(过滤时使用无灰滤纸过滤)
(7)步骤②生成沉淀的离子方程式为___________________。
(8)样品中A1N的质量分数为 _______________ (用含m1 m2的代数式表示)。
23.(14分)乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种食用的补铁剂,吸收效果比无机铁好,易溶于水,几乎不溶于乙醇,受热易分解,可通过乳酸与碳酸亚铁反应制得。
CH3CH(OH)COOH+FeCO3+2H2O=[CH3CH(OH)COO]2Fe•3H2O+CO2↑
FeCO3不溶于水,易被氧化, 4FeCO3+6H2O+O2=4Fe(OH)3+4CO2
Ⅰ.乳酸亚铁的制备:
某兴趣小组用FeCl2和NH4HCO3制备FeCO3的装置示意图如图
回答下列问题:
(1)C装置中涉及的主要反应的离子方程式 。
(2)待D 处的气体纯净后,将生成的FeCl2溶液和NH4HCO3溶液混合时的操作
是 。
(3)将制得的FeCO3加入到足量乳酸溶液中,再加入少量铁粉,75℃下搅拌反应。
加入少量铁粉的作用是 。
(4)反应结束后,无需过滤,除去过量铁粉的方法是 。
(5)从所得溶液中获得乳酸亚铁晶体的方法是: ,冷却结晶,过滤, 用适量乙醇洗涤,干燥.
Ⅱ.乳酸亚铁晶体纯度的测量:
(6)该兴趣小组用KMnO4滴定法测定样品中亚铁含量进而计算产品中乳酸亚铁的质量分数,发现产品的质量分数总是大于100%,其原因可能是 .
(7)经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量,滴定反应如下:Ce4++Fe2+ = Ce3++Fe3+。取1.440g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.0500mol•L-1Ce(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数
滴定前读数(mL)
滴定后读数(mL)
1
0.20
19.95
2
0.10
21.65
3
0.95
20.60
则产品中乳酸亚铁的质量分数为 %.(小数点后保留一位数字)
(8)请设计实验证明你购买的乳酸亚铁补铁剂中含Fe2+: .
24.(14分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
(1)写出溶解过程中产生无色气体的化学式:_________
(2)还原过程中发生的主要反应的离子方程式:__________________________________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃ 干燥2h,冷
却密封包装。70℃, 真空干燥、密封包装的原因是:______________________________。
(4)滤液中主要成分是(NH4)2SO4,工业上用(NH4)2SO4与(AL)2(SO4)3制取铵明矾,铵明矾在食品,制革等方面有重要用途,写出铵明矾的化学式________________
(5)随着PH值减小[Cu2(OH)4-nCln]中Cu% ________。(填字母)
A. 增大 B.不变 C. 不能确定 D. 减小
(6)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃ 时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是________________________________。
(7)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:__________________________________。
25.(14分)钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
请回答下列问题:
(1)步骤I中发生反应的化学方程式________________________________________。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果______________;
若步骤II中浸出剂为硫酸,写出Co2O3与硫酸反应的化学方程式_____________________
(3)步骤Ⅲ 中 ① 的目的是除去Al3+,②的目的是除去L i + ,写出除去L i + 的离子方程式
_________________________________。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有
_____________、_____________ (填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_______、过滤、洗涤、干燥。
用75%酒精代替蒸馏水洗涤,其优点是_____________________________________。
参考答案及评分标准
一.选择题(本题包括21小题,每小题2分,共42分,每小题只有一个选项符合题意。)
1
2
3
4
5
6
7
8
9
10
11
B
C
C
D
C
B
B
D
D
B
D
12
13
14
15
16
17
18
19
20
21
A
C
C
C
D
C
C
A
D
C
(说明:方程式没有配平不得分,没写条件或沉淀符号或气标只扣1分)
二、实验题(4小题,共58分)
22.(15分)
(1)Al2O3+3C+N22AlN+3CO (2分)
(2)防倒吸 (1分)
(3)把装置中残留的氨气全部导入C装置 (2分)
(4)偏高(1分)
(5)AD (2分)
(6)41V/22400m×100% (2分) 偏低(1分)
(7)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ (2分)
(8)41(m2 - m1 )/10 m1 (2分)
23.(15分)
(1)Fe2++2HCO3-==FeCO3↓+CO2↑+H2O (2分)
(2)关闭活塞3,打开活塞2(2分)
(3)防止Fe2+被氧化;(1分)
(4)加适量的乳酸,让铁粉反应完全;(2分)
(5)隔绝空气,低温蒸发(2分)
(6)乳酸根中羟基被高锰酸钾溶液氧化(2分)
(或者乳酸根被高锰酸钾溶液氧化;或者是晶体失去了部分结晶水)(任何一条都给分)
(7)98.5(2分)
(8)取少量乳酸亚铁补铁剂于试管中加蒸馏水溶解,滴加几滴KSCN溶液,溶液不变色,再滴加新制氯水,溶液变成血红色,证明补铁剂中含Fe2+(其他合理答案也给分)(2分)
24. (14分)
(1)NO (2分)
(2)2Cu2++SO32-+2Cl-+ H2O=2CuCl↓+SO42-+2H+(2分)
(3) 加快乙醇和水的挥发,防止CuCl在潮湿的空气中水解氧化 (2分)
(4)NH4 Al(SO4)212H2O (2分)
(5)D(2分)
(6)温度过高,一是促进了CuCl的水解,二是促进了CuCl与空气中氧气反应 (2分) (7) Cu2++e-+Cl-=CuC l↓ (2分)
25(14分)
(1)2Al + 2NaOH+2H2O=2NaAlO2+ 3H2↑、2L i + 2H2O=2 L i OH + H2↑(各1分)
(2)产生有毒气体氯气,污染环境 (2分), 2Co2O3 +4 H2SO4=4CoSO4 + O2↑+ 4H2O(2分)
(3)L i ++F - = L i F ↓(2分)
(4)坩埚(1分) 泥三角 (1分)
(5)蒸发浓缩 (1分) 冷却结晶 (1分) 减少晶体的溶解损失,酒精挥发带走水分(2分)
相关资料
更多








