

第66讲 常见气体的实验室制备、净化和收集 (讲义+课件 2份打包)2025年高考化学总复习
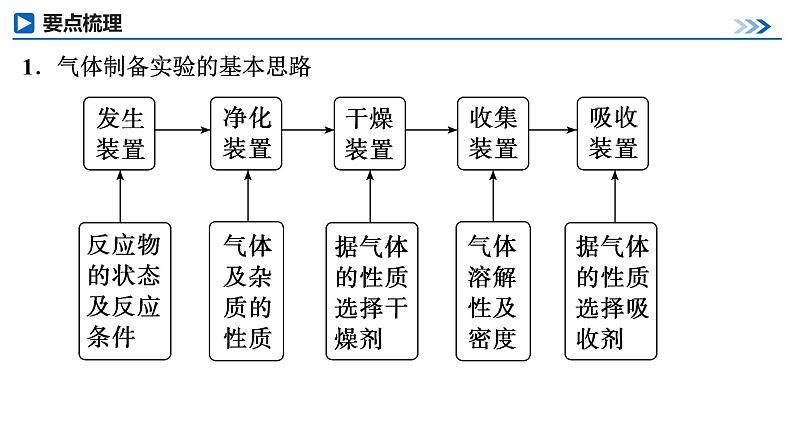
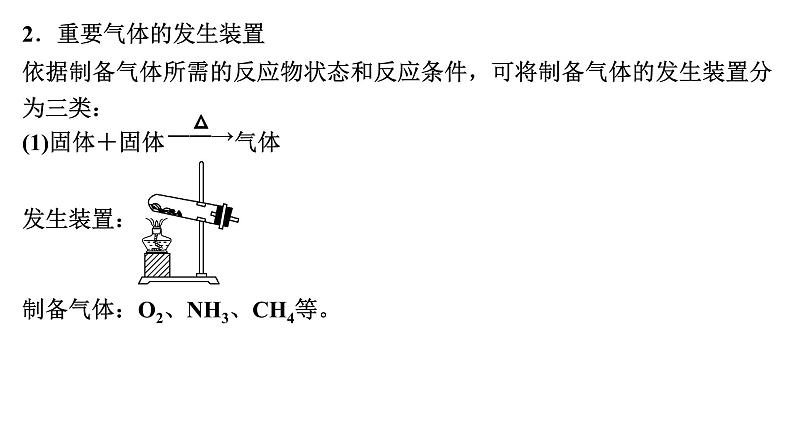
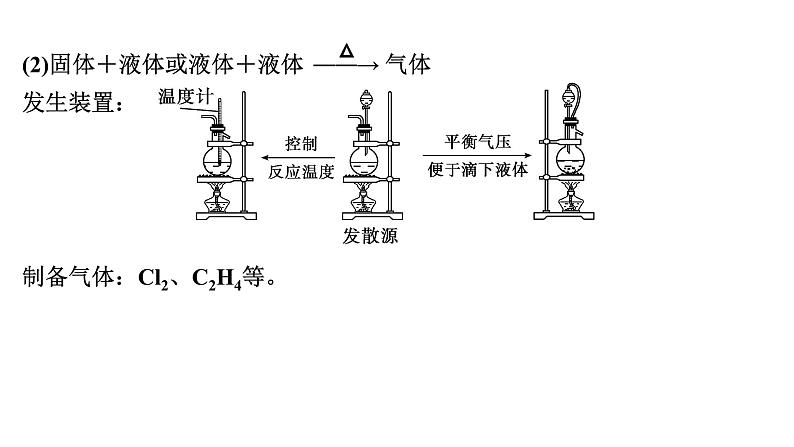
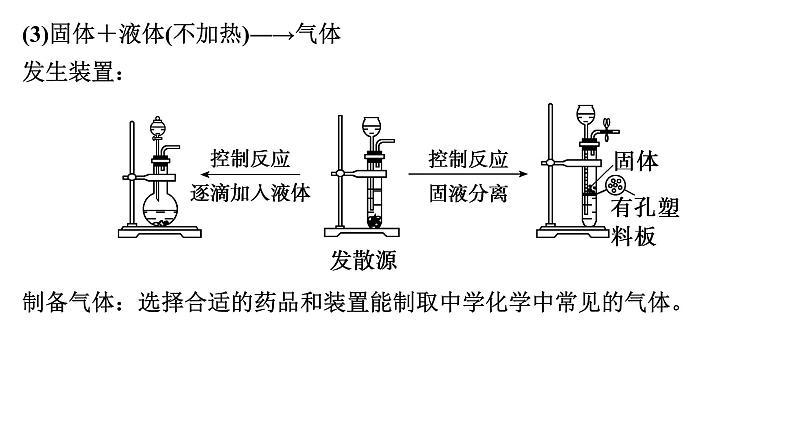
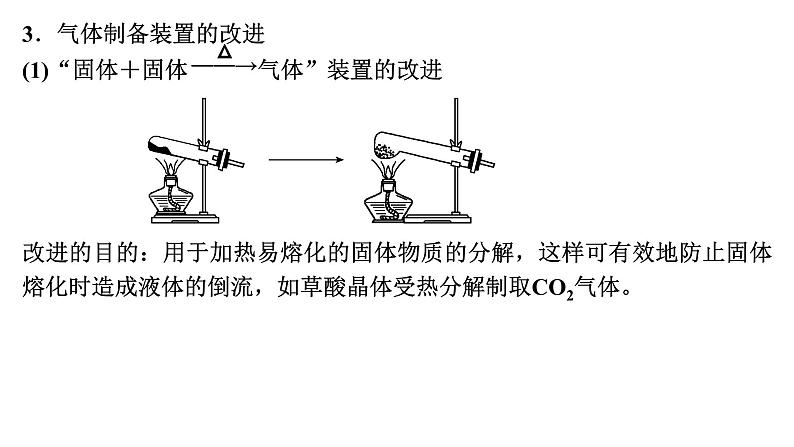
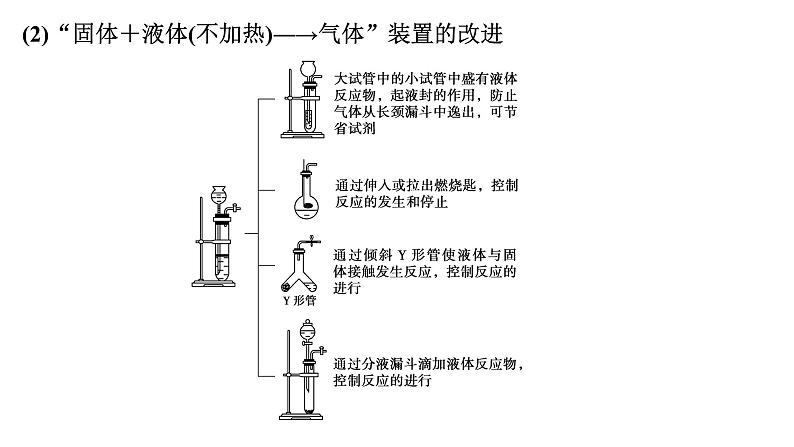
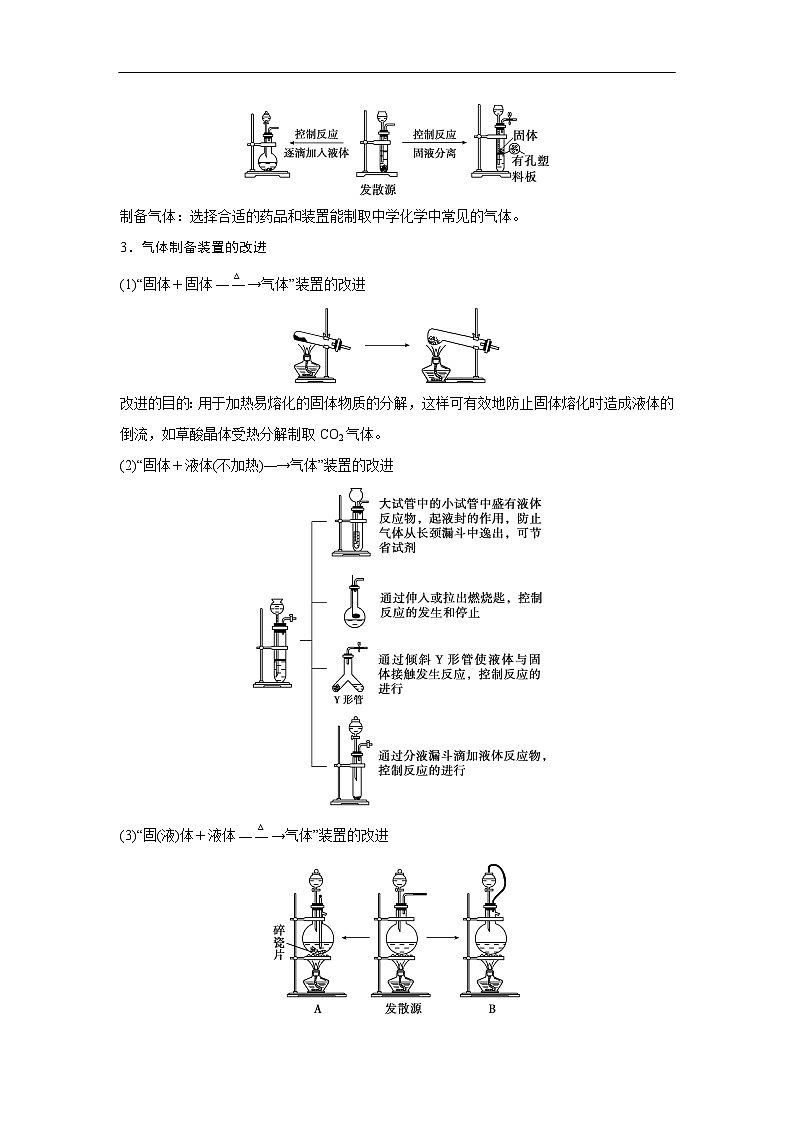
展开第66讲 常见气体的实验室制备、净化和收集第十章 化学实验基础课程标准1.了解常见气体制备原理、装置及改进。2.能根据气体的性质及制备原理设计实验流程。1.气体制备实验的基本思路2.重要气体的发生装置依据制备气体所需的反应物状态和反应条件,可将制备气体的发生装置分为三类:(1)固体+固体 气体发生装置: 制备气体:O2、NH3、CH4等。(2)固体+液体或液体+液体 气体发生装置:制备气体:Cl2、C2H4等。(3)固体+液体(不加热)―→气体发生装置:制备气体:选择合适的药品和装置能制取中学化学中常见的气体。3.气体制备装置的改进(1)“固体+固体 气体”装置的改进改进的目的:用于加热易熔化的固体物质的分解,这样可有效地防止固体熔化时造成液体的倒流,如草酸晶体受热分解制取CO2气体。(2)“固体+液体(不加热)―→气体”装置的改进(3)“固(液)体+液体 气体”装置的改进图A的改进优点是能控制反应液的温度。图B的改进优点是使圆底烧瓶和分液漏斗中的气体压强相等,便于液体顺利流下。4.气体的除杂方法(1)除杂试剂选择的依据:主体气体和杂质气体性质上的差异,如溶解性、酸碱性、氧化性、还原性。除杂原则:①不损失主体气体;②不引入新的杂质气体;③在密闭装置内进行;④先除易除的杂质气体。(2)气体干燥净化装置当CO2中混有O2杂质时,应选用上述Ⅰ~Ⅳ中的Ⅳ装置除O2,除杂试剂是Cu粉。5.气体的收集方法6.集气装置的创新——排液集气装置装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。若将广口瓶中的液体更换,还可以收集以下气体。①饱和食盐水——收集Cl2。②饱和NaHCO3溶液——收集CO2。③饱和NaHS溶液——收集H2S。④四氯化碳——收集HCl或NH3。装置(Ⅱ)储气式集气。气体从橡胶管进入,可将水由A瓶排入B瓶,在A瓶中收集到气体。7.尾气处理的原因、方法及装置(1)原因:有些气体有毒或有可燃性,任其逸散到空气中,会污染空气或者引发火灾、爆炸等灾害。(2)处理方法:一般根据气体的相关性质,使其转化为非气态物质或无毒物质,如酸性有毒气体用碱溶液吸收,可燃性气体用点燃等措施。(3)尾气处理装置(见下图a、b、c)①实验室制取Cl2时,尾气的处理可采用b装置。②制取CO时,尾气处理可采用a、c装置。③制取H2时,尾气处理可采用a、c装置。1.判断下列试剂使用是否正确,正确的打“√”,错误的打“×”。××××2.判断下列气体的吸收或收集方法是否正确,正确的打“√”,错误的打“×”。×××× (2023·全国乙卷)下列装置可以用于相应实验的是√Na2CO3受热不分解,即该装置不能用于制备CO2,A错误;乙醇和乙酸互溶,不能用分液的方式来分离乙醇和乙酸,B错误;SO2通入品红溶液中,品红溶液褪色,可证明SO2具有漂白性而不是酸性,C错误;量气管和水准管中液面高度相同时,O2排开的水的体积与O2的体积相等,即题图装置可用于测量O2体积,D正确。 (2022·广东卷)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是√浓盐酸易挥发,制备的氯气中含有HCl,可用饱和食盐水除去HCl,Cl2可用浓硫酸干燥,A装置能达到实验目的,故A不符合题意;氯气的密度大于空气,用向上排空气法收集,B装置能收集氯气,故B不符合题意;湿润的红布条褪色,干燥的红布条不褪色,可验证干燥的氯气不具有漂白性,C装置能达到实验目的,故C不符合题意;氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,D装置不能达到实验目的,故D符合题意。 (2021·海南卷)用如图装置制取干燥的气体(a、b表示加入的试剂),能实现的是√H2S与浓硫酸反应,故不能用浓硫酸干燥,故A错误;发生反应2H2O2 2H2O+O2↑,浓硫酸干燥氧气,故B正确;铁片和浓硝酸常温下发生钝化,故不能制取二氧化氮气体,故C错误;氨气与浓硫酸反应,故不能用浓硫酸干燥氨气,故D错误;故选B。考向一 气体的制备、净化和收集1.下列气体发生装置,当加入适当的块状固体和液体时不具有随开随关功能的是√A、B、C三个装置原理与启普发生器相似,均具有随开随关功能;而D装置关闭止水夹后,反应仍持续进行,不具有随开随关功能。2.根据实验目的设计的如下装置的连接中,正确的是A.制备收集C2H4:连接a→c→gB.制备收集NO:连接b→c→e→dC.制备收集NH3:连接b→d→e→cD.制备收集Cl2:连接a→f→c→e→d√制备C2H4没有控制温度的温度计,A错误;NO与O2反应,不能用排空气法收集,B错误;浓硫酸吸收多余的NH3,易发生倒吸,C错误;饱和食盐水除去HCl气体,浓硫酸吸收水蒸气,碱石灰吸收多余的Cl2,D正确。3.实验室合成硫酰氯要先制取干燥氯气。制备干燥纯净的氯气所用仪器如图:上述仪器的连接顺序:e接___,____接__,___接___,___接__(按气流方向,用小写字母表示)。dcabihg考向二 气体制备装置的改进与创新4.工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na3AlF6的装置图如图,下列叙述错误的是A.该装置均可采用由聚四氟乙烯材料制备的仪器B.装置Ⅰ发生的化学反应方程式为CaF2+H2SO4 CaSO4+2HF↑C.装置Ⅲ的作用是安全瓶,防止倒吸D.Na2CO3溶液和HF加入先后顺序,先加Na2CO3溶液再通HF气体√该装置均可采用由聚四氟乙烯材料制备的仪器,不能用普通玻璃,会被生成的HF腐蚀,A正确;装置Ⅰ为高沸点的硫酸制备低沸点的HF,发生的化学反应方程式为CaF2+H2SO4 CaSO4+2HF↑,B正确;HF易溶于水且会与氢氧化钠溶液反应,需要防倒吸,装置Ⅲ的作用是安全瓶,防止倒吸,C正确;先通HF气体溶解氢氧化铝,再加Na2CO3溶液,D错误。课 时 测 评√1.下列关于各实验装置及药品的叙述中,正确的是 A.装置①可用于实验室制取少量O2B.可用从左侧加水的方法检验装置②的气密性C.利用装置③验证铁的析氢腐蚀D.装置④随关随停制氨气二氧化锰催化过氧化氢制氧气为固液不加热反应,装置①可用于实验室制取少量O2,A正确;右侧为敞口体系,不能检验装置②的气密性,B错误;铁的析氢腐蚀需要较强的酸性环境,C错误;碱石灰中氧化钙和水生成粉末状氢氧化钙,隔板不起作用,D错误。√2.下列装置用于实验室中制取干燥氨气的实验,其中能达到实验目的的是 A.用装置甲制备氨气 B.用装置乙除去氨气中的少量水C.用装置丙收集氨气 D.用装置丁吸收多余的氨气浓氨水遇碱石灰放出氨气,实验室可以用装置甲制备氨气,故选A;浓硫酸和氨气反应生成硫酸铵,浓硫酸能吸收氨气,不能用浓硫酸干燥氨气,故不选B;体系密闭,若用装置丙收集氨气,空气无法排出,故不选C;氨气极易溶于水,漏斗口浸没在水中,若用装置丁吸收多余的氨气,导致倒吸,故不选D。√3.下列制备并收集气体的方法不可行的是 浓盐酸具有还原性,高锰酸钾具有强氧化性,两者发生氧化还原反应,可以生成氯气,而氯气在饱和食盐水中的溶解度比较低,故可以用排饱和食盐水法收集Cl2,故A不符合题意;氢氧化钠溶于水放热,且溶液中氢氧根离子浓度增大,导致氨气放出,因为氨气的密度比空气小,可以用向下排空气法收集,故B不符合题意;二氧化氮与水会发生反应,故不能用排水法收集二氧化氮,故C符合题意;铜与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫在亚硫酸氢钠溶液中溶解度比较小,故可以利用排饱和亚硫酸氢钠溶液法收集,故D不符合题意。√4.用如图所示装置制备并收集气体,其中合理的是稀盐酸和石灰石反应为固体和液体反应,二氧化碳的密度大于空气,故用长管进短管出的连接方式,故A正确;收集NH3,不能用向上排空气法收集,故B错误;一氧化氮气体易与氧气反应且密度与空气接近,故不能用排空气法收集,故C错误;氢气的密度小于空气,应该短管进长管出,故D错误。洗气气体从长导管进入液体中,短导管出,A正确;气体从导管处进入碱石灰中,经干燥后从另一头出,B正确;氨气极易溶于水,图示装置可有效防止倒吸,C正确;收集H2应该用排水法或者向下排空气法,图示装置错误,D错误。√5.下列实验操作不正确的是√6.实验室制取乙烯并验证其化学性质,下列装置正确的是用乙醇与浓硫酸混合液加热170 ℃,乙醇发生消去反应制备乙烯,要使用温度计测量溶液的温度,因此温度计的水银球要在溶液的液面以下,A错误;用NaOH溶液除去制取乙烯的杂质SO2、CO2时,导气管应该是长进短出,导气管连接顺序反了,B错误;乙烯若与Br2发生加成反应,反应产生1,2-二溴乙烷会溶解在四氯化碳中,使溶液橙色褪去,因此可以证明乙烯发生了加成反应,C正确;乙烯与空气密度非常接近,气体容易与空气混合,导致不能收集到纯净气体,因此不能使用排空气法收集,应该使用排水法收集,D错误。√7.碳酰氯(COCl2)俗名光气,熔点为-118 ℃,沸点为8.2 ℃,遇水迅速水解,生成氯化氢。光气可由氯仿(CHCl3)和氧气在光照条件下合成。下列说法错误的是A.装置丁中发生反应的化学方程式为2CHCl3+O2 2COCl2+2HClB.装置丙的主要作用是吸收尾气中的氯化氢C.丁中冰水混合物的作用是降温,防止COCl2挥发D.装置的连接顺序(装置可重复使用)应为c→a→b→e→f→a→b→d光气可由氯仿(CHCl3)和氧气在光照条件下合成,且光气遇水迅速水解,由实验装置可知,乙装置制备氧气,然后经甲干燥氧气,在装置丁中合成光气,丁后面需连接干燥装置防止水进入丁中,最后连接丙装置吸收尾气。装置丁中氯仿和氧气在光照条件下合成光气,反应的化学方程式为2CHCl3+O2 2COCl2+2HCl,故A正确;装置丁中生成氯化氢,氯化氢极易溶于水,倒扣的漏斗可防止倒吸,则装置丙的主要作用是吸收尾气中的氯化氢,故B正确;COCl2的沸点为8.2 ℃,沸点较低易挥发,则冰水混合物的作用是降温,防止COCl2挥发,故C正确;由上述分析可知,乙装置制备氧气,然后经甲干燥氧气,在装置丁中合成光气,丁后面需连接干燥装置防止水进入丁中,最后连接丙装置吸收尾气,则装置的连接顺序为c→b→a→e→f→b→a→d,故D错误。√8.用如图所示装置和相应试剂能达到实验目的的是A项,装置b中生成气体,说明硫酸的酸性强于碳酸,装置c中出现沉淀,说明碳酸的酸性强于硅酸,最高价氧化物对应的水化物的酸性越强,元素非金属性越强,即非金属性:S>C>Si,正确;B项,MnO2和浓盐酸反应,需要加热,此装置中没有加热装置,饱和食盐水除去氯气中的HCl,从装置c中出来的氯气中混有水蒸气,不是纯净的氯气,错误;C项,向装置b中加入盐酸,生成能使澄清石灰水变浑浊的气体,不能说√9.化学是以实验为基础的自然科学。下列实验操作规范且能达到实验目的的是A.利用图甲制备SO2气体B.利用图乙制备干燥的NO2C.利用图丙制备乙酸乙酯D.利用图丁装置制备、干燥、收集氨铜与浓硫酸反应需要加热,此装置没有加热仪器,故A错误;冷的浓硝酸与铁反应会发生钝化,不能用来制备二氧化氮气体,故B错误;饱和碳酸钠溶液可中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度,长颈漏斗的球状结构可防止倒吸,故C正确;生石灰溶于水放热且与水反应产生氢氧化钙,增大氢氧根离子浓度,促使氨水产生氨气,氨用碱石灰来干燥,用向下排空气的方法可以收集氨,但需要将导管伸入试管底部,故D错误。√10.NaClO是家用消毒液的有效成分,可通过Cl2与NaOH反应制得。NaClO能与CO2反应生成HClO。常温下ClO2为黄绿色有毒气体,易溶于水。ClO2体积分数大于10%或其水溶液在温度过高时可能发生爆炸,与碱反应生成ClO和ClO等。实验室制备ClO2的反应原理为2KClO3+H2C2O4+H2SO4===2ClO2↑+2CO2↑+K2SO4+2H2O。实验室用如图所示方法制备ClO2水溶液,下列说法不正确的是A.KClO3发生氧化反应 B.反应过程中需持续通入N2C.乙装置应置于冰水浴中 D.丙装置用于吸收ClO2尾气甲装置用来制备ClO2,反应原理为题中所给化学方程式,其中KClO3为氧化剂,草酸为还原剂。产生的ClO2进入乙装置中用水吸收得到其水溶液,丙装置的作用是吸收ClO2,防止污染空气。根据分析,KClO3为氧化剂,发生还原反应,A错误;ClO2的体积分数大于10%时可能发生爆炸,所以需要持续通入氮气稀释ClO2,B正确;ClO2水溶液在温度过高时可能发生爆炸,乙装置应置于冰水浴中,C正确;根据分析,丙装置用于吸收ClO2尾气,D正确。11.亚硝酰氯(ClNO)是有机物合成中的重要试剂,遇水反应生成一种氢化物和两种氧化物。某学习小组用Cl2和NO利用如图所示装置制备亚硝酰氯(ClNO),下列说法正确的是A.X装置可以随开随用,随关随停B.Y装置中的药品可以换成浓硫酸C.装入药品打开K2后,应先打开K1再打开K3D.若无装置Y,则Z中可能发生反应的化学方程式为2ClNO+H2O===2HCl+NO↑+N2O3↑√X装置打开K1,铜丝与硝酸接触反应生成的NO被排出。关闭K1,NO不溶于稀硝酸,将液面压到铜丝下方,反应停止,A项符合题意;Y装置中的药品若换成浓硫酸,则无法除去X中可能产生的NO2等杂质,且U形管装置盛装的干燥剂应为固体,B项不符合题意;实验时应先通入氯气赶走装置内的空气,防止NO被氧化为NO2,C项不符合题意;方程式未配平,N元素不守恒,D项不符合题意。12.(16分)某化学小组同学利用一定浓度的H2O2溶液制备O2。该小组同学设计了如下气体发生装置(夹持装置省略)。(1)甲装置中主要仪器的名称为____________________。分液漏斗、锥形瓶根据仪器构造可知,甲装置中主要仪器的名称为分液漏斗和锥形瓶。(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至_____________________。欲使反应停止,关闭活塞K1即可,此时装置中的现象是____________________________________________________。刚好没过MnO2固体试管内的H2O2溶液被压入长颈漏斗中,与MnO2分离乙装置是启普发生器的简易装置,可以随时控制反应的发生和停止。用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至刚好没过MnO2固体,此时可以产生氧气,氧气通过导管导出。欲使反应停止,关闭活塞K1,此时由于气体还在产生,使容器内压强增大,可观察到试管内的H2O2溶液被压入长颈漏斗中,与MnO2分离。(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是______________。液面上升打开弹簧夹K2丙装置用圆底烧瓶盛装H2O2溶液,可用于制备较多O2,催化剂铂丝可上下移动,可以控制反应速率。制备过程中如果体系内压强过大,H2O2溶液会被压入安全管中,可观察到安全管中液面上升,圆底烧瓶中液面下降。此时可以将铂丝抽离H2O2溶液,使反应速率减慢,还可以打开弹簧夹K2,使烧瓶内压强降低。(4)丙装置的特点是____(填字母)。a.可以控制制备反应的开始和结束b.可通过调节催化剂与液体接触的面积来控制反应的速率c.与乙装置相比,产物中的O2含量高、杂质种类少ab催化剂铂丝可上下移动,可以控制制备反应的开始和结束,a正确;催化剂与液体接触的面积越大,反应速率越快,可通过调节催化剂与液体接触的面积来控制反应的速率,b正确;丙装置用圆底烧瓶盛装H2O2溶液,与乙装置相比,可用于制备较多O2,但产物中的O2含量和杂质种类和乙中没有区别,c错误。13.(18分)二氯化钒(VCl2)有强还原性和吸湿性,熔点为425 ℃、沸点为900 ℃,是制备多种医药、催化剂、含钒化合物的中间体。某学习小组在实验室制备VCl2并进行相关探究。回答下列问题:(1)小组同学通过VCl3分解制备VCl2。①按气流方向,图中装置合理的连接顺序为_______________________________ (用小写字母填空)。a→c→b→d(e)→e(d)→f(g)→g(f)该实验通过VCl3分解制备VCl2,VCl2有强还原性和吸湿性,为防止VCl2被氧化、吸湿,所以要通入干燥的N2排尽装置中的空气;A装置中饱和NH4Cl溶液与NaNO2溶液共热反应制备N2,B装置中浓硫酸干燥N2,C装置中VCl3分解制备VCl2,D装置中碱石灰吸收反应生成的Cl2,防止污染。(1)①根据分析,按气流方向,图中装置的合理连接顺序为a→c→b→d(e)→e(d)→f(g)→g(f);②A中盛放NaNO2的仪器名称为__________,其中发生反应的离子方程式为_____________________________。蒸馏烧瓶N2↑+2H2O该实验通过VCl3分解制备VCl2,VCl2有强还原性和吸湿性,为防止VCl2被氧化、吸湿,所以要通入干燥的N2排尽装置中的空气;A装置中饱和NH4Cl溶液与NaNO2溶液共热反应制备N2,B装置中浓硫酸干燥N2,C装置中VCl3分解制备VCl2,D装置中碱石灰吸收反应生成的Cl2,防止污染。②根据A中盛放NaNO2溶液的仪器特点可知,其名称为蒸馏烧瓶;其中发生的反应为NH4Cl与NaNO2共热反应生成N2、NaCl和水,反应的离子方程式为NO +NH N2↑+2H2O;(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量1.377 5 g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.500 0 mol·L-1AgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为46.00 mL(Ag2CrO4为砖红色沉淀)。①滴定终点的现象为_________________________________________________________________________。滴入最后半滴AgNO3溶液时有砖红色沉淀生成,且半分钟内沉淀不溶解该实验通过VCl3分解制备VCl2,VCl2有强还原性和吸湿性,为防止VCl2被氧化、吸湿,所以要通入干燥的N2排尽装置中的空气;A装置中饱和NH4Cl溶液与NaNO2溶液共热反应制备N2,B装置中浓硫酸干燥N2,C装置中VCl3分解制备VCl2,D装置中碱石灰吸收反应生成的Cl2,防止污染。(2)①该滴定实验的原理为Ag++Cl-===AgCl↓,当Cl-完全反应,再滴入半滴AgNO3标准溶液,AgNO3与指示剂Na2CrO4作用产生砖红色沉淀,故滴定终点的现象为:滴入最后半滴AgNO3溶液时有砖红色沉淀生成,且半分钟内沉淀不溶解;②产品中VCl3与VCl2的物质的量之比为________。1∶10该实验通过VCl3分解制备VCl2,VCl2有强还原性和吸湿性,为防止VCl2被氧化、吸湿,所以要通入干燥的N2排尽装置中的空气;A装置中饱和NH4Cl溶液与NaNO2溶液共热反应制备N2,B装置中浓硫酸干燥N2,C装置中VCl3分解制备VCl2,D装置中碱石灰吸收反应生成的Cl2,防止污染。②根据滴定的原理,2n(VCl2)+3n(VCl3)=n(AgNO3)=0.500 0 mol/L×0.046 L,122 g/mol·n(VCl2)+157.5 g/mol·n(VCl3)=1.377 5 g,解得n(VCl2)=0.01 mol、n(VCl3)=0.001 mol,产品中VCl3与VCl2物质的量之比为0.001 mol∶0.01 mol=1∶10。谢 谢 观 看





