





人教版(2024)九年级下册(2024)实验活动8 常见酸、碱的化学性质教课内容课件ppt
展开
这是一份人教版(2024)九年级下册(2024)实验活动8 常见酸、碱的化学性质教课内容课件ppt,共30页。PPT课件主要包含了紫色石蕊溶液变红,澄清石灰水变浑浊,溶液由红色变为无色,氯化氢,硫酸的浓度,CaOH2,HCl等内容,欢迎下载使用。
1. (2024眉山) 下列物质能使紫色石蕊溶液变蓝的是( )A. KOH B. O2 C. NaCl D. CO2
2. (2024山东滨州模拟) 请根据如表和所学化学知识判断, 下列说法错误的是( ) A. pH>7的溶液不一定是碱溶液B. pH<7的溶液不一定是酸溶液C. 稀硫酸一定能使无色酚酞变红D. 碳酸钠溶液一定能使紫色石蕊溶液变蓝
【点拨】pH>7的溶液不一定是碱溶液, 如Na2CO3溶液为盐溶液, pH>7, 显碱性, A正确; pH<7的溶液不一定是酸溶液, 如FeCl3溶液为盐溶液, pH<7, 显酸性, B正确; 稀硫酸显酸性, 不能使无色酚酞变色, C错误; 碳酸钠溶液显碱性, 能使紫色石蕊溶液变蓝, D正确。
3. 用pH试纸测溶液的pH, 是某化学实验操作考查的题目之一。下列有关pH试纸的使用, 正确的是( )A. 把pH试纸浸入待测液B. 用湿润的玻璃棒蘸取待测液C. 把显色的pH试纸与标准比色卡对照读数D. 测出石灰水的pH为12. 4
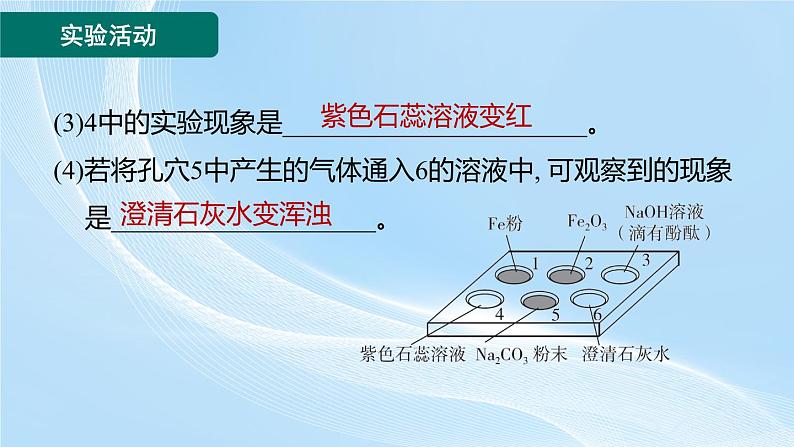
4. (2024北京东城区二模) 如图所示, 向孔穴1~5中滴加稀盐酸。(1)1、2中反应的化学方程式分别为________________________________________________。(2)3中溶液由红色变为无色, 可以得出的结论是________________________________。
Fe+2HCl===FeCl2+H2↑, Fe2O3+6HCl===2FeCl3+3H2O
氢氧化钠和稀盐酸发生了化学反应
(3)4中的实验现象是_______________________。(4)若将孔穴5中产生的气体通入6的溶液中, 可观察到的现象是____________________。
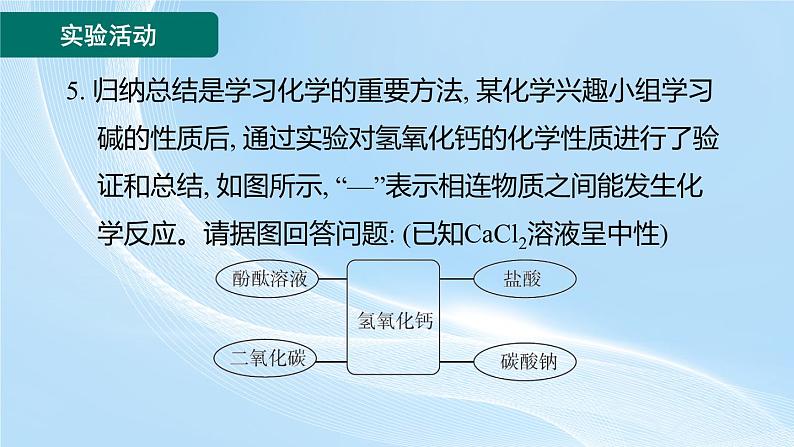
5. 归纳总结是学习化学的重要方法, 某化学兴趣小组学习碱的性质后, 通过实验对氢氧化钙的化学性质进行了验证和总结, 如图所示, “—”表示相连物质之间能发生化学反应。请据图回答问题: (已知CaCl2溶液呈中性)
(1)甲同学将酚酞溶液滴入氢氧化钙溶液中, 观察到溶液变红, 得出结论: 氢氧化钙溶液呈 (填“酸性”“碱性”或“中性”)。
(2)乙同学将过量的稀盐酸加入甲同学所得溶液中, 观察到的现象是 , 此时所得溶液中含有的溶质有 (酸碱指示剂除外)。
(3)将二氧化碳通入澄清的氢氧化钙溶液中, 发生反应的化学方程式为 。
CO2+Ca(OH)2===CaCO3↓+H2O
6. (2024长沙模拟) 我校初三化学小组的同学以“探究硫酸的性质”为主题开展项目式学习。【任务一】观察浓硫酸稀释过程中的能量变化。(1)图1实验中, 小明同学观察到用石蜡固定在铜片下的乒乓球脱落, 此现象说明浓硫酸溶于水 (填“放热”或“吸热”)。
【任务二】探究溶液浓度对硫酸化学性质的影响。(2)图2实验中, 小华同学观察到很快变黑的是滤纸B, 由此可知, _____________不同, 腐蚀性不同。
【任务三】探究稀硫酸的化学性质, 同学们按图3进行实验。(3)试管2中观察到的现象是________________________________________________ 。
红棕色固体逐渐溶解, 溶液由无色变成黄色
(4)实验结束后, 小红同学先将试管2中反应后的物质倒入废液缸中, 然后再将试管3反应后的物质缓慢倒入废液缸中, 观 察, 先无明显现象, 后出现红褐色沉淀; 再将试管4中剩余物质倒入废液缸中, 观察到沉淀消失。由此分析, 原试管2反应后溶液中的溶质为_________________(填化学式), 废液缸中最终剩余的溶液中一定含有的阳离子有______________(填离子符号)。
Fe2(SO4)3、H2SO4
Na+、K+、Fe3+
【反思】(5)实验过程中产生的废液必须处理后再排放。根据上述探究结果, 在检验废液时发现硫酸过量, 为防止其污染环境, 向该废液中加入适量的________ (填化学式), 使溶液呈中性后再排放。
【点拨】(4)试管2中氧化铁和稀硫酸反应生成硫酸铁和水, 试管3中氢氧化钠溶液和稀硫酸反应生成硫酸钠和水, 试管4中碳酸钾溶液和稀硫酸反应生成硫酸钾、二氧化碳和水。小红同学先将试管2中反应后的物质倒入废液缸中, 然后再将试管3反应后的物质缓慢倒入废液缸中, 观察, 先无明显现象, 后出现红褐色沉淀, 说明试管2中氧化铁和稀硫酸反应后有硫酸剩余, 试管3反应后氢氧化钠有剩余。
氢氧化钠先与硫酸反应, 后与硫酸铁反应, 导致先无明显现象, 后出现红褐色沉淀, 则原试管2反应后溶液中的溶质为硫酸铁和硫酸。再将试管4中剩余物质倒入废液缸中, 观察到沉淀消失, 说明试管4反应后硫酸也有剩余, 该硫酸与沉淀氢氧化铁反应生成硫酸铁和水, 导致沉淀消失。综合以上分析, 废液缸中最终剩余的溶液中一定含有的溶质有硫酸钠、硫酸钾、硫酸铁, 则废液缸中最终剩余的溶液中一定含有的阳离子有Na+、K+、Fe3+。
7. 某化学兴趣小组同学在探究碱的化学性质时, 设计并完成了如图实验: 【实验探究一】Ⅰ. 向滴加有酚酞的NaOH溶液中慢慢滴入稀盐酸(如图1所示), 边滴加边振荡, 测得试管①中最终溶液的pH=2。
Ⅱ. 分别称取0. 5 g氢氧化钙粉末置于两支试管中, 各滴加2 mL水, 振荡; 再向试管②中加入2 mL水、试管③中加入2 mL稀盐酸(如图2所示), 振荡并观察现象。
Ⅲ. 向盛有氢氧化钠溶液的试管④中加入少量硫酸铜溶液, 振荡。静置后测得上层清液的pH=12, 继续向其中滴加几滴稀盐酸(如图3所示), 试管⑤中无明显现象。
(1)实验Ⅰ中, 能证明盐酸和氢氧化钠发生了化学反应的实验现象是 。试管①最终溶液中含有的溶质(酚酞除外)有 (填化学式)。
(2)实验Ⅱ中用水作对照实验, 其目的是_______________________________________________。(3)试管④中发生反应的化学方程式是__________________________________________。
排除水的影响, 证明盐酸与氢氧化钙发生了化学反应
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
【分析讨论】甲同学通过“试管⑤中无明显现象”得出“盐酸不能与Cu(OH)2发生反应”的结论。乙同学认为甲同学的结论不正确, 于是继续开展如下探究。
【实验探究二】取试管①反应后的溶液逐滴滴入试管⑤中, 直至过量, 边加边振荡。实验探究二中依次观察到的现象有: 溶液由无色变成红色, 然后由红色慢慢又变成无色, 接着蓝色沉淀逐渐消失, 溶液变为蓝色。
【结论】盐酸能与Cu(OH)2发生反应。【交流反思】(4)最终试管⑤溶液中大量存在的离子有_____________________________(填离子符号)。
Na+、Cu2+、H+、Cl-、SO42-
【点拨】(1)实验Ⅰ中, 能证明盐酸和氢氧化钠发生了化学反应的实验现象是溶液由红色变为无色, 氢氧化钠和盐酸反应生成氯化钠和水, 最终溶液pH=2, 显酸性, 说明盐酸过量, 则试管①最终溶液中含有的溶质(酚酞除外)有NaCl、HCl。(2)氢氧化钙在水中的溶解度不大, 为了排除盐酸中水对氢氧化钙溶解的影响, 设置对比实验, 加入等量的水, 排除水的影响, 证明盐酸与氢氧化钙发生了化学反应。
(3)试管④中氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜沉淀。(4)测得试管⑤清液的pH=12, 说明溶液显碱性, 存在氢氧化钠, 向试管⑤中滴加的几滴盐酸与氢氧化钠发生中和反应, 盐酸还没有与氢氧化铜沉淀反应, 所以向其中滴加几滴稀盐酸, 试管⑤中无明显现象, 所以试管⑤中存在的溶质是氯化钠、硫酸钠、氢氧化钠,
试管①中氢氧化钠与盐酸反应生成氯化钠和水, 最终溶液的pH=2, 盐酸过量, 所以试管①中的溶质是氯化钠和过量的氯化氢, 取试管①反应后的溶液逐滴滴入试管⑤中, 直至过量, 边加边振荡, 盐酸先与氢氧化钠反应生成氯化钠和水, 当滴加少量时, 盐酸反应完全, ⑤中氢氧化钠过量, 此时溶液由无色变成红色, 随着盐酸和氢氧化钠反应生成氯化钠和水, 氢氧化钠消耗完全, 溶液由红色又变成无色,
相关课件
这是一份初中化学人教版(2024)九年级下册(2024)实验活动8 常见酸、碱的化学性质图文课件ppt,共21页。
这是一份初中化学人教版(2024)九年级下册(2024)实验活动8 常见酸、碱的化学性质教课内容课件ppt,共24页。PPT课件主要包含了感悟新知,碱的化学性质,考向酸碱的化学性质,题型2酸的化学性质,FeCl3,产生白色沉淀,题型3碱的化学性质,OH-等内容,欢迎下载使用。
这是一份人教版(2024)九年级下册(2024)实验活动8 常见酸、碱的化学性质精品教学课件ppt,文件包含核心素养《实验活动8常见酸碱的化学性质》课件PPTpptx、核心素养《实验活动8常见酸碱的化学性质》教学设计docx、核心素养《实验活动8常见酸碱的化学性质》同步分层练习docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。









