初中化学人教版(2024)九年级上册(2024)课题2 化学方程式学案及答案
展开
这是一份初中化学人教版(2024)九年级上册(2024)课题2 化学方程式学案及答案,共32页。学案主要包含了化学方程式及意义,化学方程式的书写,根据信息书写化学方程式等内容,欢迎下载使用。
第1课时 化学方程式的意义和书写
板块导航
01/学习目标 明确内容要求,落实学习任务
02/思维导图 构建知识体系,加强学习记忆
03/知识导学 梳理教材内容,掌握基础知识
04/效果检测 课堂自我检测,发现知识盲点
05/问题探究 探究重点难点,突破学习任务
06/分层训练 课后训练巩固,提升能力素养
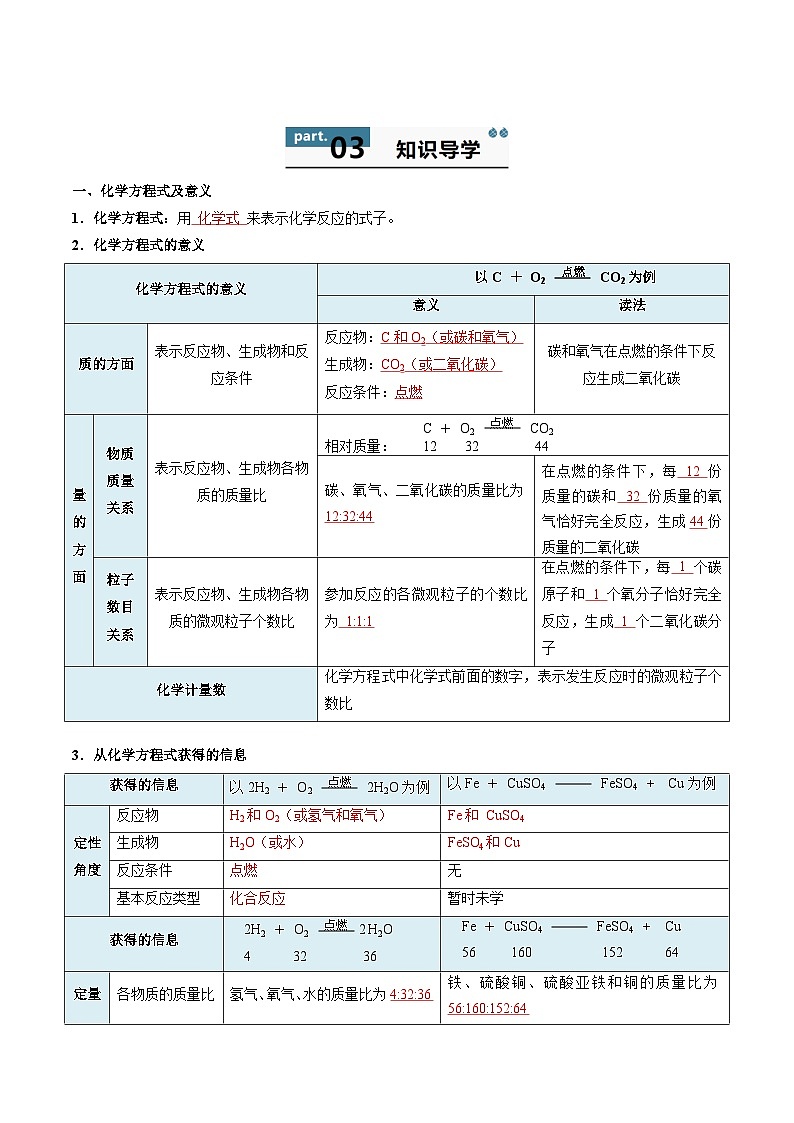
一、化学方程式及意义
1.化学方程式:用 化学式 来表示化学反应的式子。
2.化学方程式的意义
3.从化学方程式获得的信息
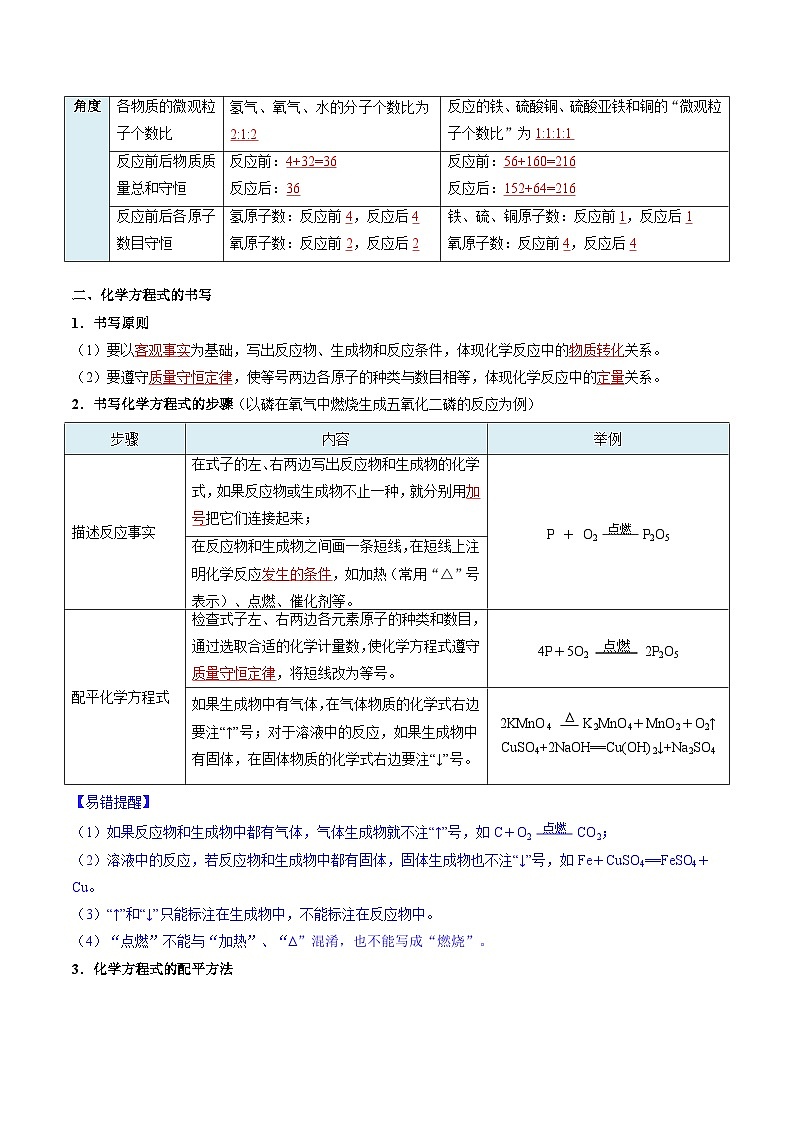
二、化学方程式的书写
1.书写原则
(1)要以客观事实为基础,写出反应物、生成物和反应条件,体现化学反应中的物质转化关系。
(2)要遵守质量守恒定律,使等号两边各原子的种类与数目相等,体现化学反应中的定量关系。
2.书写化学方程式的步骤(以磷在氧气中燃烧生成五氧化二磷的反应为例)
【易错提醒】
(1)如果反应物和生成物中都有气体,气体生成物就不注“↑”号,如C+O2 点燃 CO2;
(2)溶液中的反应,若反应物和生成物中都有固体,固体生成物也不注“↓”号,如Fe+CuSO4==FeSO4+Cu。
(3)“↑”和“↓”只能标注在生成物中,不能标注在反应物中。
(4)“点燃”不能与“加热”、“∆”混淆,也不能写成“燃烧”。
3.化学方程式的配平方法
三、根据信息书写化学方程式
1.根据文字信息书写化学方程式
从文字表述中找出反应物、生成物和反应条件,然后配平。
典例:写出下列与氢气有关的反应的化学方程式。
(1)在1200~1300 ℃时,三氯化硼(BCl3)蒸气与干燥、纯净的氢气反应可制得单质硼(B)和氯化氢:
2BCl3+3H2 1200~1300 ℃ 2B+6HCl 。
(2)氢化钙(CaH2)固体是一种储氢材料,能与水反应生成氢氧化钙和氢气:
CaH2+2H2O=== Ca(OH)2+2H2↑ 。
【易错提醒】
(1)反应条件要严格按照题给信息书写,不能擅自改动。如“1200℃”不能写成“高温”;“一定条件”、“催化剂”、“高温高压”等都要原文照抄,不可改动。
(2)关注反应物和生成物的状态,考虑是否需要添加气体符号和沉淀符号。
2.根据微观反应示意图书写化学方程式
(1)恰好完全反应时
典例:二氧化碳转化为甲醇的微观示意图如图所示,请回答:
写出该反应的化学方程式:CO2+3H2 一定条件 CH4O+H2O。
【易错提醒】
不能根据图上数出来的分子或原子个数直接作为化学计量数(化学方程式中化学式前面的数字),化学计量数一定要化为最简整数比。
反应物有剩余时
反应剩余的分子,不能写入化学方程式。反应后的图示中有与反应前图示中相同的某分子(原子)模型,说明该物质有剩余,但在写化学方程式时,生成物中不能出现该物质的化学式。一般可在反应前后的示意图上,先将相同的分子(原子)模型一对一地划去,然后再写化学方程式。
典例:某反应的微观示意图如图所示,请回答:
写出该反应的化学方程式:2CO+O2 点燃 2CO2 。
【易错提醒】
在反应前后的示意图上,划去相同的分子(原子)模型时一定要一对一,也就是反应前后划去的分子(原子)模型要相等。
(3)只给出各物质的一个分子(原子)型
根据给出的模型,写出反应物和生成物及反应条件,然后自己配平。
典例:A和B在某种催化条件下反应生成C和D。反应的微观示意图如图所示,请回答:
写出该反应的化学方程式:2H2S+SO2 催化剂 3S+2H2O 。
1.判断题
(1)书写化学方程式要遵守两个原则:一是必须要以客观事实为基础;二是要遵守质量守恒定律。( )
(2)根据化学方程式能获得的信息是:反应中的反应物和生成物;各反应物、生成物之间的质量比;反应发生所需要的条件。( )
(3)由化学方程式可以看出一个化学反应的反应物、生成物和反应条件。( )
(4)一个化学方程式不仅表示了该化学反应的事实,还表示了反应中各物质之间的质量关系。( )
(5)根据化学方程式,可知参加反应的各粒子的相对数量( )
(6)书写化学方程式时,当反应物中有气体时,生成物中的气体不用标“↑”。( )
(7)只有生成物中有气体生成,一定要使用“↑”。( )
(8)根据化学反应方程式不能获得的信息是:化学反应的快慢( )
(9)点燃和燃烧是同一意思,所以反应条件两者可以随便使用。( )
(10)铁在氧气中剧烈燃烧:4Fe+3O22Fe2O3.( )
(11)只要反应中如有气体放出、沉淀生成,都须用符号标明。( )
(12)乙醇燃烧:C2H5OH+O2═CO2+H2O( )
(13)化学方程式S+O2SO2叙述的是一个硫原子加一个氧分子等于两个水分子( )
(14)电解水的化学方程式是( )
(15)有关的反应前后固体质量不变( )
(16)化学方程式S+O2SO2叙述的是1g硫磺和2g氧气反应生成3g二氧化硫( )
(17)化学方程式是正确的( )
(18)化学方程式4Fe+3O22Fe2O3 是正确的( )
(19)根据化学方程式:,可以判断:反应前后氧原子和氢原子的数目没变( )
(20)书写化学方程式时,在式子左右两边的化学式前要配上适当的化学计量数,使化学反应前后每一种元素的原子总数相等。( )
【答案】(1) √ (2) √ (3) √ (4) √ (5) √ (6) √ (7) × (8) √ (9) × (10) × (11) × (12)× (13) × (14) × (15) × (16) × (17) × (18) × (19)√ (20) √
2.根据化学方程式书写原则,分析下列化学方程式违背了什么原则:
(1)违背了 ;
(2)违背了 。
【答案】(1)客观事实
(2)质量守恒定律
【详解】(1)铁和氧气在点燃的条件下反应,生成四氧化三铁(Fe3O4),不是氧化铁(Fe2O3),所以该化学方程式违背了客观事实;故答案为:客观事实;
(2)由该化学方程式可知,反应前后氧原子的数目不相等,所以该化学方程式违背了质量守恒定律;同时在书写化学方程式时,应注意反应前反应物中没有气体参与,反应后有气体生成时,应在该气体后标记气体符号;故答案为:质量守恒定律。
3.请从Fe、KMnO4、O2、H2、P中选择适当物质,按要求写出化学方程式。
(1)化合反应(产物常温下呈液态) ;
(2)分解反应(产物有三种) ;
(3)放出大量白烟的反应 ;
(4)火星四射的反应 。
(配平以下化学方程式)
(5) CH4+ O2 CO2+ H2O
(6) C2H5OH+ O2 CO2+ H2O
(7) CO+ Fe2O3 Fe+ CO2
(8) NaOH+ CO2= Na2CO3+ H2O
【答案】 2H2+O2 2H2O 2KMnO4 K2MnO4+MnO2+O2↑
4P+5O22P2O5 3Fe+2O2Fe3O4 1 2 1 2 1 3 2 3 3 1
2 3 2 1 1 1
【详解】(1) 因为产物常温下呈液态,则为水,故为氢气燃烧的化学方程式:2H2+O2 2H2O;
(2)产物有三种的分解反应,则为KMnO4分解:2KMnO4 K2MnO4+MnO2+O2↑;
(3)放出大量白烟的反应,则为红磷燃烧的反应:4P+5O22P2O5;
(4)火星四射的反应为铁丝在氧气中燃烧的反应:3Fe+2O2Fe3O4;
(5)选择定1法配平:先选取最复杂的化学式CH4将其化学计量数定位1,其中C原子的数目为1,H原子的数目为4,所以化学式CO2的化学计量数为1,化学式H2O的化学计量数为2,此时双横线后O原子的数目为4,则化学式O2的化学计量数为2,所以四种物质的化学计量数从前向后依次为1、2、1、2,故填1、2、1、2;
(6)选择定1法配平:先选取最复杂的化学式C2H5OH将其化学计量数定位1,其中C原子的数目为2,H原子的数目为6,O原子的数目为1,所以化学式CO2的化学计量数为2,化学式H2O的化学计量数为3,此时双横线后O原子的数目为7,双横线前化学式C2H5OH含有1个氧原子,则化学式O2的化学计量数为3,所以四种物质的化学计量数从前向后依次为1、3、2、3,故填1、3、2、3;
(7)本题可从得失氧的角度配平,一个CO分子反,应中获得一个氧原子变为二氧化碳分子,由于一个Fe2O3分子中氧原子的数目为3个,所以CO与CO2前面的化学计量数都为3,最后配平其它元素的原子,Fe2O3、Fe前面的化学计量数分别为1、2,故填3、1、2、3;
(8)本题可利用“定一 法”进行配平,把Na2CO3的化学计量数定为1,则CO2、NaOH、H2O前面的化学计量数分别为:2、1、 1、1
4.化学在交通“节能减排”中发挥了重要作用。
(1)液化石油气(LNG)是洛阳市正在推广的公交车燃料。它具有燃烧效率高、污染小的优点。写出天然气主要成分(CH4)完全燃烧的化学方程式: 。
(2)汽车尾气中NO与CO在催化剂的作用下,反应生成CO2和一种无污染的单质气体。写出该反应的化学方程式: 。
(3)氢化镁(MgH2)固体与水反应生成氢氧化镁和氢气,可为氢动力汽车提供能源。写出该反应的化学方程式: 。
【答案】 CH4+2O2CO2+2H2O 2NO+2CO2CO2+N2 MgH2+2H2O===Mg(OH)2+2H2↑
【详解】(1)天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为:CH4+2O2CO2+2H2O;
(2)汽车尾气中NO与CO在催化剂的作用下,反应生成CO2和一种无污染的单质气体(由质量守恒定律,反应前后元素种类不变,该气体是氮气),反应的化学方程式为:2NO+2CO2CO2+N2;
(3)氢化镁(MgH2)固体与水反应生成氢氧化镁和氢气,该反应的化学方程式为:MgH2+2H2O═Mg(OH)2+2H2↑。
►问题一 化学方程式的意义
【典例1】北京冬奥会火炬“飞扬”采用液氢作为燃料,真正做到了零排放、零污染。氢气燃烧的化学方程式为2H2+O22H2O,从中获得的信息错误的是
A.氢气和氧气在点燃的条件下生成水
B.在点燃条件下,2份质量的氢气和1份质量的氧气反应生成2份质量的水
C.反应前后原子的种类、数目均不变
D.在点燃条件下,每2个氢气分子和1个氧气分子反应生成2个水分子
【答案】B
【详解】A、等号左边为反应物,右边为生成物,等号上面为反应条件,则由方程式可知,氢气和氧气在点燃的条件下生成水,该选项正确;
B、根据化学方程式可知,,则每4份质量的氢气与32份质量的氧气反应生成36份质量的水,该选项不正确;
C、由方程式可知,反应前后原子的种类、数目均不变,该选项正确;
D、化学式前面的系数也可表示微粒个数关系,即在点燃条件下,每2个氢气分子和1个氧气分子反应生成2个水分子,该选项正确。
故选B。
【解题必备】
化学方程式表示的含义:
定性(质的方面):反应物、生成物、反应条件
定量(量的方面):物质的质量比、物质的微观粒子个数比
【变式1-1】如图,四位同学正在讨论某一个化学方程式表示的意义。下列四个化学方程式中,同时符合这四位同学所描述的是( )。
A.S+O2 点燃 SO2B.C+O2 点燃 CO2
C.2H2+O2 点燃 2H2OD.2C+O2 点燃 2CO
【答案】C
【解析】A、反应条件是点燃,微观粒子个数比是1:1:1.物质的质量比为:32:32:64=1:1:2,故A错误;
B、反应条件是点燃,微观粒子个数比是1:1:1.物质的质量比为:12:32:44=3:8:11,故B错误;
C、反应条件是点燃,微观粒子个数比是2:1:2.物质的质量比为:4:32:36=1:8:9,故C正确;
D、反应条件是点燃,分子个数比为:2:1:2,质量比为24:32:56=6:8:14,故D错误。
故选C。
【变式1-2】在一密闭的容器中。一定质量的硫粉与过量的氧气在点燃的条件下充分反应,容器内各相关量与时间(从反应开始计时)的对应关系正确的是
A. B. C. D.
【答案】A
【详解】A、由于,反应前氧气为气体,反应后二氧化硫为分子,则气体分子个数反应前后不变,该选项正确;
B、根据质量守恒,生成的二氧化硫气体的质量等于硫和氧气的质量之和,则气体质量增大,该选项不正确;
C、反应过程中,硫质量不断减少直至减为零,该选项不正确;
D、反应前后,物质的总质量不变,该选项不正确。
故选A。
►问题二 常见化学方程式的书写
【典例2】下列化学方程式中,正确的是( )。
A.C+O2CO2B.2HgOHg2+O2↑
C.4Fe+3O22Fe2O3D.4P+5O22P2O5
【答案】D
【解析】A、碳和氧气在点燃的条件下生成二氧化碳,反应的化学方程式为:,故选项错误;
B、氧化汞加热分解生成汞和氧气,反应的化学方程式为:,故选项错误;
C、铁和氧气在点燃的条件下生成四氧化三铁,反应的化学方程式为:,故选项错误;
D、磷和氧气在点燃的条件下生成五氧化二磷,反应的化学方程式为:,故选项正确;
故选D。
【解题必备】
书写化学方程式时,一定要检查:1、化学式的正误;2、是否配平;3、有没没加反应条件;4、有没有标注生成物的状态。
【变式2-1】写出下列要求的化学方程式:
(1)生成有刺激性气味气体的燃烧反应 。
(2)一种金属在氧气中燃烧生成一种黑色固体 。
(3)燃烧产生浓厚白烟的反应 。
(4)一种液体与一种黑色固体混合制氧气 。
【答案】(1)
(2)
(3)
(4)
【详解】(1)硫在氧气中燃烧生成二氧化硫,二氧化硫是具有刺激性气味的气体,该反应的化学方程式为:;
(2)铁是一种金属,铁在氧气中燃烧生成黑色固体四氧化三铁,该反应的化学方程式为:;
(3)红磷燃烧生成五氧化二磷,产生大量白烟,该反应的化学方程式为:;
(4)过氧化氢溶液是液体,二氧化锰是黑色固体,过氧化氢溶液和二氧化锰混合,过氧化氢在二氧化锰的催化下分解生成水和氧气,该反应的化学方程式为:;
【变式2-2】写出下列反应的化学方程式,并在括号内注明基本反应类型。
(1)电解水: 。( )反应
(2)过氧化氢溶液中加入二氧化锰: 。( )反应
(3)高锰酸钾制取氧气: 。( )反应
(4)钠在氯气中燃烧: 。( )反应
【答案】 2H2O2H2↑+O2↑ 分解 2H2O22H2O+O2↑ 分解 2KMnO4K2MnO4+MnO2+O2↑ 分解 2Na+Cl22NaCl 化合
【分析】(1)一个正确的化学方程式必须做到:化学式正确、已经配平、注明反应条件、气体符号等使用正确没有遗漏;
(2)由多种物质发生反应生成一种物质的化学变化是化合反应,由一种物质发生反应生成多种物质的化学变化是分解反应。
【详解】(1)电解水生成氢气和氧气,一种物质生成多种物质,是分解反应;2H2O2H2↑+O2↑。
(2)过氧化氢溶液中加入二氧化锰生成水和氧气,一种物质生成多种物质,是分解反应;2H2O22H2O+O2↑。
(3)高锰酸钾加热生成氧气、二氧化锰、锰酸钾,一种物质生成多种物质,是分解反应;2KMnO4K2MnO4+MnO2+O2↑。
(4)钠在氯气中燃烧生成氯化钠,多种物质生成一种物质,化合反应; 2Na+Cl22NaCl。
►问题三 化学方程式的配平
【典例3】配平或写出下列化学方程式:
(1) 。
(2) 。
【答案】(1) 3 2 4 3
(2) 1 6 2 3
【解析】(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,Fe2O3、CO2前面的化学计量数分别为:2、3,最后调整碳、铁前面的化学计量数为3、4;
(2)本题可利用“定一法”进行配平,把Al2O3的化学计量数定为1,则HCl、AlCl3、H2O前面的化学计量数分别为:6、2、3。
【解题技巧】
1.最常用的配平方法:观察法、最小公倍数法
2.化学方程式配平没有固定的方法,可以视情况将各种方法联合应用。如:对于含碳氢氧元素的有机物燃烧化学方程式的配平,可综合采用定一法和分数法。
【变式3-1】配平下列反应的化学方程式(化学计量数为1也要填上)。
① Al+ O2 Al2O3
② C2H4+ O2 CO2+ H2O
③ Fe2O3+ CO Fe+ CO2
④ Na2SO4+ BaCl2= NaCl + BaSO4↓
【答案】4 3 2 1 3 2 2 1 3 2 3 1 1 2 1
【详解】①该方程式用最小公倍数配平,以氧原子为参照原子,把氧原子个数配成6个,再观察配平其他原子,配平后该反应的化学方程式为:,故填:4;3;2。
②该方程式用定1法配平,把C2H4的化学计量数定位1,观察配平其他原子,配平后该反应的化学方程式为:,故填:1;3;2;2。
③该方程式用观察法配平,配平后该反应的化学方程式为:,故填:1;3;2;3。
④该方程式用观察法配平,配平后该反应的化学方程式为:,故填:1;1;2;1。
【变式3-2】配平以下化学方程式(系数“1”要填写,配平完要划上等号):
(1) 。
(2) 。
(3) 。
(4) 。
【答案】(1) 2 1 1 1
(2) 2 9 6 6
(3) 1 4 3 4
(4) 2 1 3 4
【解析】(1)观察化学方程式可知,NaHCO3前的计量数为2,其余物质前的计量数为1,化学方程式即可配平,化学方程式为:2;
(2)设C3H6的计量数为1,根据碳原子守恒,则CO2的系数为3,再根据氢原子守恒,则H2O的系数为3,最后根据氧原子守恒,则O2前的系数为,扩大两倍将化学方程计量数化为整数,化学方程式为:2966;
(3)观察化学方程式可知,该反应的实质是一氧化碳夺取四氧化三铁中的氧元素,生成二氧化碳,四氧化三铁失去氧元素生成铁,每个四氧化三铁分子有4个氧原子需4个一氧化碳分子,形成4个二氧化碳分子,因此化学方程式为:434;
(4)设N2O4的计量数为1,根据氧原子守恒,则H2O的系数为4,再根据氢原子守恒,则N2H4的系数为2,最后根据氮原子守恒,则N2前的系数为3,因此化学方程式为:2N2H4+N2O4 3N2+4H2O。
►问题四 根据信息书写化学方程式
【典例4】第十九届亚运会秉持着“绿色、智能、节俭、文明”的办会理念。燃料创新使用“零碳甲醇燃料”,即通过二氧化碳和氢气在一定条件下生成甲醇(CH3OH)和一种常见的液体,该反应的化学方程式为 。
【答案】
【解析】(1)二氧化碳和氢气在一定条件下反应生成甲醇和一种常见的液体,根据质量守恒定律,化学反应前后,元素的种类不变,反应物中含C、H、O,生成物中也应含C、H、O,故生成的常见液体是水,该反应的化学方程式为:。
【解题必备】
1.根据题目的文字表述,找准反应物、生成物和反应条件;
2.反应条件严格按照题目信息书写,不能擅自改动。若题目条件指向不明确,则根据题目表述书写,如出现“一定条件”、“一定温度和压强”“催化剂”等,则将这些条件直接写等号上方即可。
【变式4-1】按要求完成下列反应的化学方程式。
(1)氢化钠是一种白色固体,化学式是NaH,它与水反应生成氢氧化钠和氢气。该反应的化学方程式是
(2)高级汽车中常配置一种汽车安全气囊,内部贮存有硝酸铵。当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生大量一氧化二氮气体和另一种氧化物充满气囊,隔在乘员和挡风玻璃、方向盘之间,防止乘员受伤。写出硝酸铵受撞击后发生分解的化学方程式
【答案】(1)NaH+H2O=NaOH+H2↑
(2)NH4NO3N2O↑+2H2O
【详解】(1)氢化钠和水反应生成氢氧化钠和氢气,反应的化学方程式:NaH+H2O=NaOH+H2↑;
(2)由题意,当汽车高速行驶中受到猛烈撞击时,硝酸铵迅速分解产生的大量一氧化二氮(N2O)气体和水蒸气,反应的化学方程式为:NH4NO3N2O↑+2H2O。
【变式4-2】哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH4ClO4)混合物做为固体燃料,加热铝粉使其被氧气氧化,放出大量的热,促使混合物中高氯酸铵受热分解。同时生成四种气体:一种气体是空气中的主要成分,一种气体是氯气(Cl2)还有一种气体是化合物(常温下是液态)因而产生巨大的推动力。试写出其中涉及反应的化学方程式:
(1)铝粉被氧气氧化成三氧化二铝: 。
(2)高氯酸铵受热分解: 。
【答案】 4Al+3O2 2Al2O3 2NH4ClO4N2↑+2O2↑+Cl2↑+4H2O↑
【详解】(1)铝粉被氧气氧化成三氧化二铝:4Al+3O2 2Al2O3;
(2)高氯酸铵受热分解:2NH4ClO4N2↑+2O2↑+Cl2↑+4H2O↑。
►问题五 根据微观示意图书写化学方程式
【典例5】硫化氢(H2S)是一种有毒气体。如图是硫化氢和氧气在点燃条件下反应的微观示意图,该反应的化学方程式 。
【答案】 2H2S+3O22SO2+2H2O
【解析】由反应的微观示意图可知,该反应是硫化氢和氧气在点燃条件下发生反应生成了二氧化硫和水,反应的化学方程式是:2H2S+3O22SO2+2H2O。
【解题必备】
1.微观示意图上若各种物质都有多个分子,则注意根据图示写出的化学方程式中化学计量数要约简。
2.反应前后若有相同的分子且分子数减少,表示该反应物有剩余,可以先划去相同数目的该分子;
3.反应前后各种物质的分子模型只出现一次,则根据模型写出反应物和生成物及反应条件后,还需要配平。
【变式5-1】质量守恒定律是化学由定性走向定量的第一步,请回答下列问题:
(1)电解食盐水可制烧碱:,则X的化学式为 。
(2)如图是某反应的微观示意图。
①写出该反应的化学方程式 。
②通过上述变化可得出,化学变化的实质是 。
【答案】(1)Cl2
(2)
在化学变化中,分子分解成原子,原子重新构成新的分子
【详解】(1)由质量守恒定律:反应前后,原子种类、数目均不变,反应前氯、钠、氧、氢原子个数分别为2、2、2、4,反应后的生成物中氯、钠、氧、氢原子个数分别为0、2、2、4,根据反应前后原子种类、数目不变,则每个X分子由2个氯原子构成,则物质X的化学式为Cl2;
(2)①由图可知,甲为NH3,乙为O2,丙为NO,丁为H2O,氨气和氧气在催化剂和加热的条件下反应生成一氧化氮和水,化学方程式为:;
②通过上述变化以及微粒的变化可得出,化学变化的实质是在化学变化中,分子分解成原子,原子重新构成新的分子。
【变式5-2】清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化为液体燃料甲醇,其微观示意图如图所示。
(1)写出该反应的化学方程式: 。
(2)求两种生成物的质量比: 。
【答案】(1)
(2)16:9/9:16
【详解】(1)根据微观示意图可知,二氧化碳与氢气在催化剂作用下加热,反应生成甲醇和水,该反应的化学方程式为。
故填:。
(2),根据化学方程式可知,两种生成物的质量比=32:18=16:9或两种生成物的质量比=18:32=9:16。故填:16:9或9:16。
►问题六 根据化学方程式推测化学式
【典例6】银器在使用过程中逐渐失去光泽是因为发生了化学反应:4Ag+O2+2H2S=2X+2H2O。根据质量守恒定律可推测X是
A.Ag2SB.Ag2SO4C.SO2D.SO3
【答案】A
【详解】根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Ag、O、H、S的个数分别是4、2、4、2,生成物中含Ag、O、H、S的个数分别是0、2、4、0,故生成物中还应含4个Ag、2个S,故X的化学式为:Ag2S。
故选A。
【解题必备】
依据反应前后原子是种类和数目不变,将反应前后各原子数目依次列出,找出所求化学式中各种原子数目;
若所求化学式前面有化学计量数,则计算出的原子个数需要除以计量数,所得的值就是化学式中原子是数目。
【变式6-1】 “84”消毒液可用于灾区防疫,其主要成分是次氯酸钠(NaClO),制取它的化学方程式为2NaOH+X═NaClO+NaCl+H2O,则X的化学式为 .求出NaClO中氯元素化合价并在该化学式中表示出来 .
【答案】 Cl2
【详解】根据化学反应前后,各原子种类和原子个数不变,可知X的化学式为Cl2;根据化合物中各元素正负化合价代数和为0解答,元素化合价标在元素符号正上方。
解:由反应的化学方程式2NaOH+X═NaClO+NaCl+H2O,反应后NaClO、NaCl、H2O所含Na、Cl、H、O原子个数为2、2、2、2,而反应前2NaOH仅含2个Na原子、2个H原子、2个O原子,根据反应前后原子种类、个数不变,反应物X的分子由2个Cl原子构成,则物质X的化学式为Cl2;假设Cl化合价为X,列式为:+1+X+(-2)=0,X=+1,在该化学式中表示为:。
【变式6-2】三氧化铬()常用于金属镀铬,工业上制造三氧化铬的化学方程式为,其中X的化学式是
A.B.C.D.
【答案】C
【详解】根据化学反应前后原子的种类和数目不变,反应物中含有2个Na,2个Cr,7个O,1个X,生成物中含有2个Cr,11个O,2个Na,1个S,2个H,则X中含有2个H,1个S,4个O,故X为H2SO4。
故选C。
1.关于化学方程式的描述中正确的是
A.乙烯加氧气在点燃的条件下等于二氧化碳和水
B.1个乙烯和3个氧气在点燃的条件下生成2个水和2个二氧化碳
C.1个乙烯分子和3个氧分子在点燃的条件下生成2个水分子和2个二氧化碳分子
D.乙烯和氧气在点燃的条件下生成水和二氧化碳
【答案】C
【详解】A、该反应可表示乙烯和氧气在点燃的条件下反应生成二氧化碳和水,在化学方程式中,“+”读作“和”,“=”读作生成,不符合题意;
B、由化学方程式可知,该反应可表示1个乙烯分子和3个氧分子在点燃的条件下反应生成2个水分子和2个二氧化碳分子,不符合题意;
C、由化学方程式可知,该反应可表示1个乙烯分子和3个氧分子在点燃的条件下反应生成2个水分子和2个二氧化碳分子,符合题意;
D、该反应可表示,28份质量的乙烯和96份质量的氧气在点燃的条件下反应生成36份质量的水和88份质量的二氧化碳,不符合题意。
故选C。
2.过氧化钠因能与二氧化碳反应生成氧气,故可作为呼吸面具中氧气的来源,从下列化学方程式:“”中获得的信息,不正确的是
A.过氧化钠和二氧化碳反应生成碳酸钠和氧气
B.此反应中氧元素有两种化合价
C.这一原理不适宜在实验室制取纯净的氧气
D.参加反应的二氧化碳与反应生成的氧气分子个数比为
【答案】B
【详解】A、由化学方程式可知,该反应可表示为过氧化钠和二氧化碳反应生成碳酸钠和氧气,不符合题意;
B、过氧化钠中钠元素显+1价,根据化合物中,正、负化合价的代数和为零,可得氧元素显-1价,二氧化碳和碳酸钠中氧元素均显-2价,氧气中氧元素化合价为0,故此反应中氧元素有三种化合价,符合题意;
C、该反应中有气体参与反应,会导致收集的氧气不纯,这一原理不适宜在实验室制取纯净的氧气,不符合题意;
D、由化学方程式可知,参加反应的二氧化碳与反应生成氧气的分子个数比为:2:1,不符合题意。
故选B。
3.下列化学用语正确的是
A.汞元素hgB.五氧化二磷P5O2
C.钠离子Na-D.镁在氧气中燃烧的方程式
【答案】D
【详解】A.书写元素符号注意“一大二小”,汞的元素符号是Hg,故选项化学用语错误,不符合题意;
B.五氧化二磷的化学式为P2O5,故选项化学用语错误,不符合题意;
C.由离子的表示方法,在表示该离子的元素符号或原子团的右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个单位电荷时,1要省略,钠离子可表示为Na+,故选项化学用语错误,不符合题意;
D.镁和氧气点燃生成氧化镁,该化学方程式书写完全正确,故选项化学用语正确,符合题意,故选:D。
4.拉瓦锡在研究空气成分时,将氧化汞(HgO)收集后加强热,反应的微观示意图如图所示。下列说法错误的是
A.从反应类型看:该反应属于分解反应
B.从表示方法看:该反应的化学方程式为2HgOHg2+O2↑
C.从微观构成看:分子和原子均可直接构成物质
D.从守恒关系看:反应前后原子的种类、数目不变
【答案】B
【详解】A、该反应符合“一变多”,属于分解反应,故A正确;
B、根据微观示意图可知,氧化汞加热生成汞和氧气,方程式中汞的化学式错误,正确的化学方程式为,故B错误;
C、分子、原子都可以直接构成物质,如:汞由汞原子构成,氧气由氧分子构成,故C正确;
D、由质量守恒定律可知,化学反应前后,原子的种类、数目、质量均不发生变化,故D正确。
故选B。
5.公共场所常用“84”消毒液进行环境消毒,其有效成分为次氯酸钠,若将它与“洁厕灵”(有效成分为盐酸)混合后,发生如下化学反应:,由此推知X的化学式为
A.B.C.D.
【答案】A
【详解】化学反应前后,原子的种类和个数不变,等号左边有1个钠原子、2个氢原子、3个氯原子和1个氧原子,等号右边除X外,有1个钠原子、3个氯原子,则X中含有2个氢原子和1个氧原子,化学式为H2O,故选A。
6.下列反应的化学方程式,书写正确的是
A.磷在空气中燃烧:
B.氧化汞加热分解:
C.硫在氧气中燃烧:
D.细铁丝在氧气中燃烧:
【答案】D
【详解】A.该化学方程式五氧化二磷的化学式书写错误,且配平错误,正确的化学方程式应为:,故不符合题意;
B.该化学方程式没有配平,缺少反应条件,正确的化学方程式应为:,故不符合题意;
C.该化学方程式反应物后面不需要标注↑,氧气是气体,二氧化硫后面也不需要标注↑,正确的化学方程式应为:,故不符合题意;
D.铁和氧气点燃生成四氧化三铁,该化学方程式书写完全正确,故符合题意;
故选D。
7.“宏观一微观一符号”三重表征是化学独特的表示物质及其变化的方法。在一定条件下,甲酸(常温下为液体)可以发生反应,反应的微观示意图如下所示,该反应的化学方程式书写正确的是
A.B.
C.D.
【答案】D
【详解】根据题目叙述,甲酸(常温下为液体)在一定条件下发生反应,产生氢气和二氧化碳气体,则方程式是;
故选D。
8.乙醇作为一种清洁能源,已成为各国可再生能源的发展重点之一。下图为乙醇充分燃烧的微观示意图,下列有关该区应的说法正确的是( )。
A.反应生成丙和丁的分子个数比是2:3
B.反应前后原子种类发生改变
C.反应前后各元素的化合价均没有变化
D.该反应中共涉及到三种氧化物
【答案】A
【解析】A、根据反应的微观图示可知该反应的化学方程式为C2H5OH+3O22CO2+3H2O,则生成物丙(CO2)与丁(H2O)的分子个数比为2:3,故选项说法正确;
B、根据反应的图示分析可知反应前后原子的种类不发生改变,都为C、H、O,故选项说法错误;
C、该反应中C化合价由-2价变为+4价,H化合价没有发生变化,O化合价由0价变为-2价,故选项说法错误;
D、氧化物是指由两种元素组成,且其中一种为氧元素的化合物;则CO2、H2O属于氧化物,共涉及到2种氧化物,故选项说法错误。
故选A。
9.在化学方程式中,各化学式系数之间的关系正确的是
A.2m=aB.3a=nC.3m=2nD.2b=2m+n
【答案】D
【详解】在化学方程式中,反应前C原子有a个,反应后C原子有m个,所以a=m;
反应前H原子有4a个,反应后H原子有2n个,所以,4a=2n;
反应前O原子有2b个,反应后O原子有2m+n,所以,2b=2m+n;
配平后化学方程式为;a=1,b=2,m=1,n=2;
A、根据以上分析,2m=2a,不符合题意;
B、根据以上分析,2a=n,不符合题意;
C、根据以上分析,2m=n,不符合题意;
D、根据以上分析,2b=2m+n,符合题意;
故选D。
10.写出下列反应的化学方程式:
(1)铝在氧气中燃烧生成三氧化二铝 。
(2)甲烷(CH4)在空气中燃烧生成二氧化碳和水 。
(3)水煤气法制氢气:用焦炭(主要成分是碳单质)为原料与水蒸气在高温时反应制得氢气和二氧化碳 。
(4)镁在高温下与TiCl4反应生成Ti和氯化镁 。
【答案】(1)
(2)
(3)
(4)
【详解】(1)铝在氧气中燃烧生成三氧化二铝,反应的化学方程式为:;
(2)甲烷(CH4)在空气中燃烧生成二氧化碳和水,反应的化学方程式为:;
(3)碳和水蒸气在高温时反应生成氢气和二氧化碳,反应的化学方程式为:;
(4)镁在高温下与TiCl4反应生成Ti和氯化镁,反应的化学方程式为:。
11.配平或写出下列化学方程式:
(1) 。
(2) 。
(3)汽车尾气中的一氧化氮与一氧化碳在催化剂的作用下,反应生成二氧化碳和一种无污染的单质气体。写出该反应的化学方程式: 。
(4)氧化铁固体高温时会分解成四氧化三铁和一种气体,写出该反应的化学方程式: 。
【答案】(1) 3 2 4 3
(2) 1 6 2 3
(3)
(4)
【解析】(1)利用最小公倍数法进行配平,以氧原子作为配平的起点,Fe2O3、CO2前面的化学计量数分别为:2、3,最后调整碳、铁前面的化学计量数为3、4;
(2)本题可利用“定一法”进行配平,把Al2O3的化学计量数定为1,则HCl、AlCl3、H2O前面的化学计量数分别为:6、2、3;
(3)汽车尾气中的一氧化氮与一氧化碳在催化剂的作用下,反应生成二氧化碳和一种无污染的单质气体,由质量守恒定律,反应前后元素种类不变,生成的单质气体是氮气,反应的化学方程式为;
(4)氧化铁固体高温时会分解成四氧化三铁和一种气体,由质量守恒定律,反应前后元素种类不变,生成的气体是氧气,反应的化学方程式为。
12.观察下列在一定条件下发生的化学反应的微观示意图:
(1)如图中,生成物的化学式是 。
(2)上述反应过程中,发生反应的物质与所生成物质的微粒个数之比为 。
【答案】(1)
(2)
【分析】根据图示可知,反应前的微观粒子有3个氧分子和3个二氧化硫分子,反应后还剩2个氧分子和1个二氧化硫分子,生成新分子是2个三氧化硫分子,因此该反应是二氧化硫和氧气在一定条件下反应生成三氧化硫,化学方程式为:,据此解题。
【解析】(1)根据分析可知,生成的物质是三氧化硫,化学式是:;
(2)根据分析可知,发生反应的物质与所生成物质的微粒个数之比即二氧化硫、氧气、三氧化硫三种分子的个数比是:。
13. 完成下列各题:
(1)铜能与硝酸反应,但不产生H2.根据反应方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2X↑+4H2O,推测X的化学式是 。
(2)一些心脏病患者安装心脏起搏器,以在心跳骤停时刺激心脏,恢复心跳。一种用于心脏起搏器的锂电池,工作时发生的反应为4Li+2SOCl2=4LiCl+X+SO2↑,则X的化学式为 。
(3)实验室通常用浓盐酸和二氧化锰在加热的条件下制取氯气。反应的化学方程式为4HCl(浓)+MnO2MnCl2+2X+Cl2↑,则X的化学式为 。
(4)物质X是一种杀菌消毒效率高,二次污染小的水处理剂,制备该物质的原理是2KClO3+4HCl(浓)=2KCl+2X+Cl2↑+2H2O,则X的化学式为 。
(5)学校防控新冠肺炎所用消毒液成分之一是次氯酸钠,以下反应可生成次氯酸钠,Cl2+2NaOH=NaCl+X+H2O,其中X的化学式为 。
【答案】(1)NO
(2)S
(3)H2O
(4)ClO2
(5)NaClO
【详解】(1)根据质量守恒定律化学反应前后原子的种类和个数不变,反应前有3个Cu、8个H、8个N、24个O,反应后有3个Cu、8个H、6个N、22个O,所以2X中有2个N和2个O,那么X中有1个N和1个O,所以X的化学式为NO,故填:NO;
(2)根据质量守恒定律化学反应前后原子的种类和个数不变,反应前有4个Li、2个S、2个O、4个Cl,反应后有4个Li、4个Cl、1个S、2个O,则X中有1个S,所以X的化学式为S,故填:S;
(3)根据质量守恒定律化学反应前后原子的种类和个数不变,反应前有4个H、4个Cl、1个Mn、2个O,反应后有1个Mn、4个Cl,则2X中有4个H、2个O,那么X中有2个H、1个O,所以X的化学式为H2O,故填:H2O;
(4)根据质量守恒定律化学反应前后原子的种类和个数不变,反应前有2个K、6个Cl、6个O、4个H,反应后有2个K、4个Cl、4个H、2个O,则2X中有2个Cl、4个O,那么X中有1个Cl、2个O,所以X的化学式为ClO2,故填:ClO2;
(5)根据质量守恒定律化学反应前后原子的种类和个数不变,反应前有2个Cl、2个Na、2个O、2个H,反应后有1个Cl、1个Na、1个O、2个H,则X中有1个Cl、1个Na、1个O,所以X的化学式为NaClO,故填:NaClO。
1.下列有关“2CO+O22CO2”的说法,正确的是
A.若生成10gCO2,则消耗CO和O2的质量总和不一定是10g
B.若5gCO和2gO2混合点燃,则CO2生成的质量一定是7g
C.表示一氧化碳加氧气等于二氧化碳
D.参加反应的氧气与生成的二氧化碳的分子个数比为1:2
【答案】D
【详解】A、根据质量守恒定律可知,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,因此若生成10gCO2,则消耗CO和O2的质量总和一定是10g,说法错误,不符合题意;
B、根据,参加反应的一氧化碳、氧气的质量比为,若5gCO与2gO2混合点燃,则一氧化碳有剩余,消耗的一氧化碳的质量为3.5g,根据质量守恒定律可知,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,因此生成的CO2的质量小于7g,说法错误,不符合题意;
C、表示一氧化碳与氧气在点燃条件下反应生成二氧化碳,说法错误,不符合题意;
D、由化学方程式可知,参加反应的氧气与生成的二氧化碳的分子个数比为1:2,说法正确,符合题意。
故选:D。
2.下列化学方程式书写正确的是
A.木炭在氧气中燃烧:
B.乙炔在空气中充分燃烧:
C.铁丝在氧气中燃烧:
D.铝粉在空气中燃烧:
【答案】B
【详解】A、木炭在氧气中燃烧生成二氧化碳,化学方程式为,书写错误,不符合题意;
B、乙炔在空气中充分燃烧生成二氧化碳和水,化学方程式为,书写正确,符合题意;
C、铁在氧气中燃烧生成四氧化三铁,化学方程式为,书写错误,不符合题意;
D、铝在空气中燃烧生成氧化铝,化学方程式为,书写错误,不符合题意。
故选:B。
3.联氢()是运载火箭使用的燃料之一,该燃料与一氧化氮(NO)反应的化学方程式为,则X的化学式为
A.B.C.D.
【答案】C
【详解】根据质量守恒定律的元素守恒可知,原子的种类不变,原子的个数不变,反应前的原子为:氮原子4个、氢原子4个、氧原子2个;反应后的原子为:氢原子4个、氧原子2个,则2X中含有氮原子4个、故X的化学式为N2,故选C。
4.下列叙述、对应的化学方程式,所属基本反应类型都正确的是
A.测定水的组成:分解反应
B.镁在空气中燃烧:氧化反应
C.工业制氧气:分解反应
D.拉瓦锡研究空气的成分:化合反应
【答案】D
【详解】A、化学方程式未配平,正确的为:,故选项错误;
B、镁和氧气反应是氧化反应,但是氧化反应不是基本反应类型,应该是化合反应,故选项错误;
C、这是实验室制取氧气的方法,工业制取氧气是分离液态空气的方法,故选项错误;
D、拉瓦锡实验将汞和氧气一起加热,反应生成氧化汞,化学方程式正确,生成物只有1种,属于化合反应,化合反应是基本反应类型,故选项正确。
故选D。
5.下列化学方程式书写正确,且所含元素的化合价不发生变化的是
A.B.
C.D.
【答案】C
【详解】A、化学方程式书写错误,正确化学方程式:,镁、氧元素化合价发生改变,不符合题意;
B、化学方程式书写正确,锌由单质态变为化合态,化合价由零价变为+2,铜由化合态变为单质态,元素化合价由+2变为零价,化合价发生改变,不符合题意;
C、化学方程式书写正确,该反应属于复分解反应,符合“双交换价不变”的特点,元素化合价没有发生改变,符合题意;
D、化学方程式书写不正确,二氧化碳没标气体符号,反应物中钙元素为正二价,碳元素为正四价,氧元素为负二价,生成物中各元素化合价没有发生改变,不符合同意;
故选:C
6.铜不能溶于稀硫酸但能溶于稀硝酸,反应的化学方程式为:。下列有关说法正确的是
A.X的化学式是NOB.X的化学式是NO2
C.Cu(NO3)2中Cu的化合价为+5D.该反应属于分解反应
【答案】A
【详解】A、根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含Cu、H、N、O的个数分别是3、8、8、24,生成物中含Cu、H、N、O的个数分别是3、8、6、22,故生成物中还应含2个N、2个O,故X的化学式为:NO,符合题意;
B、由A的分析可知,X的化学式为:NO,不符合题意;
C、硝酸铜中硝酸根离子显-1价,根据化合物中,正、负化合价的代数和为零,可得铜元素显+2价,不符合题意;
D、分解反应是指由一种物质反应生成两种或两种以上新物质的反应,可以简单理解为“一变多”,该反应的反应物有两种,不属于分解反应,不符合题意。
故选A。
7.实验室用来加热的酒精灯,以酒精为燃料,酒精燃烧的化学方程式aC2H5OH+bO2cCO2+dH2O,各化学式前的化学计量数之间的关系不正确的是
A.a=2bB.b=dC.3a=dD.a+2b=2c+d
【答案】A
【详解】酒精燃烧的化学方程式aC2H5OH+bO2cCO2+dH2O,本题可利用“定一法”进行配平,把C2H5OH的化学计量数定为1,则O2、CO2、H2O前面的化学计量数分别为:3、2、3.即a=1,b=3,c=2,d=3。
A、a=1,b=3,a≠2b,故选项说法错误;
B、b=3,d=3,b=d,故选项说法正确;
C、a=1,d=3,3a=d,故选项说法正确;
D、a=1,b=3,c=2,d=3,a+2b=2c+d=7,故选项说法正确。
故选A。
8.我国天宫空间站常用水气整合系统消除空间的CO2,实现资源的循环利用。如图是CO2和H2在催化剂的作用下充分反应的微观示意图,下列说法正确的是
A.反应前后,原子的种类和数目都不变
B.参加反应的甲、乙分子个数比为1∶1
C.反应的化学方程式:CO2+H2=CH4+H2O
D.反应前后,催化剂的质量和性质不变
【答案】A
【分析】由反应的微观示意图可知,二氧化碳与氢气在催化剂作用下生成甲烷和水,反应的化学方程式为CO2+4H2CH4+2H2O。
【详解】A、该反应过程中有新物质生成,属于化学变化,根据质量守恒定律可知,反应前后,原子的种类和数目都不变,选项正确;
B、根据化学方程式可知,参加反应的甲、乙分子个数比为1∶4,选项错误;
C、反应的化学方程式:CO2+4H2CH4+2H2O,选项错误;
D、根据催化剂概念可知,反应前后,催化剂的质量和化学性质不变,物理性质可能改变,选项错误。
故选A。
9.一种新型合成氨(NH3)方法如图所示(Li是一种活泼金属)。下列说法正确的是
A.反应①、②分别为化合、分解反应B.反应③为
C.此方法得到产品NH3、O2和LiOHD.理论上,整个转化过程无需补充水
【答案】B
【详解】A、反应①为LiOH在通电情况下生成Li、O2和H2O,符合一变多,属于分解反应;反应②为Li和N2反应生成Li3N,符合多变一属于化合反应,选项错误;
B、由流程可知,反应③为Li3N和H2O反应生成LiOH和NH3,反应的化学方程式为:,选项正确;
C、LiOH既是①的反应物也是③的生成物,是可循环利用的物质,不属于此方法得到的产品,选项错误;
D、由通电分解LiOH的方程式,可知4LiOH转化成2H2O,由Li3N和H2O反应生成LiOH和NH3的方程式,可知3H2O转化成3LiOH,即需要4H2O才能转化成4LiOH,理论上,整个转化过程需补充水,选项错误;
故选B。
10.氢气是重要的化工原料,如图是通过热化学循环用硫化氢气体(H2S)制备氢气的模拟工艺流程。下列说法中错误的是
A.吸收室中只发生了物理变化
B.反应室中发生的化学反应中I元素的化合价发生了改变
C.上述流程中可以循环利用的物质是H2SO4或I2
D.产品室中发生反应的化学方程式为
【答案】A
【详解】A、由流程图知,吸收室中有新物质生成,吸收室中发生了化学变化,故A符合题意;
B、反应室中发生的化学反应中,反应前I2中的I元素化合价为0,反应后HI中的I元素化合价为-1,故B不符合题意;
C、反应室中生成的硫酸可以再参加吸收室中的反应,产品室中生成的I2可以再参加反应室中的反应,可以循环利用的物质是硫酸、I2,故C不符合题意;
D、产品室中发生反应的化学方程式为,故D不符合题意。
故选A。
11.氨气长期以来作为化肥工业的重要原料,实际上氨气还是一种较为理想的清洁能源。下列是氨气与氧气反应的微观示意图。
试根据上述微观示意图,写出该反应的化学方程式 ;该反应过程中生成物涉及到的单质的化学式为 。
【答案】 N2
【解析】该反应是氨气和氧气在点燃的条件下反应生成氮气和水,化学方程式为。
单质是由同种元素组成的纯净物,生成物中氮气是单质,化学式N2。
12.配平下列化学方程式
(1) Cu+ HNO3(浓)= Cu(NO3)2+ NO2↑+ H2O
(2) Cu+ HNO3(稀)= Cu(NO3)2+ NO↑+ H2O
【答案】(1) 1 4 1 2 2
(2) 3 8 3 2 4
【详解】(1)利用待定系数法配平,分别设铜的化学计量数为x、硝酸的化学计量数为2y,NO2前面系数为z,根据反应前后原子个数不变,首先使反应前后,铜原子、氢原子个数相等,则可得:,根据反应前后氮原子个数相等,列出方程:2y=2x+z,根据反应前后氧原子个数相等,列方程:6y=6x+2z+y,解此方程组,可得y=2x,z=2x,代入方程式,约去x,可得:;
(2)利用待定系数法配平,分别设铜的化学计量数为a、硝酸的化学计量数为2b,NO前面系数为c,根据反应前后原子个数不变,首先使反应前后,铜原子、氢原子个数相等,则可得:,根据反应前后氮原子个数相等,列出方程:2b=2a+c,根据反应前后氧原子个数相等,列方程:6b=6a+c+b,解此方程组,,,代入方程式,约去a,两边均乘以3,可得:。
13.科学家预言未来最理想的能源是绿色植物,即将绿色植物的秸秆[主要成分的化学式为(C6H10O5)n]和水在适当的催化剂等条件作用下生成葡萄糖(化学式为C6H12O6),再将葡萄糖在一定条件下转化为乙醇(化学式为C2H5OH,是一种良好的燃料),同时放出二氧化碳。试写出上述两步转化的化学方程式:
(1) 。
(2) 。
【答案】 (C6H10O5)n+nH2OnC6H12O6 C6H12O62C2H5OH+2CO2
【详解】(1)绿色植物的秸秆[主要成分的化学式为(C6H10O5)n]和水在适当的催化剂等条件作用下生成葡萄糖(化学式为C6H12O6) ,反应的化学方程式为:(C6H10O5)n+nH2O nC6H12O6
(2)葡萄糖在一定条件下转化为乙醇(化学式为C2H5OH,是一种良好的燃料),同时放出二氧化碳,反应的化学方程式为:C6H12O62C2H5OH+2CO2
14.甲醇(化学式CH4O)被称为“液态阳光”,也是重要的化工原料。如下图环节1、环节2所示是合成甲醇的生产流程。试回答问题:
(1)环节1发生化学反应的基本类型是 。与电解水法相比,该方法制取氢气最显著的优点是 。
(2)环节2反应中,参加反应的H2与CO2的分子个数比是 。
(3)2023年杭州亚运会主火炬使用“低碳甲醇”作为燃料。写出甲醇在空气中完全燃烧的化学方程式是 。
(4)甲醇可进一步转化为甲醛(CH2O),其中一种转化方法如图甲所示。
①反应Ⅰ中,甲醇与氧气发生反应的化学方程式是 。
②为使甲醇持续转化为甲醛,反应Ⅱ需补充H2O2,理论上需补充的H2O2与反应Ⅰ中生成的H2O2的分子个数比是:n(需补充H2O2):n(反应Ⅰ生成H2O2) 。
【答案】(1) 分解反应 节约电能
(2)3:1
(3)
(4) 1:1
【详解】(1)环节1发生化学反应是水在光照、催化剂条件下反应生成氢气和氧气,一种物质参与反应生成多种物质的反应叫做分解反应,该反应基本类型是分解反应。与电解水法相比,该方法制取氢气最显著的优点是节约电能。
(2)H2与CO2在催化剂条件下反应生成甲醇和水,该反应化学方程式:,参加反应的H2与CO2的分子个数比=3:1。
(3)甲醇在空气中完全燃烧生成二氧化碳和水,该反应化学方程式:。
(4)①反应Ⅰ中甲醇与氧气发生反应生成过氧化氢和甲醛,该反应化学方程式:。
②反应Ⅰ由甲醇(CH4O)、O2反应生成甲醛(CH2O)、H2O2,化学方程式为:。反应Ⅱ由H2O2反应生成O2、H2O,化学方程式为:,根据这两个化学方程式,总反应方程式为:,则产生1个CH2O分子需要消耗1个H2O2分子,而反应Ⅰ产生1个CH2O分子的同时产生1个H2O2分子,所以理论上需补充的H2O2与反应Ⅰ中生成的H2O2的分子个数比是:n(需补充H2O2):n(反应Ⅰ生成H2O2)=1∶1。
1.理解化学方程式的意义,学会配平化学方程式。
2.学会化学方程式的配平,并正确书写的化学方程式。
重点:
化学方程式的书写
难点:
配平化学方程式
化学方程式的意义
以C + O2 点燃 CO2为例
意义
读法
质的方面
表示反应物、生成物和反应条件
反应物:C和O2(或碳和氧气)
生成物:CO2(或二氧化碳)
反应条件:点燃
碳和氧气在点燃的条件下反应生成二氧化碳
量的方面
物质质量关系
表示反应物、生成物各物质的质量比
C + O2 点燃 CO2
相对质量: 12 32 44
碳、氧气、二氧化碳的质量比为12:32:44
在点燃的条件下,每 12 份质量的碳和 32 份质量的氧气恰好完全反应,生成44份质量的二氧化碳
粒子数目关系
表示反应物、生成物各物质的微观粒子个数比
参加反应的各微观粒子的个数比为 1:1:1
在点燃的条件下,每 1 个碳原子和 1 个氧分子恰好完全反应,生成 1 个二氧化碳分子
化学计量数
化学方程式中化学式前面的数字,表示发生反应时的微观粒子个数比
获得的信息
以2H2 + O2 点燃 2H2O为例
以Fe + CuSO4 FeSO4 + Cu为例
定性角度
反应物
H2和O2(或氢气和氧气)
Fe和 CuSO4
生成物
H2O(或水)
FeSO4和Cu
反应条件
点燃
无
基本反应类型
化合反应
暂时未学
获得的信息
2H2 + O2 点燃 2 H2O
4 32 36
Fe + CuSO4 FeSO4 + Cu
56 160 152 64
定量角度
各物质的质量比
氢气、氧气、水的质量比为4:32:36
铁、硫酸铜、硫酸亚铁和铜的质量比为56:160:152:64
各物质的微观粒子个数比
氢气、氧气、水的分子个数比为2:1:2
反应的铁、硫酸铜、硫酸亚铁和铜的“微观粒子个数比”为1:1:1:1
反应前后物质质量总和守恒
反应前:4+32=36
反应后:36
反应前:56+160=216
反应后:152+64=216
反应前后各原子数目守恒
氢原子数:反应前4,反应后4
氧原子数:反应前2,反应后2
铁、硫、铜原子数:反应前1,反应后1
氧原子数:反应前4,反应后4
步骤
内容
举例
描述反应事实
在式子的左、右两边写出反应物和生成物的化学式,如果反应物或生成物不止一种,就分别用加号把它们连接起来;
P + O2 点燃 P2O5
在反应物和生成物之间画一条短线,在短线上注明化学反应发生的条件,如加热(常用“△”号表示)、点燃、催化剂等。
配平化学方程式
检查式子左、右两边各元素原子的种类和数目,通过选取合适的化学计量数,使化学方程式遵守质量守恒定律,将短线改为等号。
4P+5O2 点燃 2P2O5
如果生成物中有气体,在气体物质的化学式右边要注“↑”号;对于溶液中的反应,如果生成物中有固体,在固体物质的化学式右边要注“↓”号。
2KMnO4 ∆ K2MnO4+MnO2+O2↑
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
配平方法
适用范围
步骤
最小公倍数法
适用于化学方程式两边某元素各出现一次的。
找出两边各出现一次的元素,选择同种原子的个数最多的原子,求最小公倍数,得分子个数;
使该原子数目在反应前后都为所求出的最小公倍数;
一般先从氧原子入手,再配平其他原子。
KClO3——KCl+ O2 ;Al + Fe3O4—— Fe + Al2O3
观察法
一般均可用
从化学式较复杂的一种生成物(反应物)推求有关反应物(生成物)化学式的化学计量数和这一生成物的化学计量数;
根据求得的化学式的化学计量数,再找出其它化学式的相应计量数,这样即可配平。
Fe2O3+ CO——Fe + CO2 ;H2 O + Fe —— Fe3 O4+ H2
奇数配偶法
适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶。
找出在化学反应中出现次数最多的元素;
从原子数为单数的元素入手(一般为氧元素),即乘2;
由已推求出的化学计量数决定其它化学式的化学计量数。
C2 H2 +O2 ——CO2 +H2 O ;O2 ——Fe2O3 + SO2
分数配平法
能配平有单质参加反应或有单质生成的化学反应。
先配平化合物中各元素的原子;
用分数配平单质元素的原子;
去分母,使配平后的化学计量数为整数。
C2H2 + O2—— CO2+ H2O ;
C2H5OH + O2 —— CO2 + H2O
定一法
有机物与氧气的反应
找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数。若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数。一般来说,观察和配平的顺序为:有氢看氢,无氢看氧,原子团优先配平,单质最后配平。
CH3OH+O2——H2O+CO2;C2H5OH+O2——H2O+CO2
相关学案
这是一份初中化学人教版(2024)九年级上册(2024)第五单元 化学反应的定量关系课题2 化学方程式导学案及答案,共50页。学案主要包含了化学方程式及意义,化学方程式的书写,根据信息书写化学方程式等内容,欢迎下载使用。
这是一份初中化学人教版九年级上册课题 3 利用化学方程式的简单计算学案设计,共4页。学案主要包含了学习目标,自主探究,自我测评等内容,欢迎下载使用。
这是一份初中人教版课题 2 如何正确书写化学方程式学案设计,共3页。学案主要包含了学习目标,自主探究,自我测评[来等内容,欢迎下载使用。










