











所属成套资源:【新教材新课标】鲁教版化学九年级下册教学课件+分层练习
鲁教版(2024)九年级下册(2024)第一节 酸及其性质优秀ppt课件
展开
这是一份鲁教版(2024)九年级下册(2024)第一节 酸及其性质优秀ppt课件,文件包含大单元教学第四单元第2课《活灵活现》第1课时精品课件30页pptx、大单元教学四单元第2课《活灵活现》第2课第1课时教学设计doc等2份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
在日常生活中,我们经常会接触一些有酸味的物质,如食醋、西红柿、柠檬汁等。化学家研究了这些物质,发现这些物质中都含有在水溶里能解离出氢离子(H+)的化合物。化学上把在水溶液里解离出的阳离子全部是氢离子(H+)的化合物称为酸。
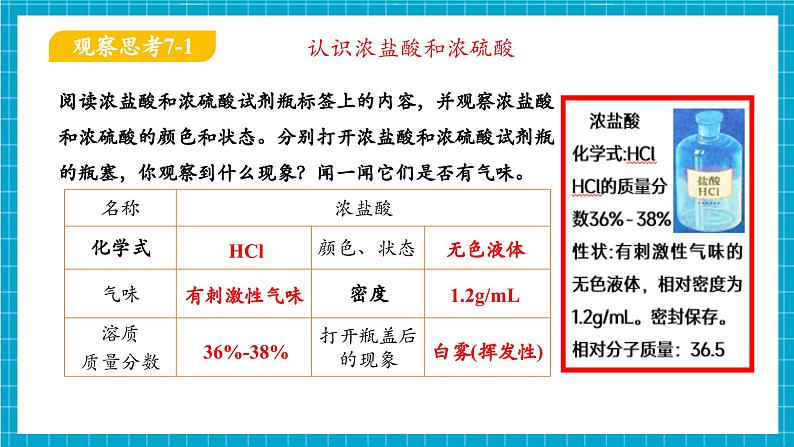
浓盐酸和浓硫酸是化学实验室中常见的酸
阅读浓盐酸和浓硫酸试剂瓶标签上的内容,并观察浓盐酸和浓硫酸的颜色和状态。分别打开浓盐酸和浓硫酸试剂瓶的瓶塞,你观察到什么现象?闻一闻它们是否有气味。
浓盐酸(敞口置于空气中,瓶口有白雾)具有挥发性,有强烈的腐蚀性。
无色、黏稠、油状的液体
吸水性(物理性质):能吸收空气及其他物质中的水分,使硫酸变稀。
可用来干燥一些气体(O2、N2、CO2、H2等),在多功能瓶中装入浓硫酸,气体长进短出
强腐蚀性和脱水性(化学性质):
浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 (氢、氧元素), 生成黑色的炭和水
浓硫酸有很强的吸水性,溶于水放出大量的热量。稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢注入水中,并且不断搅拌。切不可将水倒进浓硫酸里!
【问题思考】通过学习,你有哪些方法可以鉴别 浓硫酸与浓盐酸?
1.振荡观察,液体为黏稠、油状的是浓硫酸;2.打开瓶塞,有刺激性气味及白雾生成的是浓盐酸;3.取少量液体加入水中,放出大量热的是浓硫酸。
物质的性质是由物质的组成和结构决定,酸的化学性质就是由氢离子决定的
盐酸能与哪些物质发生化学反应
1.在两支试管中分别加入少量稀盐酸,然后分别滴加紫色石蕊试液和无色酚酞试液,观察现象。
2.向盛有生锈铁钉的试管中加入少量稀盐酸,观察现象;待铁锈除尽后再加入少量稀盐酸,观察现象。
铁锈逐渐溶解,溶液由无色变为黄色
铁钉表面产生气泡,溶液变为浅绿色
实验证明,盐酸可以使紫色石蕊试液变红色;常温下,盐酸与铁锈[主要成分为氧化铁(Fe2O3)]发生反应,还能与除锈后的铁钉发生反应。
化学反应原理:Fe2O3 + 6HCl = 2FeCl3 + 3H2O (氯化铁) Fe3+(铁离子)的颜色为浅黄色Fe + 2HCl = FeCl2+ H2↑ (氯化亚铁) Fe2+(亚铁离子)的颜色为浅黄色
3.向碳酸钠粉末中分别加入少量稀盐酸和稀硫酸,观察现象。
剧烈反应,产生大量气泡
化学反应原理:2HCl+Na2CO3=2NaCl+H2O+CO2↑H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
若用稀硫酸代替稀盐酸,重复活动探究7-1的实验,你观察到了哪些现象? 1.请写出有关化学方程式。 Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O Fe + H2SO4 = FeSO4 + H2↑
结论:用硫酸进行实验,现象与用盐酸实验现象相同
2.实验小组的同学得出了这样的结论:酸具有相似的化学性质。
(1)能使紫色石蕊试液变红;(2)能与某些金属氧化物反应,生成盐和水;(3)能与某些金属反应,生成盐和氢气;(4)能与部分盐反应,生成新盐和新酸。
【问题思考】为什么酸具有相似的化学性质?
酸的化学性质相似的微观解析
酸溶于水时,都能解离出共同的阳离子——氢离子(H+) ,正是由于氢离子的存在,导致它们具有一些相似的化学性质。
当然,由于不同的酸溶于水时解离出的酸根阴离子不同,其性质也存在差异。例如,硫酸能与氯化钡(BaCl2)反应,生成白色的硫酸钡(BaSO4)沉淀,而盐酸不能与氯化钡发生反应。
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
【问题思考】试写出硫酸与硝酸钡(Ba(NO3)2)反应的化学方程式,并思考硝酸能否与硝酸钡发生反应?
HCl + BaCl2 = 不反应
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
像BaCl2、FeCl3、BaSO4、CaCO3等均是由金属阳离子和酸根阴离子构成的化合物,化学上把这类化合物称为盐。
由于铵根离子(NH4+)与金属阳离子化学性质相似,所以由铵根离子和酸根阴离子构成的化合物也属于盐,统称为铵盐。 例如:NH4NO3、 NH4Cl、(NH4)2SO4、 NH4HCO3等。
NaHCO3、 NaHSO4、Mg(OH)Cl、Cu2(OH)2CO3等化合物都含有金属离子和酸根阴离子,也是盐。
重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等浓硫酸有吸水性,在实验室中常用它做干燥剂
重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等人体胃液中有盐酸,可帮助消化
1.图是物质M溶于水发生解离的微观示意图。能说明M一定是酸的是 ( )
2.下列有关硫酸的认识或做法,正确的是( )A.组成:硫酸溶液中H+和SO42-的数目相同B.性质:能与CO2、SO2等非金属氧化物反应C.用途:用于生产化肥、农药、火药、染料等D.生产:含硫酸的工业废水,用CaCl2处理后直接排放
3.思维导图是知识整理的重要工具,如图是某思维导图的一部分,可以填入括号中的是( )A.能与活泼非金属反应B.能与某些酸反应C.能与非金属氧化物反应D.能与某些盐反应
4.从物质的组成角度解释酸具有酸的通性的原因是( )A.酸都能电离出H+ B.酸都含有酸根C.酸中都含有氢元素 D.酸中都含有氧元素
5.实验室有两瓶失去标签的无色溶液,分别是稀盐酸和稀硫酸。下列物质能区分两瓶溶液的是( )A.紫色石蕊试液 B.生锈的铁钉C.氢氧化钠溶液 D.氯化钡溶液
6. “酸”对我们来说一定不陌生。下列说法正确的是( )A.稀盐酸不能用于除铁锈 B.浓硫酸具有腐蚀性C.浓盐酸没有挥发性 D.稀盐酸能使无色酚酞溶液变红
7.下列不属于稀盐酸与稀硫酸共有的化学性质的是( )A.能与碳酸钠反应放出二氧化碳B.能与锌反应放出氢气C.能与氯化钡溶液反应生成白色沉淀D.能与氢氧化铁反应生成有色溶液
8.硫酸是重要的化工原料。下列有关硫酸的说法错误的是( )A. 浓硫酸具有吸水性 B. 稀硫酸能与纯碱反应C. 浓硫酸稀释后温度降低 D. 稀硫酸可用于金属表面除锈
9.硫酸和盐酸是实验室、化工生产中常用的两种重要的酸。(1)其中具有挥发性的酸是 。(2)将紫色石蕊溶液滴入稀硫酸中,溶液变为 色。(3)两种酸都可用于金属除锈,请写出盐酸除铁锈的化学方程式: 。
Fe2O3+6HCl=2FeCl3+3H2O
10.硫酸是一种常见的酸,完成下列问题。(1)实验室浓硫酸稀释的方法是 。(2)为研究稀硫酸的化学性质,某同学进行了如下实验。 实验中,有气泡产生的反应的化学方程式是 ,溶液有颜色变化的是 (填序号),E试管中观察到的现象是 。
将浓硫酸沿烧杯壁缓慢注入水中,并用玻璃棒不断搅拌
Zn+H2SO4=ZnSO4+H2↑
1.酸:解离时生成的阳离子全部是氢离子的化合物2.浓盐酸、浓硫酸的物理性质及特性(1)浓盐酸的挥发性(2)浓硫酸的吸水性、腐蚀性;浓硫酸的稀释3.酸的化学性质(1)能使紫色石蕊试液变红(2)能与某些金属氧化物反应,生成盐和水(3)能与某些金属反应,生成盐和氢气(4)能与部分盐反应,生成新盐和新酸4.盐:由金属离子和酸根阴离子构成的化合物(铵盐由铵根离子和酸根阴离子构成的化合物)5.常见酸的用途
相关课件
这是一份鲁教版(2024)九年级下册(2024)第一节 酸及其性质完美版课件ppt,文件包含第四节酸碱中和反应同步课件pptx、第四节酸碱中和反应分层练习原卷版docx、第四节酸碱中和反应分层练习解析版docx等3份课件配套教学资源,其中PPT共35页, 欢迎下载使用。
这是一份初中化学鲁教版(2024)九年级下册(2024)第一节 酸及其性质完美版ppt课件,文件包含第三节溶液的酸碱性同步课件pptx、第三节溶液的酸碱性分层练习原卷版docx、第三节溶液的酸碱性分层练习解析版docx等3份课件配套教学资源,其中PPT共35页, 欢迎下载使用。
这是一份初中化学鲁教版(2024)九年级下册(2024)第一节 酸及其性质精品ppt课件,文件包含第二节碱及其性质同步课件pptx、第二节碱及其性质分层练习原卷版docx、第二节碱及其性质分层练习解析版docx等3份课件配套教学资源,其中PPT共32页, 欢迎下载使用。











