










所属成套资源:【新教材新课标】鲁教版化学九年级下册教学课件+分层练习
【新教材新课标】鲁教版化学九年级下册第7单元《认识酸和碱》(复习课件+分层练习)
展开
这是一份【新教材新课标】鲁教版化学九年级下册第7单元《认识酸和碱》(复习课件+分层练习),文件包含第七单元认识酸和碱复习课件pptx、第七单元认识酸和碱分层练习原卷版docx、第七单元认识酸和碱分层练习解析版docx等3份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
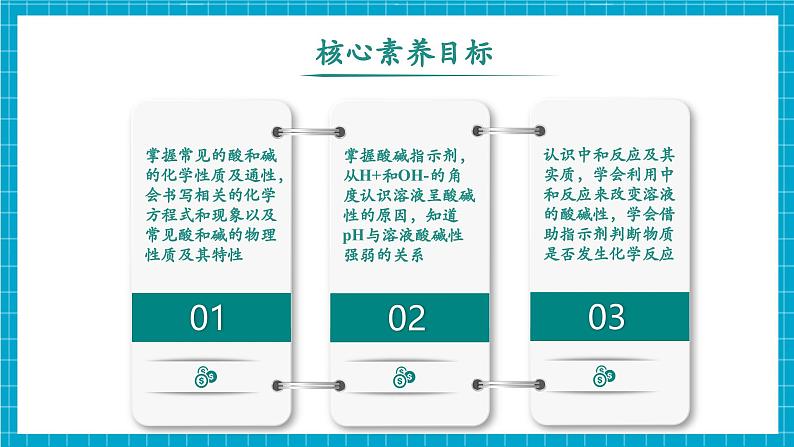
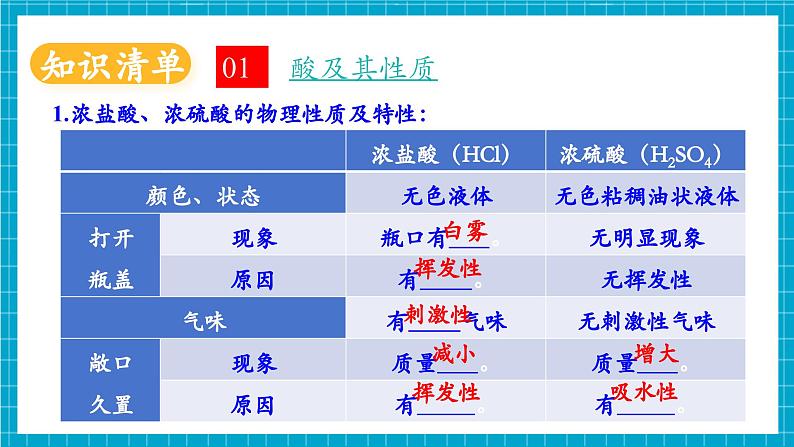
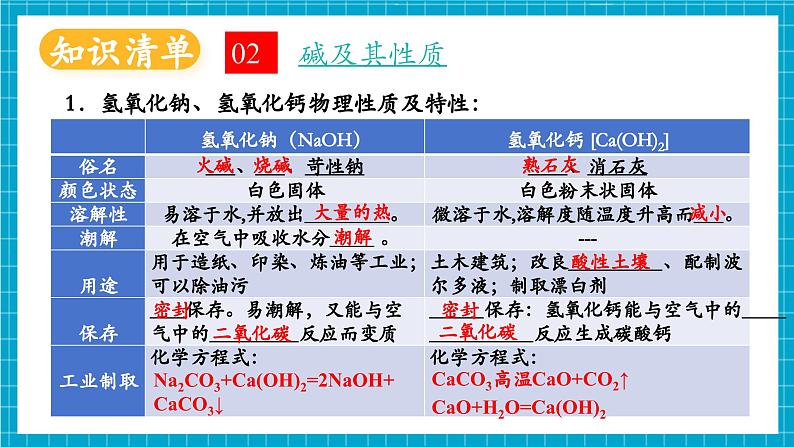
单元知识复习认识酸和碱酸及其性质溶液的酸碱性碱及其性质常见的酸酸的化学性质常见的碱浓盐酸:挥发性、刺激性气味、腐蚀性能使紫色石蕊试液变蓝,使无色酚酞试液变红能与某些非金属氧化物反应,生成盐和水能与部分盐反应,生成新盐和新酸浓硫酸:吸水性、腐蚀性、浓硫酸的稀释能使紫色石蕊试液变红能与某些金属氧化物反应,生成盐和水能与某些金属反应,生成盐和氢气能与部分盐反应,生成新盐和新酸碱的化学性质氢氧化钠:易潮解、易溶于水放热、腐蚀性、俗称氢氧化钙:微溶于水、俗称、制取(生石灰与水反应)酸碱指示剂:石蕊-酸红碱蓝,酚酞-酸无碱红pH:pH<7酸性,pH=7中性;pH>7碱性酸碱中和反应中和反应:酸+碱→盐+水 H++OH-→H2O中和反应的应用:医药卫生、土壤改良、处理废水、调节酸碱性1.浓盐酸、浓硫酸的物理性质及特性:酸及其性质01白雾挥发性刺激性挥发性减小吸水性增大2.浓硫酸:(1)浓硫酸溶于水,放出 。切不可把 直接倒入 中,否则会造成液滴四处飞溅。稀释浓硫酸时要把 沿烧杯内壁,缓慢倒入 中,并用玻璃棒不断搅拌。(2)浓硫酸具有强烈的 。如果不慎将浓硫酸沾到皮肤或衣物上,应立即用 冲洗,然后涂上 溶液。水浓硫酸水腐蚀性大量的热3%--5%的碳酸氢钠大量水浓硫酸3.酸的化学性质:(1)能使紫色石蕊试液变 色,不能使无色酚酞试液变色;(2)酸+金属→ ; Fe+2HCl= +H2↑ Fe+H2SO4= +H2↑现象:铁表面有 产生,溶液由无色逐渐变为 色(Fe2+的盐溶液呈 色)(3)酸+金属氧化物→ ;Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4= +3H2O现象:铁锈逐渐溶解消失,溶液由无色逐渐变成 色(Fe3+的盐溶液呈 色)盐+氢气FeCl2红气泡FeSO4浅绿盐+水Fe2(SO4)3黄黄浅绿(4)酸+盐→ ;CaCO3+2HCl= +CaCl2现象:固体逐渐溶解,产生 。(碳酸盐与酸反应生成水和二氧化碳)4.酸的通性及差异:(1)酸具有相似的化学性质,是因为在溶于水是都能解离出 ;(2)不同的酸溶于水时解离出的 不同,其性质也存在差异。 硫酸与氯化钡能反应生成白色沉淀,而盐酸不与氯化钡发生反应。BaCl2+H2SO4= +2HCl5.常见酸的用途:盐酸-制药、作除锈剂等;硫酸-生产化肥、农药等新酸+新盐气泡H2O+CO2↑酸根阴离子H+BaSO4↓碱及其性质021.氢氧化钠、氢氧化钙物理性质及特性:碳氢CO2H2O石油中各成分的沸点不同火碱烧碱熟石灰大量的热减小潮解酸性土壤密封密封二氧化碳二氧化碳Na2CO3+Ca(OH)2=2NaOH+CaCO3↓CaCO3高温CaO+CO2↑CaO+H2O=Ca(OH)22. 氢氧化钠:(1)氢氧化钠吸收空气中水分发生潮解,属于 变化,氢氧化钠具有吸水性,可做 ,能干燥 气体,如H2、O2、N2、CO、CH4等和NH3等 气体,不能干燥CO2、SO2、SO3、HCl、NO2等 气体。氢氧化钠和生石灰混合成碱石灰也是常用的干燥剂。(2)氢氧化钠具有强 性,如果不慎将碱液沾到皮肤上,要用 冲洗,再涂上 溶液。物理干燥剂中性碱性酸性腐蚀大量的水硼酸3.碱的化学性质:(1)与酸碱指示剂的反应:使紫色石蕊试液变 色,使无色酚酞试液变 色;(2)非金属氧化物+碱→ ; 2NaOH+CO2= +H2O Ca(OH)2+CO2= +H2O试写出氢氧化钠溶液和二氧化硫的反应化学方程式 。(3)碱+盐→新碱+新盐2NaOH + MgCl2 = + 2NaCl 蓝红盐+水CaCO3↓Na2CO3Mg(OH)2↓2NaOH+SO2=Na2SO3+H2O4.碱的通性及差异:(1)碱具有相似的化学性质,是因为在溶于水是都能解离出 ;(2)不同的碱溶于水时解离出的 不同,其性质也存在差异。 氢氧化钙与碳酸钠能反应生成白色沉淀,而氢氧化钠不与碳酸钠发生反应。化学方程式:Ca(OH)2+Na2CO3= +2NaOH5.常见碱的用途:氢氧化钠-用于造纸、印染、炼油、生产化学纤维、生产橡胶等;氢氧化钙-用于生产农药、漂白剂、土木建筑、改良 等。阳离子OH-CaCO3↓酸性土壤溶液的酸碱性031.如何检验溶液的酸碱性:(1)酸溶液中都含有大量的H+,表现出酸性;(2)碱溶液中都含有大量的OH-,表现出碱性。紫色石蕊试液遇到酸性溶液变成 色,遇到碱性溶液变为 色;无色酚酞试液遇到酸性溶液 色,遇到碱性溶液变为 色;紫色石蕊试液和无色酚酞试液遇到中性溶液 色。红红蓝不变不变2.怎样判断溶液酸碱性的强弱:化学上用pH表示溶液酸碱性的强弱程度,pH的数值通常在0和14之间。通常用pH试纸来粗略测定溶液的pH,pH值为 。pH 7的溶液呈酸性,pH越小,溶液的酸性越 ;pH 7时,溶液呈中性;pH 7的溶液呈碱性,pH越大,溶液的碱性越 。注意事项:(1)pH试纸不能 ,溶液会被稀释;(2)不能把pH试纸 中,会污染溶液。强整数<=用水湿润>强直接浸入待测液酸和中和反应041.中和反应:(1)定义: 和 作用生成 和 的反应。(2)表达式: + → + 实质: 。(3)验证中和反应发生的方法:①看酸碱指示剂变色情况, 说明酸碱能发生反应;②测定溶液的pH,溶液的的 说明酸碱发生反应;③测量酸碱溶液混合前后的温度, 说明酸碱发生反应。盐酸碱水H+ + OH- → H2O盐酸碱水指示剂变色pH出现酸碱性转化温度升高2.中和反应的应用:(1)溶质的分析①当滴入盐酸较少时,溶液中氢氧化钠有剩余,溶液呈碱性,pH>7;A点溶质为: 。②当滴入氢氧化钠溶液与HCl恰好完全反应时,溶液显中性,pH=7;B点溶质为: 。③当滴入盐酸过量时,溶液中盐酸有剩余,溶液显酸性,pH







